| |
| Med Sci (Paris). 2010 August; 26(8-9): 713–718. Published online 2010 August 15. doi: 10.1051/medsci/2010268-9713.La double vie de la sérotonine ou quand la génétique découvre la physiologie Franck Oury1 and Gérard Karsenty1* 1Columbia University, Department of Genetics and Development, HHSC 701 W 168th Street, New York, NY 10032, États-Unis |
On peut proposer deux définitions, non exclusives et complémentaires, de la physiologie. La plus récente est l’étude intracellulaire, moléculaire et forcément réductrice des événements de signalisation qui déterminent une fonction physiologique donnée. La seconde définition, plus classique, est l’étude des signaux extracellulaires, hormonaux ou neuronaux, à l’origine des grandes fonctions physiologiques. Cette dernière vision de la physiologie, imposant une étude chez l’animal entier, a été réactualisée par l’avènement de la génétique moléculaire chez la souris. En effet, la possibilité d’invalider un seul gène, si possible dans un seul type cellulaire, a permis de découvrir durant les vingt dernières années de nombreuses fonctions physiologiques dont l’existence même était insoupçonnée. Nous en citerons trois qui n’auraient sans doute pas pu être découvertes autrement : le rôle du tissu adipeux dans le contrôle de l’appétit [
1,
2], la régulation de la masse osseuse par le cerveau [
3–
5] et la régulation du métabolisme énergétique par le squelette [
6]. Ces récentes découvertes suggèrent que de nombreuses autres voies physiologiques restent encore insoupçonnées. |
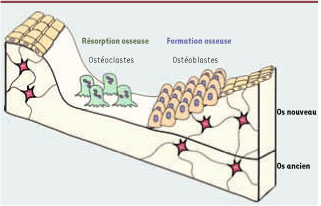
La physiologie du squelette et les contraintes du réel L’importance d’une approche génétique pour comprendre la physiologie est parfaitement illustrée par l’étude des fonctions du squelette, un des derniers organes à apparaître durant l’évolution. Comme chaque organe, le squelette a un certain nombre de particularités qui définissent ce que peut être sa physiologie. Deux d’entre elles sont particulièrement importantes pour notre propos. Tout d’abord, le squelette est, avec la peau, l’organe qui couvre le plus de surface chez les vertébrés. Ensuite, un constituant du squelette, le tissu osseux, abrite un type cellulaire, l’ostéoclaste, dont la seule fonction est précisément de détruire le tissu osseux. Il s’agit là, pour ainsi dire, d’une réaction auto-immune physiologique. La destruction du tissu osseux par les ostéoclastes est au centre de deux fonctions physiologiques essentielles, le modelage et le remodelage osseux, dont l’importance est évidente si on les place dans un contexte d’évolution. Durant le modelage comme le remodelage osseux, il y a une destruction quotidienne du tissu osseux par les ostéoclastes suivie de la formation d’un nouveau tissu osseux par les ostéoblastes [
7]. Quand ces deux phases se succèdent durant l’enfance, c’est le modelage osseux nécessaire à la croissance longitudinale du squelette. Après la fin de la puberté, la succession de ces deux phases définit le remodelage osseux. C’est le mécanisme par lequel les vertébrés renouvellent leur squelette. Par cette succession de destruction et de réparation, le remodelage osseux permet également la réparation des fractures et donc un maintien de la mobilité [
8]. En fait, jusqu’au XIXe siècle, c’était probablement le seul moyen de réparer la majorité des fractures. En toute objectivité et sans comparer l’intérêt intellectuel que ces deux fonctions peuvent susciter, maintenir la mobilité des individus a été plus important tout au long de l’évolution et jusqu’à il y a encore peu d’années que de contrôler l’appétit.  | Figure 1
Le remodelage osseux. Le remodelage osseux est un processus complexe et dynamique qui permet un perpétuel renouvellement du tissu osseux. Il repose sur un équilibre précis entre deux mécanismes cellulaires : la résorption et la formation osseuses. La résorption osseuse est le fait des ostéoclastes qui détruisent la matrice osseuse minéralisée préexistante. La formation osseuse repose sur un autre type cellulaire : les ostéoblastes, qui forment la nouvelle matrice collagénique. |
Cette succession permanente de destruction et de formation qui caractérise le remodelage osseux requiert un flot constant d’énergie vers les ostéoblastes et les ostéoclastes. Le fait que modelage et remodelage aient lieu chaque jour à plusieurs dizaines d’endroits ne fait qu’augmenter le coût énergétique de ces fonctions. C’est cette vue de la physiologie osseuse qui nous a amenés à émettre l’hypothèse d’un contrôle commun, possiblement endocrinien, de la masse osseuse et du métabolisme énergétique. Dans la logique de cette hypothèse, cette possible corégulation est rendue nécessaire par les besoins énergétiques du squelette. Dès lors, les hormones impliquées doivent apparaître au cours de l’évolution avec le squelette et non avec le métabolisme énergétique. L’expérimentation animale vérifia que c’est bien le cas. Une seule hormone est connue pour réguler de façon importante le métabolisme énergétique et apparaître au cours de l’évolution simultanément au tissu osseux : la leptine, une hormone sécrétée par les adipocytes, qui inhibe l’appétit et accroît la dépense énergétique [1, 2]. Ces particularités font qu’elle est souvent présentée, à tort, comme l’hormone de l’appétit. En effet, l’appétit existe et il est régulé chez les invertébrés tels que C. elegans et la drosophile [
9,
10]. Si une hormone contrôle l’appétit, elle devrait, en toute logique, apparaître durant l’évolution en même temps que cette fonction et non pas des millions d’années après. Or, au cours de l’évolution, la leptine apparaît avec les vertébrés [
11,
12]. Si la leptine n’est pas l’hormone de l’appétit, quel est son rôle physiologique ? Encore une fois, en utilisant l’évolution comme guide, on peut postuler qu’une hormone, comme c’est le cas de tout gène de régulation, apparaît de façon concomitante à la ou les fonction(s) qu’elle régule. De façon remarquable, même si la leptine est synthétisée dans les adipocytes, elle apparaît durant l’évolution avec le squelette et plus généralement avec la capacité de modeler et remodeler le tissu osseux. Non seulement elle émerge avec ces fonctions mais elle en est un des plus importants régulateurs. En fait, la leptine, confortant la notion que la masse osseuse et le métabolisme énergétique sont corégulés, inhibe à la fois l’appétit et la masse osseuse. Elle remplit ces deux fonctions via un relais cérébral dont la nature, qui reste très débattue, est l’un des deux sujets de cette revue. |
Comment la leptine corégule-t-elle l’appétit et la masse osseuse ? Le schéma proposé initialement, selon lequel la leptine pouvait agir directement sur les cellules osseuses, était contre-intuitif car toutes les fonctions de la leptine nécessitent un relais dans le cerveau. De fait, cette hypothèse était incorrecte. En effet, l’inactivation du récepteur de la leptine dans l’ostéoblaste n’affecte pas la masse osseuse alors que son inactivation dans les neurones reproduit le phénotype osseux observé chez les souris déficientes pour la leptine [
13]. Dès lors, l’étude du mode d’action de la leptine, que ce soit pour la régulation de l’appétit ou de la masse osseuse, bute depuis seize ans sur la même question : quelle est la cible de la signalisation de la leptine dans le cerveau ? Initialement, l’idée couramment acceptée était que la leptine agit dans l’hypothalamus. Des arguments en apparence très convaincants apportaient de l’eau au moulin de cette hypothèse. Le premier, vieux de soixante-dix ans maintenant, est que la destruction des neurones du noyau arqué dans l’hypothalamus induit chez le rat une hyperphagie identique à celle causée par l’absence de la leptine. La seconde est que le récepteur de la leptine est abondamment exprimé dans ces neurones et dans d’autres localisés dans l’hypothalamus. Une fois encore, un sort fut fait à ce dogme quand la génétique s’en est mêlée. En effet, la délétion du récepteur de la leptine dans les neurones de l’hypothalamus pressentis comme médiateurs de la régulation de la masse osseuse ou de l’appétit par la leptine n’affecte en rien ces deux fonctions [
14]. Comment réconcilier les résultats en apparence contradictoires obtenus en détruisant les cellules pour les uns ou en invalidant seulement le récepteur dans ces cellules pour les autres ? Ces résultats ne sont pas contradictoires, ils sont en fait complémentaires. En effet, ce qu’ils disent, et ils ne disent que cela, c’est que la leptine a besoin de l’intégrité des neurones du noyau ventromédial de l’hypothalamus (VMH) ou des noyaux arqués pour, respectivement, réguler la masse osseuse et l’appétit, mais qu’elle n’induit pas elle-même de signalisation dans ces neurones. Une telle interprétation de ces expériences implique donc que la leptine ne cible pas directement l’hypothalamus mais agit ailleurs dans le cerveau. C’est l’hypothèse que nous avons privilégiée car elle pouvait être testée. |
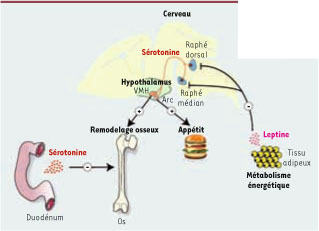
La leptine inhibe la sérotonine cérébrale La sérotonine est une bioamine dérivée du tryptophane, synthétisée par les cellules entérochromaffines du duodénum et par un petit groupe de neurones dans le cerveau postérieur. Un aspect remarquable de cette molécule est qu’elle ne traverse pas la barrière hématoméningée [
15]. Il est donc possible, comme nous l’avons fait, d’inhiber entièrement la synthèse de la sérotonine dans le cerveau sans affecter aucunement sa contrepartie périphérique, et vice-versa. La sérotonine synthétisée dans le cerveau est surtout connue comme un neurotransmetteur impliqué dans le contrôle de nombreuses fonctions cognitives. Cette fonction de neurotransmetteur de la sérotonine est si importante qu’il existe une classe de psychotropes inhibant la recapture de cette bioamine par les neurones et donc augmentant sa concentration dans la fente synaptique, ce qui compense le taux anormalement bas de sérotonine chez les sujets déprimés. Ces inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) sont maintenant très largement utilisés. Comme tout bon médicament, les ISRS ne sont pas dépourvus d’effets secondaires. L’un d’entre eux est de provoquer une perte osseuse chez les patients traités au long cours, l’autre est d’augmenter l’appétit [
16–
19]. Ces observations cliniques suggèrent que la sérotonine d’origine cérébrale pouvait bien être un régulateur de la masse osseuse et de l’appétit. Cette hypothèse fut testée en abrogeant la synthèse de la sérotonine dans le cerveau. Des souris dont le cerveau est incapable de synthétiser la sérotonine développent, outre des anomalies des fonctions cognitives, deux autres phénotypes : elles sont anorexiques et ostéoporotiques [
20]. Ces deux anomalies indiquaient que la sérotonine cérébrale est un régulateur positif de l’accroissement de la masse osseuse et de l’appétit. De façon remarquable, cette dernière fonction est conservée chez C. elegans et chez l’homme [
21]. L’inactivation de récepteurs de la sérotonine, ciblée de façon sélective dans divers noyaux de l’hypothalamus, permit de montrer que la sérotonine synthétisée dans le cerveau postérieur se lie au récepteur Htr2c présent dans les neurones du noyau VMH pour favoriser l’accroissement de la masse osseuse [20]. Elle le fait en entraînant une diminution de l’activité du système nerveux sympathique en périphérie. Par ailleurs, la sérotonine se lie également au récepteur Htr1a ou Htr2b sur les neurones des noyaux arqués de l’hypothalamus pour augmenter la synthèse de mélanocortine et, par l’intermédiaire de cette molécule, augmenter l’appétit [20]. Le fait que la sérotonine et la leptine exercent des influences opposées sur le remodelage osseux en utilisant pour cela le même médiateur périphérique, le système nerveux sympathique, suggère un modèle dans lequel la leptine préviendrait l’accroissement de la masse osseuse en inhibant la synthèse de sérotonine cérébrale. En parfait accord avec cette hypothèse, l’injection de leptine chez une souris sauvage diminue la synthèse de la sérotonine cérébrale et, à l’inverse, le niveau de sérotonine dans l’hypothalamus de souris déficientes en leptine est considérablement accru. Deux arguments génétiques ont achevé de démontrer que la leptine inhibe l’accroissement de la masse osseuse et l’appétit en inhibant la synthèse et la sécrétion de sérotonine par les neurones du tronc cérébral. Le premier est que la réduction de 50 % du contenu de sérotonine dans le cerveau suffit à corriger complètement le phénotype osseux et l’obésité observés chez les souris ob/ob, qui sont déficientes en leptine. Le second est que la délétion du récepteur de la leptine dans les neurones sérotonergiques reproduit l’hyperphagie et la masse osseuse élevée observées chez les souris ob/ob. La même délétion dans diverses populations neuronales n’a aucun effet [20].  | Figure 2
Fonctions de la sérotonine selon ses sources. A. Le tissu adipeux régule le remodelage osseux et l’appétit. La leptine, une hormone sécrétée par les adipocytes, traverse la barrière hématoméningée et inhibe la synthèse de sérotonine par les neurones des noyaux dorsal et médian du raphé du cerveau postérieur. Lasérotonine cérébrale est un neurotransmetteur qui active positivement la formation osseuse en activant les neurones du noyau ventral médian (VMH) de l’hypothalamus et régule positivement l’appétit en stimulant les neurones du noyau arqué (Arc) de l’hypothalamus. B. Le duodénum régule le remodelage osseux. Contrairement à la sérotonine cérébrale qui a la fonction d’un neurotransmetteur, la sérotonine duodénale est une hormone sécrétée par les cellules entérochromaffines et qui régule négativement la formation osseuse enagissant directement sur les ostéoblastes. |
|
Une autre sérotonine, une autre fonction La révélation que la sérotonine d’origine cérébrale influence de façon si puissante la masse osseuse et l’appétit était inattendue. La démonstration que la sérotonine d’origine digestive influence également le remodelage osseux de façon totalement différente le fut plus encore. Deux dysplasies du squelette ont été très étudiées dans les dix dernières années, en grande partie parce qu’elles sont toutes deux causées par des mutations différentes dans le même gène. Ces deux maladies sont l’ostéoporose avec pseudogliome, une forme pédiatrique et extrêmement grave d’ostéoporose se déclarant après la naissance et qui est associée à une cécité. L’autre maladie est le syndrome de masse osseuse élevée, une entité dont la manifestation clinique la plus intéressante est que les patients affectés ne développent pas d’ostéoporose [
22,
23]. Ces deux maladies génétiques, la première de transmission récessive autosomale et la seconde dominante, sont causées par des mutations dans le même gène, Lrp5 (LDL receptor related protein 5) codant pour une protéine présente à la surface des cellules et exprimée de façon quasi ubiquitaire. Dans le cas de l’ostéoporose avec pseudogliome, les mutations abrogent la fonction du gène. Dans le cas du syndrome de masse osseuse élevée, il s’agit d’une substitution d’un seul acide aminé qui probablement résulte en un gain de fonction. Une raison supplémentaire de s’intéresser à Lrp5 est que ce gène contrôle uniquement la formation osseuse. Dès lors, l’élucidation de son mécanisme d’action moléculaire devrait théoriquement déboucher sur un traitement anabolique de l’ostéoporose. |
Le mode d’action de Lrp5 in vivo : la quadrature du cercle Dès son identification, et en partie en raison de son homologie de séquence avec un corécepteur pour wingless chez la drosophile, Lrp5 a été considéré comme un corécepteur pour une famille de facteurs de croissance, les protéines Wnt [
24]. En conséquence, l’ostéoporose avec pseudogliome et le syndrome de masse osseuse élevée ont été considérés comme des maladies de cette voie de signalisation. De fait, notre travail s’est initialement inscrit dans cette ligne de pensée jusqu’au moment où, encore une fois, l’expérimentation génétique dans l’animal entier nous a montré que cela ne pouvait pas être le cas. Sans énumérer ici les détails forcément fastidieux proposés à l’appui d’une hypothèse non vérifiée, il suffit de mentionner ici qu’à l’inverse de l’invalidation de Lrp5, l’invalidation du signal Wnt dans les ostéoblastes n’affecte aucunement la formation osseuse [
25]. Plus encore, les gènes régulés dans les ostéoblastes par Lrp5 et par les protéines Wnt sont différents. Nous avons alors décidé de nous incliner devant les évidences génétiques et de rechercher un autre mode d’action pour Lrp5. Pour ce faire, et en l’absence de toute hypothèse de travail, nous avons pris comme point de départ une analyse d’expression génique tous azimuts en utilisant des puces à ADN. Cette analyse a montré rapidement que Tph1, le gène responsable de la synthèse de sérotonine dans le duodénum, était en fait le gène le plus surexprimé chez les souris Lrp5
−/−
. Bien sûr, rien de tout cela ne fut observé chez les souris dont la voie de signalisation Wnt était abrogée dans les ostéoblastes [
26]. Ce résultat initialement fortuit était pour nous une chance étant donné notre intérêt pour la biologie de la sérotonine. Ce qui était aussi remarquable, c’est qu’il suggérait que la sérotonine, qui encore une fois ne traverse pas la barrière hématoméningée, exerce une influence différente sur le remodelage osseux si elle agit comme neurotransmetteur (régulateur positif) ou comme - potentiellement - une hormone d’origine duodénale (régulateur négatif). Il s’agit peut-être d’un exemple unique d’une molécule dont l’influence sur une fonction donnée varie selon son lieu de synthèse. Nous avons pu démontrer relativement rapidement que : (1) le taux circulant de sérotonine est élevé chez les souris et les hommes chez lesquels Lrp5 est inactivé ; l’analyse des patients, initialement conduite dans notre laboratoire, a été ensuite confirmée par d’autres équipes de recherche ailleurs dans le monde ; (2) la sérotonine inhibe la prolifération des ostéoblastes ; (3) elle le fait après s’être liée à un récepteur spécifique sur ces cellules, le récepteur Htr1b ; (4) le taux circulant de sérotonine est diminué chez les souris et les hommes porteurs d’une mutation activatrice de Lrp5 [26]. Là encore, l’analyse des patients fut initialement conduite dans notre laboratoire mais elle a depuis été confirmée par d’autres. Rien ne nous préparait à ces résultats, si ce n’est, il faut le souligner, un certain agnosticisme suscité par notre impossibilité à démontrer que Lrp5 intervient dans la voie de signalisation des protéines Wnt. |
L’inhibition de la synthèse de sérotonine duodénale comme traitement de l’ostéoporose Il est dangereux et vain de croire qu’une discipline ou une technique surpasse toutes les autres en biologie. Les résultats présentés jusqu’à présent ont tous été obtenus dans des modèles génétiques, murins et humains. Au-delà de la génétique, si effectivement la sérotonine d’origine duodénale est un inhibiteur de la formation osseuse si puissant qu’une diminution de 50 % de son taux circulant suffit à protéger des patients de toute forme d’ostéoporose, alors il doit être possible de le vérifier de façon pharmacologique. Non seulement cela doit être possible mais c’est souhaitable, car ce que l’étude des patients atteints du syndrome de masse osseuse élevée nous dit, c’est que l’inhibition partielle de la synthèse de la sérotonine dans le duodénum est un traitement efficace de l’ostéoporose. Il se trouve qu’un inhibiteur de Tph1, l’enzyme responsable de la synthèse de la sérotonine duodénale, existe. En outre, cette molécule, appelée LP533401, qui ne traverse pas la barrière hématoméningée, a déjà été testée dans un essai clinique chez l’homme et aucun effet secondaire n’a été rapporté. Cet inhibiteur était donc un candidat idéal pour vérifier le rôle de la sérotonine d’origine duodénale dans la régulation de la masse osseuse et pour déterminer, du moins chez l’animal, si l’inhibition partielle de la synthèse de la sérotonine duodénale pouvait être un nouveau traitement anabolique de l’ostéoporose. C’est ce que nous nous sommes employés à déterminer dans la dernière phase de travail. Après avoir vérifié que LP533401 n’était pas toxique chez les rongeurs, nous avons utilisé dans un premier temps les souris ovariectomisées comme modèle d’ostéoporose post-ménopausique [
27]. La première question fut de savoir si LP533401 pouvait prévenir l’apparition de l’ostéoporose. De façon remarquable, lorsque LP533401 est administrée une seule fois par jour par voie orale pendant un mois à des souris ovariectomisées peu de temps auparavant, nous avons observé une prévention complète de l’ostéoporose avec une dose 10 fois inférieure à celle qui avait été utilisée chez l’homme pour déterminer si cette molécule pouvait être toxique. Forts de ce résultat, nous avons posé la vraie question thérapeutique : LP533401 peut-elle guérir une ostéoporose établie ? Chez la souris comme chez le rat, LP533401 a pu corriger une ostéoporose préexistante avec une efficacité semblable à celle de la parathormone (PTH), le seul traitement anabolique autorisé pour l’ostéoporose, et ce même si le traitement était commencé trois mois après l’ovariectomie [26]. Au-delà de l’effet remarquable de LP533401, ces expériences ont montré qu’effectivement la sérotonine d’origine duodénale inhibe la formation osseuse et que bloquer de façon tout à fait partielle sa synthèse peut s’avérer être un excellent traitement anabolique de l’ostéoporose. |
L’étude des multiples fonctions qu’assure chacune des sources de la sérotonine, et pour l’une d’entre elles dans le contrôle de l’appétit, a permis de découvrir deux nouvelles actions physiologiques : d’une part, la sérotonine d’origine centrale agit comme médiateur moléculaire de la corégulation de la masse osseuse et de l’appétit ; d’autre part, la sérotonine d’origine duodénale, dont le rôle était inconnu jusqu’alors, se conduit comme une hormone inhibant la formation osseuse. Cette étude a aussi permis d’élucider le mécanisme moléculaire de deux maladies génétiques, l’ostéoporose avec pseudogliome et le syndrome de masse osseuse élevée. Enfin, et pour conclure, ce travail débouche sur ce qui peut être un traitement efficace et rationnel de l’ostéoporose. Surtout, ce travail a démontré la nécessité d’un dialogue continu entre la médecine et la biologie afin d’augmenter notre connaissance et surtout développer de nouveaux traitements. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
Nous remercions Patricia Ducy et Marine Oury pour leurs précieux commentaires au cours de l’écriture de cette revue. Franck Oury est financé par le Human frontier scientific program et la Fondation Bettencourt Schueller. Cet article est dédié à la mémoire de R.A.
|
1. Zhang Y, Proenca R, Maffei M, et al. Positional cloning of the mouse obese gene and its human homologue. Nature 1994 ; 372 : 425-32. 2. Spiegelman BM, Flier JS. Adipogenesis and obesity: rounding out the big picture. Cell 1996 ; 87 : 377-89. 3. Ducy P, Amling M, Takeda S, et al. Leptin inhibits bone formation through a hypothalamic relay : a central control of bone mass. Cell 2000 ; 100 : 197-207. 4. Elefteriou F, Ahn JD, Takeda S, et al. Leptin regulation of bone resorption by the sympathetic nervous system and CART. Nature 2005 ; 434 : 514-20. 5. Takeda S, Elefteriou F, Levasseur R. Leptin regulates bone formation via the sympathetic nervous system. Cell 2002 ; 111 : 305-17. 6. Lee NK, Sowa H, Hinoi E, et al. Endocrine regulation of energy metabolism by the skeleton. Cell 2007 ; 130 : 456-69. 7. Karsenty G. Convergence between bone and energy homeostases : Leptin regulation of bone mass. Cell Metab 2006 ; 4 : 341-8. 8. Oury F, Karsenty G. La sérotonine d’origine intestinale : une nouvelle hormone régulant le remodelage osseux. Med Sci (Paris) 2009 ; 25 : 445-6. 9. Horvitz HR, Chalfie M, Trent C, Sulston JE, Evans PD. Serotonin and octopamine in the nematode Caenorhabditis elegans. Science 1982 ; 216 : 1012-4. 10. Srinivasan S, Sadegh L, Elle IC, et al. Serotonin regulates C. elegans fat and feeding through independent molecular mechanisms. Cell Metab 2008 ; 117 : 533-44. 11. Doyon C, Drouin G, Trudeau VL, Moon TW. Molecular evolution of leptin. Gen Comp Endocrinol 2001 ; 124 : 188-98. 12. Huising MO, Kruiswijk CP, Flik G. Phylogeny and evolution of class-I helical cytokines. J Endocrinol 2006 ; 189 : 1-25. 13. Shi Y, Yadav VK, Suda N, et al. Dissociation of the neuronal regulation of bone mass and energy metabolism by leptin in vivo. Proc Natl Acad Sci USA 2008 ; 105 : 20529-33. 14. Balthasar N, Coppari R, McMinn J, et al. Leptin receptor signaling in POMC neurons is required for normal body weight homeostasis. Neuron 2004 ; 42 : 983-91. 15. Mann JJ, McBride PA, Brown RP, et al. Relationship between central and peripheral serotonin indexes in depressed and suicidal psychiatric inpatients. Arch Gen Psychiatry 1992 ; 49 : 442-6. 16. Ziere G, Dieleman JP, van der Cammen TJ, et al. Selective serotonin reuptake inhibiting antidepressants are associated with an increased risk of nonvertebral fractures. J Clin Psychopharmacol 2008 ; 28 : 411-7. 17. Richards JB, Papaioannou A, Adachi JD, et al. Effect of selective serotonin reuptake inhibitors on the risk of fracture. Arch Intern Med 2007 ; 167 : 188-94. 18. Haney EM, Chan BK, Diem SJ, et al. Association of low bone mineral density with selective serotonin reuptake inhibitor use by older men. Arch Intern Med 2007 ; 167 : 1246-51. 19. Hainer V, Kabrnova K, Aldhoon B, et al. Serotonin and norepinephrine reuptake inhibition and eating behavior. Ann NY Acad Sci 2006 ; 1083 : 252-69. 20. Yadav VK, Oury F, Suda N, et al. A serotonin-dependent mechanism explains the leptin regulation of bone mass, appetite, and energy expenditure. Cell 2009 ; 138 : 976-89. 21. Srinivasan L, Sadegh IC, Elle AG, et al. Serotonin regulates C. elegans fat and feeding through independent molecular mechanisms. Cell Metab 2008 ; 7 : 533-44. 22. Gong Y, Slee RB, Fukai N, et al. LDL receptor-related protein 5 (LRP5) affects bone acccrual and eye development. Cell 2001 ; 107 : 513-23. 23. Boyden LM, Mao J, Belsky J, et al. High bone density due to a mutation in LDL-receptor-related protein 5. N Engl J Med 2002 ; 346 : 1513-21. 24. Tamai K, Semenov M, Kato Y, et al. LDL-receptor-related proteins in Wnt signal transduction. Nature 2000 ; 407 : 530-5. 25. Glass DA, Bialek P, Ahn JD, et al. Canonical Wnt signaling in differenciated osteoblasts control osteoclast differentiation. Dev Cell 2005 ; 8 : 751-64. 26. Yadav VK, Ryu JH, Suda N, et al. Lrp5 controls bone formation by inhibiting serotonin synthesis in the duodenum. Cell 2008 ; 135 : 825-37. 27. Yadav VK, Balaji S, Suresh PS, et al. Pharmacological inhibition of gutderived serotonin synthesis is a potential bone anabolic treatment for osteoporosis. Nat Med 2010 ; 16 : 308-12. |