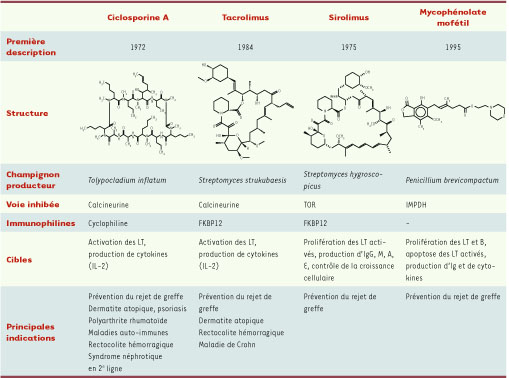
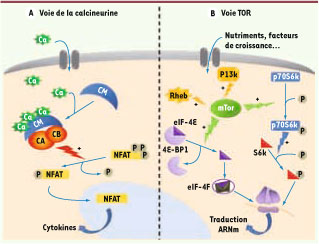
1.
Gothel SF, Marahiel MA. Peptidyl-prolyl cis-trans isomerases, a superfamily of ubiquitous folding catalysts. Cell Mol Life Sci 1999 ; 55 : 423-36.
2.
Ritter ML, Pirofski L. Mycophenolate mofetil: effects on cellular immune subsets, infectious complications, and antimicrobial activity. Transpl Infect Dis 2009 ; 11 : 290-7.
3.
Kahan BD. Fifteen years of clinical studies and clinical practice in renal transplantation: reviewing outcomes with de novo use of sirolimus in combination with cyclosporine. Transplant Proc 2008 ; 40 : S17-20.
4.
Rao A, Luo C, Hogan PG. Transcription factors of the NFAT family: regulation and function. Annu Rev Immunol 1997 ; 15 : 707-47.
5.
Schmelzle T, Hall MN. TOR, a central controller of cell growth. Cell 2000 ; 103 : 253-62.
6.
Allison AC, Eugui EM. Mechanisms of action of mycophenolate mofetil in preventing acute and chronic allograft rejection. Transplantation 2005 ; 80 : S181-S190.
7.
Menzin J, Meyers JL, Friedman M, et al. Mortality, length of hospitalization, and costs associated with invasive fungal infections in high-risk patients. Am J Health Syst Pharm 2009 ; 66 : 1711-7.
8.
Lanternier F, Chandesris MO, Poiree S, et al. Cellulitis revealing a cryptococcosis-related immune reconstitution inflammatory syndrome in a renal allograft recipient. Am J Transplant 2007 ; 7 : 2826-8.
9.
Singh N, Lortholary O, Alexander BD, et al. An immune reconstitution syndrome-like illness associated with Cryptococcus neoformans infection in organ transplant recipients. Clin Infect Dis 2005 ; 40 : 1756-61.
10.
Lanternier F, Lortholary O. Liposomal amphotericin B: what is its role in 2008? Clin Microbiol Infect 2008 ; 14 (suppl 4) : 71-83.
11.
Steinbach WJ, Reedy JL, Cramer RA, Jr, Perfect JR, Heitman J. Harnessing calcineurin as a novel anti-infective agent against invasive fungal infections. Nat Rev Microbiol 2007 ; 5 : 418-30.
12.
Odom A, Muir S, Lim E, et al. Calcineurin is required for virulence of Cryptococcus neoformans. EMBOJ 1997 ; 16 : 2576-89.
13.
Cruz MC, Sia RA, Olson M, Cox GM. Heitman J. Comparison of the roles of calcineurin in physiology and virulence in serotype D and serotype A strains of Cryptococcus neoformans. Infect Immun 2000 ; 68 : 982-5.
14.
Fox DS, Cruz MC, Sia RA, et al. Calcineurin regulatory subunit is essential for virulence and mediates interactions with FKBP12-FK506 in Cryptococcus neoformans. Mol Microbiol 2001 ; 39 : 835-49.
15.
Steinbach WJ, Cramer RA, Jr, Perfect BZ, et al. Calcineurin controls growth, morphology, and pathogenicity in Aspergillus fumigatus. Eukaryot Cell 2006 ; 5 : 1091-103.
16.
Steinbach WJ, Cramer RA Jr, Perfect BZ, et al. Calcineurin inhibition or mutation enhances cell wall inhibitors against Aspergillus fumigatus. AntimicrobAgents Chemother 2007 ; 51 : 2979-81.
17.
Juvvadi PR, Kuroki Y, Arioka M, et al. Functional analysis of the calcineurin-encoding gene cnaA from Aspergillus oryzae: evidence for its putative role in stress adaptation. Arch Microbiol 2003 ; 179 : 416-22.
18.
Reedy JL, Filler SG, Heitman J. Elucidating the Candida albicans calcineurin signaling cascade controlling stress response and virulence. Fungal Genet Biol 2010 ; 47 : 107-16.
19.
Blankenship JR, Wormley FL, Boyce MK, et al. Calcineurin is essential for Candida albicans survival in serum and virulence. Eukaryot Cell 2003 ; 2 : 422-30.
20.
Heitman J. Cell biology. A fungal Achilles’ heel. Science 2005 ; 309 : 2175-6.
21.
Bastidas RJ, Reedy JL, Morales-Johansson H, et al. Signaling cascades as drug targets in model and pathogenic fungi. Curr Opin Investig Drugs 2008 ; 9 : 856-64.
22.
Bastidas RJ, Heitman J, Cardenas ME. The protein kinase Tor1 regulates adhesin gene expression in Candida albicans. PLoS Pathog 2009 ; 5 : e1000294.
23.
Cruz MC, Cavallo LM, Gorlach JM, et al. Rapamycin antifungal action is mediated via conserved complexes with FKBP12 and TOR kinase homologs in Cryptococcus neoformans. Mol Cell Biol 1999 ; 19 : 4101-12.
24.
Fitzgibbon GJ, Morozov IY, Jones MG, Caddick MX. Genetic analysis of the TOR pathway in Aspergillus nidulans. Eukaryot Cell 2005 ; 4 : 1595-8.
25.
Pallet N, Beaune P, Legendre C, Anglicheau D. Rapamycine et inhibition de mTOR : des voies de signalisation aux applications cliniques. Ann Biol Clin (Paris) 2006 ; 64 : 107-15.
26.
O’Gara MJ, Lee CH, Weinberg GA, et al. IMP dehydrogenase from Pneumocystis carinii as a potential drug target. Antimicrob Agents Chemother 1997 ; 41 : 40-8.
27.
Mody CH, Toews GB, Lipscomb MF. Cyclosporin A inhibits the growth of Cryptococcus neoformans in a murine model. Infect Immun 1988 ; 56 : 7-12.
28.
Cruz MC, Del Poeta M, Wang P, et al. Immunosuppressive and nonimmunosuppressive cyclosporine analogs are toxic to the opportunistic fungal pathogen Cryptococcus neoformans via cyclophilin-dependent inhibition of calcineurin. Antimicrob Agents Chemother 2000 ; 44 : 143-9.
29.
Cruz MC, Goldstein AL, Blankenship J, et al. Rapamycin and less immunosuppressive analogs are toxic to Candida albicans and Cryptococcus neoformans via FKBP12-dependent inhibition of TOR. Antimicrob Agents Chemother 2001 ; 45 : 3162-70.
30.
High KP. The antimicrobial activities of cyclosporine, FK506, and rapamycin. Transplantation 1994 ; 57 : 1689-700.
31.
High KP, Washburn RG. Invasive aspergillosis in mice immunosuppressed with cyclosporin A, tacrolimus (FK506), or sirolimus (rapamycin). J Infect Dis 1997 ; 175 : 222-5.
32.
Kirkland TN, Fierer J. Cyclosporin A inhibits Coccidioides immitis in vitro and in vivo. Antimicrob Agents Chemother 1983 ; 24 : 921-4.
33.
Wong GK, Griffith S, Kojima I, Demain AL. Antifungal activities of rapamycin and its derivatives, prolylrapamycin, 32-desmethylrapamycin, and 32-desmethoxyrapamycin. J Antibiot (Tokyo) 1998 ; 51 : 487-91.
34.
Oz HS, Hughes WT. Novel anti-Pneumocystis carinii effects of the immunosuppressant mycophenolate mofetil in contrast to provocative effects of tacrolimus, sirolimus, and dexamethasone. J Infect Dis 1997 ; 175 : 901-4.
35.
Kontoyiannis DP, Lewis RE, Osherov N, et al. Combination of caspofungin with inhibitors of the calcineurin pathway attenuates growth in vitro in Aspergillus species. J Antimicrob Chemother 2003 ; 51 : 313-6.
36.
Steinbach WJ, Schell WA, Blankenship JR, et al. In vitro interactions between antifungals and immunosuppressants against Aspergillus fumigatus. Antimicrob Agents Chemother 2004 ; 48 : 1664-9.
37.
Steinbach WJ, Singh N, Miller JL, et al. In vitro interactions between antifungals and immunosuppressants against Aspergillus fumigatus isolates from transplant and nontransplant patients. Antimicrob Agents Chemother 2004 ; 48 : 4922-5.
38.
Neofytos D, Horn D, Anaissie E, et al. Epidemiology and outcome of invasive fungal infection in adult hematopoietic stem cell transplant recipients: analysis of Multicenter Prospective Antifungal Therapy (PATH) Alliance registry. Clin Infect Dis 2009 ; 48 : 265-73.
39.
Almyroudis NG, Sutton DA, Linden P, et al. Zygomycosis in solid organ transplant recipients in a tertiary transplant center and review of the literature. Am J Transplant 2006 ; 6 : 2365-74.
40.
Dannaoui E, Schwarz P, Lortholary O. In vitro interaction between antifungals and immunosuppressive drugs against zygomycetes. Antimicrob Agents Chemother 2009 ; 53 : 3549-51.
41.
Marchetti O, Moreillon P, Glauser MP, et al. Potent synergism of the combination of fluconazole and cyclosporine in Candida albicans. Antimicrob Agents Chemother 2000 ; 44 : 2373-81.
42.
Onyewu C, Blankenship JR, Del Poeta M, Heitman J. Ergosterol biosynthesis inhibitors become fungicidal when combined with calcineurin inhibitors against Candida albicans, Candida glabrata, and Candida krusei. Antimicrob Agents Chemother 2003 ; 47 : 956-64.
43.
Del Poeta M, Cruz MC, Cardenas ME, et al. Synergistic antifungal activities of bafilomycin A(1), fluconazole, and the pneumocandin MK-0991/ caspofungin acetate (L-743,873) with calcineurin inhibitors FK506 and L-685,818 against Cryptococcus neoformans. Antimicrob Agents Chemother 2000 ; 44 : 739-46.
44.
Kontoyiannis DP, Lewis RE, Alexander BD, et al. Calcineurin inhibitor agents interact synergistically with antifungal agents in vitro against Cryptococcus neoformans isolates: correlation with outcome in solid organ transplant recipients with cryptococcosis. Antimicrob Agents Chemother 2008 ; 52 : 735-8.
45.
Cowen LE, Lindquist S. Hsp90 potentiates the rapid evolution of new traits: drug resistance in diverse fungi. Science 2005 ; 309 : 2185-9.
46.
Marchetti O, Entenza JM, Sanglard D, et al. Fluconazole plus cyclosporine: a fungicidal combination effective against experimental endocarditis due to Candida albicans. Antimicrob Agents Chemother 2000 ; 44 : 2932-8.
47.
Husain S, Singh N. The impact of novel immunosuppressive agents on infections in organ transplant recipients and the interactions of these agents with antimicrobials. Clin Infect Dis 2002 ; 35 : 53-61.
48.
Singh N, Alexander BD, Lortholary O, et al. Cryptococcus neoformans in organ transplant recipients: impact of calcineurin-inhibitor agents on mortality. J Infect Dis 2007 ; 195 : 756-64.
49.
Singh N, Aguado JM, Bonatti H, et al. Zygomycosis in solid organ transplant recipients: a prospective, matched case-control study to assess risks for disease and outcome. J Infect Dis 2009 ; 200 : 1002-11.
50.
Breton G. Syndrome inflammatoire de reconstitution immune. Med Sci (Paris) 2010 ; 26 : 281-9.