| |
| Med Sci (Paris). 2010 October; 26(10): 848–854. Published online 2010 October 15. doi: 10.1051/medsci/20102610848.Tour d’horizon des lignées de cellules souches pluripotentes Emmanuelle Kieffer,1,2 Sandra Kuntz,3 and Stéphane Viville4* 1Institut de génétique et de biologie moléculaire et cellulaire, département biologie cellulaire et développement (Inserm, CNRS, Université de Strasbourg), 1, rue Laurent Fries, 67400 Illkirch-Graffenstaden,
France 2Babraham Institute, Babraham, Cambridge CB22 3AT, Royaume-Uni 3Laboratoire de biologie expérimentale, aspects cellulaires et moléculaires de la reproduction et du développement, faculté des sciences, Vandœuvre-les-Nancy, France 4Institut de génétique et de biologie moléculaire et cellulaire, département biologie cellulaire et développement ; faculté de médecine, centre hospitalier universitaire, Strasbourg, France |
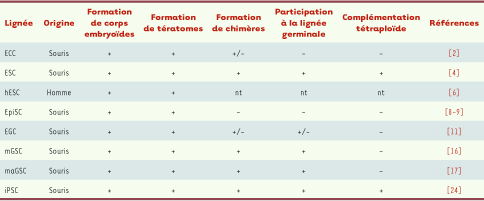
Les cellules souches pluripotentes sont définies par deux propriétés majeures : l’autorenouvellement et la pluripotence. L’autorenouvellement permet, au cours des divisions mitotiques, la production de cellules filles identiques à la cellule d’origine. Les lignées de cellules souches pluripotentes ont la capacité de s’autorenouveler de façon illimitée in vitro. Ces cellules conservent donc au cours des divisions leur propriété de pluripotence qui leur permet, sous l’influence de signaux spécifiques, de se différencier en cellules constituant les tissus dérivés des trois feuillets primaires formés au cours de la gastrulation (endoderme, mésoderme et ectoderme) ainsi qu’en cellules des lignées germinales. Les origines possibles de cellules souches pluripotentes étant de plus en plus nombreuses, il est important tout d’abord de définir les caractéristiques d’une lignée plu-ripotente. Cette pluripotence peut être testée in vitro et in vivo. Différentes expériences sont généralement utilisées, et les critères peuvent être classés selon le degré de précision avec lequel ils renseignent sur ce potentiel pluripotent : expression de marqueurs, capacité de différenciation in vitro, formation de tératomes, contribution aux tissus de souris chimères, avec ou sans participation à la lignée germinale, et complémentation d’embryons tétraploïdes (Figure 1 et Tableau I). La complémentation d’embryons tétraploïdes est un critère de choix car, dans ce cas, les cellules pluripotentes injectées dans le blastocyste hôte ne bénéficient pas de l’environnement de la masse cellulaire interne de l’embryon hôte (les cellules tétraploïdes sont uniquement capables de former le trophectoderme, il n’y a donc pas de bouton embryonnaire) [
38]. Elles sont donc à elles seules à l’origine d’un organisme entier. Chez la souris, la formation de chimères avec transmission germinale est un critère minimal requis pour qualifier une lignée de pluripotente, et seules les cellules souches embryonnaires (CSE) et les cellules souches pluripotentes induites1 (iPSC) ont, à l’heure actuelle, prouvé leur capacité à complémenter des embryons tétraploïdes. Chez l’homme, il va de soi que ce type d’expériences n’est pas possible et le minimum requis est la formation de tératomes après injection sous-cutanée des cellules dont on souhaite évaluer la pluripotence à des souris immunodéficientes.  | Tableau I
Tableau récapitulatif des potentialités des lignées de cellules souches pluripotentes connues. + : positif ; - : non démontré ; nt : non testé. On peut noter que la complémentation d’embryons tétraploïdes n’a été possible que pour les CSE et les iPSC. |
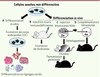 | Figure 1
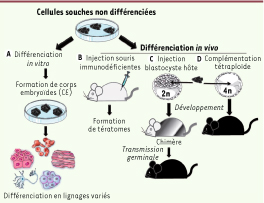
Tests évaluant la pluripotence. Les différents tests permettant d’analyser la pluripotence de cellules souches sont présentés ici, des moins rigoureux (à gauche) aux plus rigoureux (à droite). A.
In vitro, des corps embryoïdes (CE) peuvent être formés en suspension puis se différencier dans les lignages issus des trois feuillets embryonnaires. B.
In vivo, les cellules souches peuvent former des tératomes lorsqu’elles sont injectées dans des souris immunodéficientes. C. Lorsqu’elles sont injectées dans un blastocyste hôte, ensuite implanté chez une souris femelle, elles peuvent également participer à la formation de tous les tissus d’un animal chimère. Lorsqu’elles colonisent la lignée germinale, elles peuvent être à l’origine d’un organisme entier à la génération suivante. D. Leur injection dans un blastocyste tétraploïde entraîne directement la génération d’un embryon totalement issu des cellules souches. |
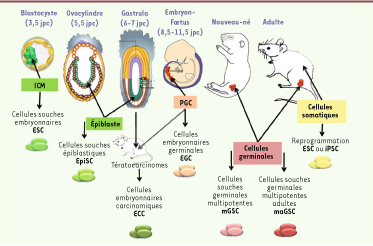
Nous présentons ici, en suivant la logique chronologique qui existe au cours du développement, les différentes origines possibles à partir desquelles on peut établir des lignées de cellules souches pluripotentes (Figure 2). 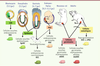 | Figure 2
Origine des différentes catégories de cellules souches pluripotentes. Les cellules souches pluripotentes peuvent être dérivées à différents stades de développement et à partir de différents tissus, en particulier des tissus pluripotents comme l’ICM (inner cell mass) à partir duquel on dérive des CSE, ou l’épiblaste (dont on dérive directement des EpiSC, ou, indirectement, via la formation de tératocarcinome, des ECC), et les cellules de la lignée germinale (les EGC, embryonic germinal cells, sont établies à partir des PGC, primordial germ cells, du foetus, et les mGSC, multipotent germ stem cells, et les maGSC, multipotent adult germ stem cells, sont établies à partir des cellules germinales de nouveau-né et d’adulte respectivement). Des cellules pluripotentes peuvent également être générées après reprogrammation de cellules somatiques (voir Figure 3). |
|
Les cellules embryonnaires de carcinome (ECC) La recherche sur les cellules souches pluripotentes a débuté dans les années 1970, lorsqu’il a été possible d’induire des tératocarcinomes en transplantant des crêtes génitales fœtales ou des embryons in toto au stade prégastrulation dans des testicules adultes, et d’en dériver des lignées de cellules appelées cellules embryonnaires carcinomiques (ECC) [
1]. Ces lignées sont pluripotentes dans le sens où, lorsqu’elles sont injectées à l’état clonal dans des souris receveuses, elles sont à l’origine d’un nouveau tératocarcinome, formé à la fois de cellules non différenciées et de cellules différenciées issues des trois feuillets embryonnaires [
2]. Lorsqu’elles sont injectées dans des blastocystes, certaines lignées contribuent également aux tissus d’une souris chimérique, mais la plupart en sont incapables ou participent à la fois à la formation de tissus normaux et tumoraux [
3]. Malgré un potentiel de pluripotence restreint et une utilisation minime, l’étude des ECC a été déterminante. Elle a permis de montrer la nécessité d’une coculture avec des fibroblastes mitotiquement inactivés (appelés cellules nourricières ou feeders) pour leur maintien à l’état indifférencié. |
Les cellules souches embryonnaires (CSE) L’étape suivante, dix ans plus tard, a été l’établissement de lignées de cellules souches à partir d’embryons de souris au stade blastocyste, sans passer par la formation de tératocarcinomes : les cellules souches embryonnaires murines (mCSE) étaient nées [
4]. La capacité des mCSE à former des chimères et à participer à leur lignée germinale est très supérieure à celle des ECC, puisque des souris entièrement issues de CSE ont pu être générées après leur injection dans des embryons tétraploïdes [
5]. Les CSE sont depuis largement utilisées et cette capacité de contribuer à des souris chimères, alliée aux techniques de recombinaison homologue, a permis la génération de multiples modèles de souris mutantes. Elles ont également fait l’objet de nombreuses études visant à élucider (puis à tenter de reproduire) les mécanismes du développement précoce et de la différenciation cellulaire. L’établissement de cellules CSE humaines (hCSE) a été relativement tardif (1998) par rapport aux premières dérivations de CSE murines [
6]. Ceci peut s’expliquer notamment par le fait que l’autorenouvellement des hCSE et des mCSE dépend de facteurs différents. Contrairement aux mCSE, le maintien des hCSE à l’état indifférencié est indépendant du facteur LIF (leukemia inhibiting factor)
2
, ce rôle étant dévolu à la voie activine/nodal et au FGF2 (fibroblast growth factor) [
7]. De plus, les colonies de hCSE ont une morphologie très plate et étalée, et les cellules ne peuvent être que difficilement dissociées et repiquées à l’état clonal. La pluripotence des hCSE est évaluée par la présence de marqueurs tels que les facteurs de transcription Oct4 [
39] et Nanog et les marqueurs de surface comme SSEA3 et SSEA4 (stage-specific embryonic antigens, qui sont des gangliosides), Tra-1-60 et Tra-1-81 (protéoglycannes) et par leur capacité à se différencier in vitro. Elle est également établie in vivo par formation de tératomes3 chez la souris [6]. Les limites éthiques imposées par la manipulation des hCSE empêchent toutefois de pratiquer des tests in vivo plus informatifs (comme l’injection dans des blastocystes) sur la pluripotence de ces cellules. |
Les cellules souches de l’épiblaste (EpiSC) Après l’implantation de l’embryon dans la muqueuse utérine, l’épiblaste reste pluripotent jusqu’à l’établissement des trois feuillets embryonnaires et de la lignée germinale au cours de la gastrulation [
40]. À ce stade, deux groupes ont récemment établi des lignées de cellules souches épiblastiques (epiblast stem cells, EpiSC) [
8,
9]. Ces cellules partagent de nombreuses caractéristiques avec les hCSE : (1) leur dérivation dépend de la voie activine/nodal et du facteur de croissance FGF2, mais pas du LIF ni de BMP (bone morphogenetic protein) ; (2) les colonies ont la même morphologie, elles sont plates et plus étalées que celles issues des mCSE ; (3) il est difficile de les propager à l’état clonal. Des analyses de leur transcriptome ont montré que les EpiSC étaient plus proches de leur tissu original, l’épiblaste, que du bouton embryonnaire (ICM, inner cell mass) ou des mCSE qui en sont issues [8]. Ceci est basé sur le constat que les EpiSC expriment les gènes de pluripotence Nanog, Oct4 et Sox2, mais également certains gènes de différenciation à un niveau plus élevé que dans les mCSE [
10]. La pluripotence des EpiSC a été démontrée in vitro par la formation de corps embryoïdes (CE) (agrégats cellulaires qui se forment lors de l’induction de la différenciation des cellules CSE sevrées de facteurs et de cellules nourricières), et in vivo par la formation de tératomes. En revanche, elles sont incapables de coloniser la masse interne des blastocystes et donc de participer à des chimères [8, 9]. Cette difficulté pourrait s’expliquer par l’origine plus tardive des EpiSC au cours de développement. Cellesci seraient, de ce fait, incompatibles avec les cellules de l’ICM et l’environnement embryonnaire au stade préimplantatoire. L’établissement des cellules EpiSC à partir d’embryons de souris au stade post-implantatoire et leur ressemblance avec les hCSE ont fait naître l’hypothèse que les hCSE seraient en réalité issues de l’épiblaste. Cette différence temporelle expliquerait les nombreuses divergences observées entre les CSE murines et humaines. |
Les cellules embryonnaires germinales (EGC) et autres lignées issues des cellules germinales D’autres sources embryonnaires peuvent être à l’origine de l’obtention de lignées proches des CSE. Après la gastrulation, seules les cellules germinales primordiales (PGC) [
41] conservent des caractéristiques de pluripotence (même si elles sont unipotentes au sein de l’organisme dans lequel elles sont formées), puisqu’elles sont à l’origine d’un individu entier à la génération suivante et sont capables de générer des tératocarcinomes lorsqu’elles sont transplantées dans des testicules adultes [1]. Des lignées de cellules souches pluripotentes, nommées cellules embryonnaires germinales (embryonic germ cells, EGC) ont été directement établies à partir de PGC chez la souris [
11] et chez l’homme [
12]. Bien que les EGC soient très proches des CSE, l’induction de leur pluripotence in vitro nécessite l’ajout des facteurs de croissance SCF (stem cell factor) et FGF au LIF et aux cellules nourricières. Lorsqu’elles sont établies, les EGC prolifèrent à long terme en l’absence de ces facteurs, dans les mêmes conditions que les CSE. Il est possible d’établir des EGC dans une fenêtre précise du développement embryonnaire murin, de 8,5 à 11,5 jpc. Ceci correspond à la phase pendant laquelle les PGC présentent des caractéristiques génétiques (en particulier l’expression des marqueurs de pluripotence tels Oct4, Nanog et Sox2) et épigénétiques (réduction de la marque répressive H3K9me2 au profit de H3K27me34) de pluripotence [
13] et précède la phase d’effacement de l’empreinte génomique qui a lieu au cours du développement des PGC. Lorsqu’elles sont établies dans cette fenêtre de temps, les EGC peuvent contribuer à tous les tissus de souris chimériques, y compris leur lignée germinale [
14]. Au-delà, à 12,5 jpc, il est toujours possible d’établir des EGC, mais avec une fréquence diminuée. De plus, leur transmission germinale est compromise, et la majorité des chimères obtenues après l’injection de ces EGC présentent des anomalies squelettiques typiques de la présence de défauts de l’empreinte génomique, reflétant probablement des défauts épigénétiques plus vastes [
15]. Les EGC semblent donc hériter des modifications épigénétiques présentes dans les PGC dont elles sont issues, et leur potentiel de pluripotence varie en fonction de ces différences. La capacité de dériver des lignées de cellules souches pluripotentes à partir de tissus germinaux persiste cependant jusqu’au stade de nouveau-nés puisqu’on peut dériver à partir des testicules, à ce stade, des cellules souches germinales multipotentes (multipotent germinal stem cells, mGSC) [
16]. Des lignées issues de cellules souches spermatogoniales, baptisées cellules souches germinales multipotentes adultes (multipotent adult germinal stem cells, maGSC) ont également été dérivées à partir de testicules adultes [
17]. Dans les deux cas, et malgré leur appellation trompeuse de cellules multipotentes, ces lignées sont en fait pluripotentes puisqu’elles ont été capables de se différencier in vitro et in vivo, formant des tératocarcinomes qui comprennent des tissus issus des trois feuillets embryonnaires. De plus, elles ont montré leur contribution à la formation de tissus variés dans des chimères, y compris la lignée germinale. Cette potentialité reflète la grande plasticité de la lignée germinale quipeut, tout au long de son existence, revenir à un état embryonnaire dans certaines conditions de culture. |
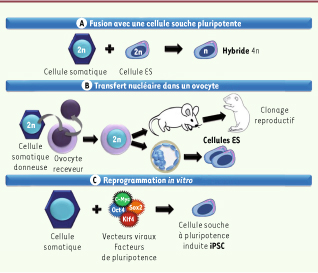
La reprogrammation de cellules somatiques Le potentiel de pluripotence des cellules souches, en particulier celui des CSE, a suscité un intérêt croissant, tant pour la recherche fondamentale que pour le développement thérapeutique. La nécessité d’obtenir des cellules histocompatibles avec celles des patients à traiter a fait émerger l’idée d’utiliser le potentiel de pluripotence de ces cellules, ou les connaissances acquises grâce à leur étude, pour reprogrammer des cellules somatiques adultes en cellules pluripotentes. Trois méthodes de reprogrammation du génome d’une cellule différenciée et spécialisée en une cellule naïve et pluripotente ont été élaborées (Figure 3) [
18].  | Figure 3
Stratégies de reprogrammation des cellules somatiques. Pour obtenir des cellules souches pluripotentes à partir de cellules somatiques, la reprogrammation peut se faire : A. Par fusion d’une cellule somatique avec une cellule souche pluripotente. L’hybride 4n (tétraploïde) qui est ainsi produit possède les caractéristiques d’une cellule pluripotente, mais n’a pas un caryotype normal. B. Par transfert du noyau d’une cellule somatique dans un ovocyte receveur énucléé qui peut le reprogrammer. Suite au développement du zygote 2n ainsi généré, des CSE portant le matériel génétique de la cellule somatique donneuse peuvent être établies. Si le développement de l’embryon est mené à son terme, il s’agit de clonage reproductif. C. Par transduction de quatre facteurs de pluripotence : Oct4, Sox2, Klf4, et c-Myc (chez la souris), à l’aide de vecteurs viraux. La cellule souche ainsi générée, nommée cellule souche à pluripotence induite ou iPSC, porte le matériel génétique de la cellule « reprogrammée » et présente des propriétés similaires à celles des CSE. |
Fusion cellulaire et transfert nucléaire
-
La fusion de cellules somatiques avec des cellules pluripotentes entraîne la formation de cellules hybrides (Figure 3a) dans lesquelles la cellule pluripotente impose son phénotype [
19]. Cette technique est inutilisable à l’heure actuelle en thérapie puisque les hybrides créés par fusion sont tétraploïdes. Récemment, une méthode permettant l’élimination d’un chromosome entier provenant de CSE fusionnàes à des cellules somatiques a été mise au point [
20]. Toutefois, il paraît peu vraisemblable de pouvoir un jour rendre une cellule hybride diploïde et utilisable en thérapie, d’autant que d’autres méthodes de reprogrammation, moins invasives, semblent bien plus prometteuses.
-
Le procédé de transfert nucléaire de cellule somatique (somatic cell nuclear transfer, SCNT), encore appelé « clonage », tire profit de la capacité d’un ovocyte énucléé à reprogrammer un noyau provenant d’une cellule somatique (Figure 3b). Les embryons ainsi obtenus peuvent être utilisés pour établir des CSE, voire des CSE histocompatibles avec un patient à traiter si le noyau provient des cellules de ce patient.
Ces expériences de clonage ont démontré qu’une cellule totalement différenciée n’était pas dans un état épigénétique irréversible et qu’il était toujours possible de la ramener à un état embryonnaire grâce à des facteurs présents dans l’ovocyte. Cependant, l’efficacité de reprogrammation est très faible, et de sérieuses anomalies sont observées chez les animaux clonés, rendant compte de défauts épigénétiques qui aboutissent à une expression aberrante de certains gènes [
21]. Une meilleure reprogrammation semble se mettre en place après le passage dans la lignée germinale puisque la descendance des animaux clonés semble normale [
22]. Par ailleurs, ces défauts ne semblent pas affecter les CSE dérivées après SCNT qui resteraient utilisables en thérapie [
23]. Malheureusement, la technique de SCNT n’a jusqu’ici pas montré son efficacité chez l’homme. Par ailleurs, cette stratégie se heurte bien sûr à des problèmes éthiques majeurs puisqu’elle nécessite l’utilisation d’ovocytes humains et qu’elle pourrait mener à des dérives en matière de clonage humain. Les cellules pluripotentes induites (iPSC) Ces données ont motivé la communauté scientifique qui a cherché à identifier les facteurs responsables de la reprogrammation lors de la formation d’hybrides par fusion avec des CSE ou lors de SCNT. En 2006, Takahashi et Yamanaka ont été capables de reprogrammer des fibroblastes fœtaux ( mouse embryonic fibroblasts, MEF) et adultes de souris en cellules pluripotentes à l’aide d’une sélection de 24 facteurs spécifiquement exprimés dans les CSE, et/ou connus pour maintenir la pluripotence ou la prolifération des CSE [
24,
42]. Par un procédé itératif, ils ont pu réduire à 4 le nombre de facteurs (Oct4, Sox2, Klf4 et c-Myc) nécessaires pour induire l’apparition de clones semblables à des clones de CSE et baptisés iPSC ou cellules souches à pluripotence induite (Figure 3C). L’utilisation d’un gène rapporteur associé au promoteur du gène Nanog a permis la sélection de clones d’iPSC pluripotents, compétents pour coloniser la lignée germinale de souris chimères [
25]. De plus, ces iPSC sont également compétentes pour former des souris adultes entièrement issues des iPSC par la technique de complémentation d’embryons tétraploïdes [
26, 38]. Outre leur morphologie et leur potentiel d’autorenouvellement et de pluripotence similaires à ceux des CSE, les iPSC présentent une reprogrammation épigénétique complète, prouvée à la fois par la déméthylation des promoteurs des gènes Oct4 et Nanog, la réactivation du chromosome X dans les lignées femelles et par un profil global de méthylation des histones et d’expression de gènes très proche de celui des CSE [ 25,
27]. Depuis, des iPSC ont été créées a partir d’une très large variété de tissus allant, sans vouloir tous les citer, de cellules souches hématopoïétiques à des lymphocytes B [
28]. La reprogrammation de cellules somatiques adultes humaines en cellules iPS (hiPSC) a été démontrée simultanément par deux équipes avec l’utilisation de deux combinaisons de gènes différentes, l’une identique à celle utilisée chez la souris (Oct4, Sox2, Klf4, c-Myc) [
29], l’autre incluant Oct4, Sox2, Nanog et Lin28 [
30]. La dérivation d’hiPSC constitue une avancée majeure puisqu’elle pourrait aboutir à la création de cellules souches pluripotentes spécifiques des patients, sans passer par la production d’embryons [
43]. Cependant, l’intégration de rétrovirus (utilisés comme vecteurs des gènes induisant la reprogrammation) dans le génome de la cellule adulte reprogrammée compromet leur utilisation en clinique. C’est pourquoi plusieurs équipes tentent de produire des iPSC sans intégration de vecteurs viraux en utilisant notamment des vecteurs adénoviraux [
31], des plasmides non intégratifs [
32], des transposons piggyBac permettant l’excision du transgène [
33], des protéines recombinantes [
34] ou des extraits cellulaires [
35]. Cependant, l’efficacité de ces méthodes laisse à désirer et il est nécessaire de développer de nouvelles méthodes. Outre le potentiel thérapeutique qu’elle laisse espérer, la technique de dérivation d’hiPSC permet la génération de modèles cellulaires humains de maladies pour lesquelles il n’existait jusqu’ici pas ou peu de modèles in vitro. Les hiPSC porteuses de mutations peuvent ainsi servir d’outil pour comprendre les mécanismes des maladies et effectuer des criblages pour le développement de nouveaux médicaments [
36]. Le développement des iPSC représente une avancée majeure dans la recherche de moyens permettant la reprogrammation de cellules adultes. Cette reprogrammation ne soulève pas de problème éthique puisqu’elle ne nécessite pas la destruction d’ovocytes ou d’embryons humains et peut être réalisée à partir de cellules adultes obtenues avec le consentement éclairé des patients. Par rapport aux autres techniques de reprogrammation, elle se fait avec une facilité et une efficacité sans précédent. De plus, si on évalue les lignées de cellules souches pluripotentes qui ont été dérivées jusqu’ici, seules les iPSC et les CSE ont satisfait aux critères les plus rigoureux définissant la pluripotence (Tableau I). Toutefois, il faut rester attentif au fait que ces cellules sont obtenues de façon artificielle et qu’il conviendra de caractériser en détails toutes leurs potentialités (et leurs risques) avant d’envisager de les utiliser en thérapie. Il n’empêche que, même s’il semble exister des différences, minimes, avec les CSE [
37], cette technologie représente la meilleure chance de pouvoir produire à l’avenir des cellules souches histocompatibles utilisables en thérapie cellulaire, rendant les deux autres techniques obsolètes. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
Footnotes |
1. Stevens LC. Experimental production of testicular teratomas in mice. Proc Natl Acad Sci USA 1964 ; 52 : 654-61. 2. Kleinsmith LJ, Pierce GB Jr. Multipotentiality of single embryonal carcinoma cells. Cancer Res 1964 ; 24 : 1544-51. 3. Rossant J, McBurney MW. The developmental potential of a euploid male teratocarcinoma cell line after blastocyst injection. J Embryol Exp Morphol 1982 ; 70 : 99-112. 4. Evans MJ, Kaufman MH. Establishment in culture of pluripotential cells from mouse embryos. Nature 1981 ; 292 : 154-6. 5. Nagy A, Rossant J, Nagy R, et al. Derivation of completely cell culture-derived mice from early-passage embryonic stem cells. Proc Natl Acad Sci USA 1993 ; 90 : 8424-8. 6. Thomson JA, Itskovitz-Eldor J, Shapiro SS, et al. Embryonic stem cell lines derived from human blastocysts. Science 1998 ; 282 : 1145-7. 7. Vallier L, Alexander M, Pedersen RA. Activin/nodal and FGF pathways cooperate to maintain pluripotency of human embryonic stem cells. J Cell Sci 2005 ; 118 : 4495-509. 8. Brons IG, Smithers LE, Trotter MW, et al. Derivation of pluripotent epiblast stem cells from mammalian embryos. Nature 2007 ; 448 : 191-5. 9. Tesar PJ, Chenoweth JG, Brook FA, et al. New cell lines from mouse epiblast share defining features with human embryonic stem cells. Nature 2007 ; 448 : 196-9. 10. Rossant J. Stem cells and early lineage development. Cell 2008 ; 132 : 527-31. 11. Matsui Y, Zsebo K, Hogan BL. Derivation of pluripotential embryonic stem cells from murine primordial germ cells in culture. Cell 1992 ; 70 : 841-7. 12. Shamblott MJ, Axelman J, Wang S, et al. Derivation of pluripotent stem cells from cultured human primordial germ cells. Proc Natl Acad Sci USA 1998 ; 95 : 13726-31. 13. Reik W. Stability and flexibility of epigenetic gene regulation in mammalian development. Nature 2007 ; 447 : 425-32. 14. Stewart CL, Gadi I, Bhatt H. Stem cells from primordial germ cells can reenter the germ line. Dev Biol 1994 ; 161 : 626-8. 15. Labosky PA, Barlow DP, Hogan BL. Mouse embryonic germ (EG) cell lines: transmission through the germline and differences in the methylation imprint of insulin-like growth factor 2 receptor (Igf2r) gene compared with embryonic stem (ES) cell lines. Development 1994 ; 120 : 3197-204. 16. Kanatsu-Shinohara M, Inoue K, Lee J, et al. Generation of pluripotent stem cells from neonatal mouse testis. Cell 2004 ; 119 : 1001-12. 17. Guan K, Nayernia K, Maier LS, et al. Pluripotency of spermatogonial stem cells from adult mouse testis. Nature 2006 ; 440 : 1199-203. 18. Jaenisch R, Young R. Stem cells, the molecular circuitry of pluripotency and nuclear reprogramming. Cell 2008 ; 132 : 567-82. 19. Miller RA, Ruddle FH. Pluripotent teratocarcinoma-thymus somatic cell hybrids. Cell 1976 ; 9 : 45-55. 20. Matsumura H, Tada M, Otsuji T, et al. Targeted chromosome elimination from ES-somatic hybrid cells. Nat Methods 2007 ; 4 : 23-5. 21. Humpherys D, Eggan K, Akutsu H, et al. Abnormal gene expression in cloned mice derived from embryonic stem cell and cumulus cell nuclei. Proc Natl Acad Sci USA 2002 ; 99 : 12889-94. 22. Tamashiro KL, Wakayama T, Akutsu H, et al. Cloned mice have an obese phenotype not transmitted to their offspring. Nat Med 2002 ; 8 : 262-7. 23. Hochedlinger K, Jaenisch R. Nuclear reprogramming and pluripotency. Nature 2006 ; 441 : 1061-7. 24. Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell 2006 ; 126 : 663-76. 25. Maherali N, Sridharan R, Xie W, et al. Directly reprogrammed fibroblasts show global epigenetic remodeling and widespread tissue contribution. Cell Stem Cell 2007 ; 1 : 55-70. 26. Zhao XY, Li W, Lv Z, et al. iPS cells produce viable mice through tetraploid complementation. Nature 2009 ; 461 : 86-90. 27. Okita K, Ichisaka T, Yamanaka S. Generation of germline-competent induced pluripotent stem cells. Nature 2007 ; 448 : 313-7. 28. Carey BW, Markoulaki S, Beard C, et al. Single-gene transgenic mouse strains for reprogramming adult somatic cells. Nat Methods 2010 ; 7 : 56-9. 29. Takahashi K, Tanabe K, Ohnuki M, et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell 2007 ; 131 : 861-72. 30. Yu J, Vodyanik MA, Smuga-Otto K, et al. Induced pluripotent stem cell lines derived from human somatic cells. Science 2007 ; 318 : 1917-20. 31. Stadtfeld M, Nagaya M, Utikal J, et al. Induced pluripotent stem cells generated without viral integration. Science 2008 ; 322 : 945-9. 32. Okita K, Nakagawa M, Hyenjong H, et al. Generation of mouse induced pluripotent stem cells without viral vectors. Science 2008 ; 322 : 949-53. 33. Woltjen K, Michael IP, Mohseni P, et al. PiggyBac transposition reprograms fibroblasts to induced pluripotent stem cells. Nature 2009 ; 458 : 766-70. 34. Zhou H, Wu S, Joo JY, et al. Generation of induced pluripotent stem cells using recombinant proteins. Cell Stem Cell 2009 ; 4 : 381-4. 35. Taranger CK, Noer A, Sørensen AL, et al. Induction of dedifferentiation, genomewide transcriptional programming, and epigenetic reprogramming by extracts of carcinoma and embryonic stem cells. Mol Biol Cell 2005 ;16 : 5719-35. 36. Park IH, Arora N, Huo H, et al. Disease-specific induced pluripotent stem cells. Cell 2008 ; 134 : 877-86. 37. Chin MH, Mason MJ, Xie W, et al. Induced pluripotent stem cells and embryonic stem cells are distinguished by gene expression signatures. Cell Stem Cell 2009 ; 5 : 111-23. 38. Coulombel L. Comment définir la pluripotence ? Med Sci (Paris) 2009 ; 25 : 798-801. 39. Stefanovic S, Pucéat M. L’octamanie continue : le double jeu de OCT4. Med Sci (Paris) 2010 ; 26 : 411-6. 40. Chazaud C. L’embryogenèse précoce des mammifères : premières différenciations cellulaires et cellules souches. Med Sci (Paris) 2008 ; 24 : 1043-8. 41. Machev N, Fuhrmann G, Viville S. Ontogenèse des cellules germinales primordiales. Med Sci (Paris) 2004 ; 20 : 1091-5. 42. Coulombel L. Reprogrammation nucléaire d’une cellule différenciée : on efface tout et on recommence. Med Sci (Paris) 2007 ; 23 : 667-70. 43. Coulombel L. Cellules iPS humaines : déjà ! Med Sci (Paris) 2008 ; 24 : 102-4. |