| |
| Med Sci (Paris). 2010 November; 26(11): 981–985. Published online 2010 November 15. doi: 10.1051/medsci/20102611981.Thérapie cellulaire dans l’oreille interne Nouveaux développements et perspectives Aziz El-Amraoui1* and Christine Petit1 1Institut Pasteur, Unité de génétique et physiologie de l’audition, Inserm UMRS587, UPMC Paris 06, 25 rue du Docteur Roux, 75015 Paris, France |
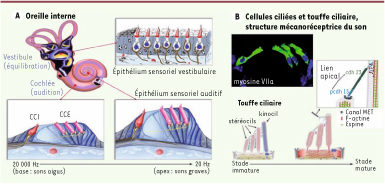
Les atteintes sévères de l’audition qui surviennent en période prélinguale affectent la communication entre individus, freinent l’acquisition du langage oral et les apprentissages scolaires, tout particulièrement celui de la lecture. On estime qu’un individu sur 500 souffre d’une perte sévère de l’audition avant l’âge adulte. Dans plus de la moitié des cas, la surdité est d’origine génétique. Quelle que soit son origine, hérédité, traumatisme acoustique, prise de médicaments ototoxiques, exposition au bruit ou vieillissement, la perte auditive est souvent due à des lésions irréversibles des cellules sensorielles auditives, les cellules ciliées. L’oreille interne abrite l’organe sensoriel de l’audition, la cochlée, et l’organe de l’équilibration, le vestibule. Les cellules sensorielles de l’oreille interne (ou cellules ciliées) présentent à leur surface apicale une touffe ciliaire qui, dans la cochlée, est le siège de la transduction mécano-électrique du son (Figure 1A, B), c’est-à-dire de la conversion des signaux acoustiques en variations du potentiel de membrane. On distingue deux types de cellules ciliées : les unes, internes (CCI), organisées en une rangée unique de 3 000 à 3 500 cellules, et les autres, externes (CCE), qui sont au nombre de 9 000 à 12 000 et sont organisées en trois rangées. Les CCI sont les véritables cellules sensorielles. Leur dépolarisation conduit à la libération du neurotransmetteur (glutamate). L’activation des neurones auditifs primaires qui en résulte est ensuite transmise à travers les voies auditives jusqu’au cortex auditif. En revanche, les CCE ne transmettent pratiquement pas d’information vers les centres auditifs. Elles effectuent une sorte de prétraitement sélectif du signal sonore, qu’elles amplifient d’autant plus qu’il est plus faible. Elles rendent ainsi compte de l’extrême sensibilité de l’audition et de sa remarquable discrimination fréquentielle, en particulier pour les fréquences du langage parlé. Chez l’homme, le spectre des fréquences sonores perceptibles s’étend de 20 Hz à 20 kHz. Chaque fréquence est analysée à un emplacement spécifique le long de la cochlée. La base de la cochlée (où les cellules sensorielles, les CCE en particulier, sont plus courtes et plus rigides) est dévolue à l’analyse des hautes fréquences (sons aigus), et l’apex (les CCE y sont plus longues et plus souples) à celle des basses fréquences (sons graves) [
1].  | Figure 1
Organisation Fonctionnelle de l’oreille interne. A. Représentation schématique de l’oreille interne (vestibule et cochlée) et de l’épithélium sensoriel auditif (organe de Corti). Les cellules ciliées internes (CCI) et externes (CCE) sont entourées de cellules de soutien hautement spécialisées. Leurs propriétés et celles des neurones auditifs primaires qui forment des synapses avec les CCI varient de façon graduelle de la base à l’apex de la cochlée. B. Les cellules sensorielles de l’organe de Corti sont ici marquées par un anticorps dirigé contre la myosine VIIa. La touffe ciliaire est composée de 20 à 300 microvillosités rigides, les stéréocils, organisés en 3 rangées de taille croissante et emplis de filaments d’actine (pontés par l’espine). Les stéréocils sont connectés les uns aux autres par des liens fibreux, dont la nature et l’organisation varient au cours de la différenciation de la touffe ciliaire. Le lien apical (tip link), composé d’un hétérodimère de cadhérine 23 et de protocadhérine 15, unit le sommet d’un stéréocil au côté du stéréocil adjacent appartenant à la rangée de plus grande taille. Ce lien est associé à la machinerie de transduction mécano-électrique. |
|
L’aptitude des cellules ciliées à se régénérer est perdue chez les mammifères Chez les vertébrés, l’audition remonte aux gnatostomes, poissons à mâchoire apparus il y a environ 440 millions d’années. Le vestibule, dont la structure est semblable à celle du vestibule des mammifères, est capable de détecter des ondes de pressions de fréquence inférieure à 800 Hz. Chez les tétrapodes, au moment du passage de la vie aquatique à la vie terrestre, apparaît un organe indépendant du vestibule, exclusivement dédié à l’audition. L’évolution des vertébrés s’est accompagnée d’une extension du spectre des fréquences décelées vers les hautes fréquences, jusqu’à 12 kHz chez certains oiseaux, et jusqu’a 150 kHz chez certains mammifères (chauve-souris et dauphins). Plusieurs innovations morpho-fonctionnelles (apparition de l’oreille moyenne et externe, allongement de l’organe sensoriel auditif, apparition de la membrane basilaire sur laquelle repose l’épithélium auditif, émergence de deux types de cellules sensorielles distinctes : les cellules sensorielles courtes et longues chez les oiseaux, CCI et CCE chez les mammifères) ont accompagné l’amélioration des performances du système auditif, tant en ce qui concerne la localisation de la source sonore que la sensibilité et la gamme fréquentielle des sons perçus [
2,
3]. Pour des raisons encore mal comprises, la capacité de régénération des cellules ciliées tout au long de la vie de l’animal a été perdue chez les mammifères [
4–
7]. Ainsi chez l’homme, le nombre de cellules ciliées est fixé avant la naissance, et leur atteinte, dans la cochlée comme dans le vestibule, entraîne un déficit sensoriel irréversible. À ce jour, le seul traitement d’un déficit profond de l’audition est prothétique. Il consiste en un appareillage acoustico-électrique (implant cochléaire) qui traite le signal sonore pour le convertir en un signal électrique délivré à des électrodes qui stimulent directement les neurones auditifs en court-circuitant les cellules ciliées. Le développement du traitement numérique des signaux sonores a permis une amélioration des performances de l’implant cochléaire. Cependant, si l’implantation cochléaire est bien adaptée pour une écoute dans le silence, elle ne restitue ni une bonne écoute de la parole dans le bruit, ni une écoute satisfaisante de la musique. L’exploration de pistes thérapeutiques nouvelles pour restaurer l’audition chez l’homme s’avère ainsi pleinement justifiée. Recréer les conditions d’une régénération des cellules ciliées auditives chez les mammifères ouvrirait des perspectives intéressantes pour traiter bon nombre de surdités. |
Cellules souches et thérapie cellulaire dans l’oreille interne Les succès récents de la médecine régénératrice chez l’animal suscitent beaucoup d’espoirs quant à son application possible dans diverses maladies (diabète, sclérose en plaques, rétinopathies pigmentaires, maladies neurodégénératives, immunitaires, cardiovasculaires, etc.) [
8]. Dans ce contexte, des recherches similaires ont été entreprises dans l’oreille interne des mammifères pour rechercher la présence de cellules souches et tenter d’induire leur différenciation en cellules ciliées [4,
9,
10]. L’équipe dirigée par Stefan Heller a pu montrer que des cellules progénitrices provenant de cellules souches embryonnaires ou de l’utricule (un des organes sensoriels du vestibule) de la souris adulte sont capables de se différencier en cellules exprimant des protéines caractéristiques des cellules ciliées auditives [4,
11]. Toutefois, les cellules néoformées n’adoptent un phénotype de cellules ciliées in vivo que si elles sont placées dans un environnement approprié, notamment si elles sont greffées dans la vésicule otique d’embryons de poulet. Chez ces embryons, les cellules situées en dehors de l’épithélium otique ne produisent aucune protéine caractéristique des cellules ciliées auditives. Mettant à profit les avancées scientifiques récentes réalisées dans le domaine des cellules souches et de la reprogrammation de cellules somatiques [
12,
13], S. Heller et al. ont continué d’améliorer les conditions expérimentales permettant de produire plus efficacement des cellules ciliées fonctionnelles, c’est-à-dire qui opèrent la mécanotransduction auditive. Les progrès réalisés font l’objet d’un article publié dans l’édition du 14 mai 2010 du journal Cell [
14]. Pour détecter les cellules ciliées, les chercheurs ont utilisé des souris transgéniques qui expriment le gène rapporteur codant pour la GFP (green fluorescent protein) nucléaire (nGFP), sous le contrôle de l’enhancer du gène Math1 (souris Math1-GFP), un gène dont l’expression est précoce et restreinte dans la cochlée aux cellules sensorielles [
15]. Deux types de cellules souches pluripotentes ont été utilisées : cellules souches embryonnaires (ES, embryonic stem cells) et cellules « reprogrammées » (iPS, induced pluripotent stem cells). Quatre lignées de cellules souches embryonnaires (toutes exprimant la nGFP), ont ainsi été isolées à partir d’embryons au stade blastocyste, après culture sur des cellules nourricières MEF (mouse embryonic fibroblasts), en présence du facteur LIF1 (leukemia inhibitory factor). Les lignées iPS ont été obtenues à partir de fibroblastes embryonnaires provenant de souris Math1-nGFP, transfectés avec des vecteurs rétroviraux permettant la synthèse d’Oct4, Sox2, Klf4 et cMyc, des facteurs de transcription nécessaires à la reprogrammation des fibroblastes en cellules pluripotentes. Les résultats obtenus avec les cellules ES et iPS sont comparables [14]. L’utilisation combinée de trois molécules, Dkk1 (dickkopf homolog 1), une protéine sécrétée qui inhibe la voie Wnt, SIS3, un inhibiteur sélectif de Smad3 qui interfère avec la signalisation du facteur de croissance TGF-β (transforming growth factor β), et l’IGF-I (insulin growth factor I), a permis la conversion de ces cellules pluripotentes en cellules de type ectoderme antérieur, région de l’ectoderme la plus sensible à l’induction otique. L’ajout ensuite de bFGF (basic fibroblast growth factor) a conduit à l’activation des voies de signalisation qui, au cours du développement embryonnaire [
5, 7,
16], induisent la formation de cellules progénitrices de cellules sensorielles (cellules ciliées et neurones primaires) et non sensorielles de l’oreille interne. Après le retrait des facteurs de croissance et la mise en culture des cellules sur gélatine en absence de sérum, une partie de ces cellules se sont différenciées en cellules produisant des protéines caractéristiques des cellules ciliées, sans en avoir toutefois les caractéristiques morphologiques. Des substrats susceptibles de permettre d’enrichir cette population en cellules ciliées différenciées ont ensuite été étudiés. Pour 104 cellules ES mises en culture sur la fibronectine, la gélatine, ou les cellules nourricières MEF, respectivement 955 ± 153, 857 ± 240, et 520 ± 95 ont synthétisé la nGFP. Parmi ces cellules, 37 ± 5, 12 ± 8, et 33 ± 12 cellules exprimaient la myosine VIIa (marqueur des cellules ciliées, voir Figure 1B), mais aucune ne produisait l’espine, protéine qui ponte les filaments d’actine de la touffe ciliaire (voir Figure 1B) et qui intervient dans sa croissance. Des résultats plus prometteurs ont en revanche été obtenus lorsque ces cellules étaient mises en culture en présence du stroma d’utricule de poulet inactivé par irradiation. Pour 104 cellules mises en culture, 1 186 ± 150 exprimaient la nGFP, 139 ± 49 produisaient la myosine VIIa, et parmi elles, 36 ± 7 synthétisaient l’espine. Les agrégats de cellules nGFP ont ensuite été analysés en microscopie optique et électronique. Bien que d’organisation disparate, les touffes ciliaires formées présentaient plusieurs des caractéristiques morphologiques des cellules sensorielles (voir Figure 1B). Les stéréocils étaient disposés en 3 ou 4 rangées de hauteur croissante, la rangée la plus haute étant la plus proche de l’unique véritable cil, le kinocil. Les stéréocils se rétrécissaient à leur base, juste au-dessus de leur insertion dans la membrane apicale de la cellule. Ils étaient reliés entre eux par des liens interstéréociliaires multiples, visualisés avec les anticorps dirigés contre la cadhérine 23. La présence de liens apicaux essentiels à la mécanotransduction auditive (voir Figure 1B) était également notée. C’est la première fois que des cellules ciliées ayant atteint un stade de différenciation si avancé sont produites à partir de cellules souches in vitro. Néanmoins, cette différenciation n’est intéressante que si les fonctions de la touffe ciliaire sont présentes. Aussi, les auteurs ont-ils analysé la réponse de ces touffes ciliaires néoformées à une stimulation mécanique. Cinquante-deux cellules ont pu être testées avec succès (42 dérivées de cellules ES et 10 de cellules iPS cultivées sur du stroma irradié d’utricule de poulet). Pour 45 cellules enregistrées, 24 cellules présentaient un courant de transduction mécano-électrique d’amplitude variable, allant de 14 pA à 340 pA (moindre que celle qu’on enregistre dans une touffe ciliaire normale mature). Ces expériences montrent que seule la mise en culture sur du stroma d’utricule de poulet fournit une combinaison de signaux (dont tous ne sont pas sécrétés) suffisante pour induire efficacement la formation d’une touffe ciliaire mécanosensible. La forme des touffes ciliaires (similaire à celle des cellules ciliées du vestibule et non de la cochlée) et les mesures de la polarité fonctionnelle de la touffe ciliaire montrent néanmoins qu’aucune des touffes ciliaires n’a atteint le stade de différenciation d’une touffe ciliaire de la cochlée mature. L’identification de la nature des signaux nécessaires à la croissance de la touffe ciliaire cochléaire, depuis sa formation durant le développement embryonnaire jusqu’à son stade mature, devrait permettre d’en comprendre les mécanismes sous-jacents. Grâce à ce travail sur les cellules souches pluripotentes, l’accès à des millions de cellules ciliées et la possibilité de contrôler leur différenciation ouvrent de nouveaux champs d’investigation, et constituent une opportunité expérimentale unique pour tenter de déterminer les mécanismes moléculaires et cellulaires responsables de la différenciation des cellules ciliées et tout particulièrement de la maturation de leurs touffes ciliaires, en utilisant les techniques d’interférence ARN et « -omiques » (transcriptome, protéome), etc. L’intérêt essentiel du potentiel de ces lignées réside dans leur utilisation pour l’établissement des modèles cellulaires des diverses atteintes de l’audition, et le test de l’effet de composés destinés à protéger ou à prévenir la dégénérescence et la perte des cellules ciliées. |
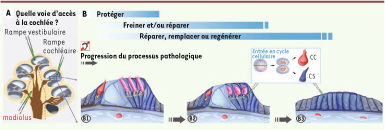
De la cellule à l’organe entier, un défi pour la thérapie cochléaire Quand auront été trouvées les conditions pour générer des cellules ciliées auditives matures et mécanosensibles, se posera la question essentielle de leur intégration dans la tonotopie cochléaire. L’architecture unique de la spirale cochléaire, avec son gradient différentiel base-apex, joue en effet un rôle-clé dans la transduction auditive. Aussi, pour une audition normale, les cellules réparées ou nouvellement différenciées doivent avoir des propriétés corrélées à leur position le long de la cochlée, et établir un couplage mécanique adéquat avec leurs cellules de soutien et avec les neurones qui les innervent (Figure 2A). Comme pour toute démarche thérapeutique, l’approche envisagée dans l’oreille interne devra être adaptée à la nature de l’atteinte auditive, de la (ou des) cellule(s) cible(s) de cette atteinte (cellules ciliées, cellules de soutien, ou neurones), et au problème à résoudre (prévention d’une détérioration supplémentaire, restauration fonctionnelle, remplacement cellulaire, etc.) (Figure 2B). De nombreuses difficultés doivent être surmontées, et plusieurs pistes peuvent être explorées [4, 5, 7, 16].  | Figure 2
Représentation schématique de la cochlée (A) et de l’évolution de l’état de l’épithélium sensoriel auditif lors d’une atteinte sévère de l’audition. A. Pour toute approche thérapeutique dans l’oreille interne, il est primordial de définir une voie d’entrée appropriée qui ne compromette pas l’homéostasie ionique particulière de cet organe. Les voies possibles sont la fenêtre ovale, le modiolus, ou l’une des rampes cochléaires. B. L’approche choisie devra être adaptée au degré de la détérioration de l’épithélium sensoriel auditif. Au début du processus pathologique, les cellules ciliées, les cellules de soutien, ainsi que les neurones auditifs sont encore présents (B1). Quand les cellules ciliées entrent en apoptose, les cellules de soutien (encore dans leur état différencié) et les neurones auditifs commencent à leur tour à dégénérer (B2). Enfin, à un stade terminal, les cellules ciliées et de soutien sont remplacées par un épithélium plat (B3). Si des succès sont enregistrés dans les recherches visant à prévenir et/ou freiner l’évolution de la perte des cellules ciliées, aucune tentative pour réactiver les capacités de transduction de l’épithélium plat n’a encore abouti. L’objectif à terme est de pouvoir remplacer les cellules endommagées par la stimulation, la régénération ou la transplantation de cellules progénitrices capables de se différencier en cellules ciliées. La possibilité de stimuler les cellules de soutien (CS) pour qu’elles se différencient en cellules ciliées (CC), soit par transdifférenciation, soit après un cycle de division cellulaire donnant naissance à une cellule de soutien et une cellule ciliée, mérite d’être considérée (Figure adaptée de [ 4,
18]). |
Plusieurs questions restent aujourd’hui sans réponse : (1) pourquoi l’oreille des vertébrés non mammifères est-elle capable, tout au long de la vie, de renouveler spontanément, ou de régénérer suite à une agression par traumatisme acoustique ou des agents ototoxiques, les cellules ciliées perdues [
6, 7] ? Identifier les stimulus responsables de cette régénération permettra de guider au plan expérimental, chez les mammifères, la stimulation (ou la réactivation) des cellules en place afin de remplacer les cellules ciliées atteintes ; (2) l’identification des mécanismes moléculaires qui régissent la transdifférenciation des cellules de soutien en cellules ciliées peut également révéler de nouvelles cibles thérapeutiques [5,
17]. Néanmoins, sachant que les cellules de soutien de l’épithélium auditif ne sont pas présentes en grand nombre, un moyen efficace serait d’induire chez l’adulte un retour dans le cycle cellulaire des cellules restantes, puis d’orienter de manière contrôlée la différenciation de certaines cellules pour qu’elles forment des cellules ciliées sans risque d’apoptose (voir Figure 2B) ; (3) malgré les difficultés, les résultats en matière de thérapie génique par l’intermédiaire de certains vecteurs viraux sont encourageants [18]. Le transfert de gènes qui codent des facteurs de croissance ou des agents mitotiques constitue une approche intéressante dans la mesure où, pour des produits sécrétés, le choix des cellules cibles apparaît moins critique. Le contrôle précis de la cible cellulaire est en revanche essentiel pour la plupart des gènes exprimés dans les cellules ciliées, comme ceux qui codent Math1, la myosine VIIa ou d’autres protéines [
19] ; (4) en parallèle, et compte tenu du gradient base-apex de la partition cochléaire, des progrès en termes de transfert de gènes ou de transplantation de cellules sont nécessaires pour que ces techniques réparatrices puissent trouver une application clinique [16,
20]. En particulier, comment assurer la transplantation effective de cellules souches aux bons endroits le long de la spirale cochléaire (par perfusion directe ou d’autres techniques à déterminer), et comment concevoir des vecteurs viraux, efficaces et sûrs, capables d’infecter les cellules cibles appropriées et de leur conférer, de manière contrôlée, un taux et une durée d’expression adéquats du gène d’intérêt ? |
Il est aujourd’hui difficile d’estimer la place qu’occupera la thérapie cellulaire dans l’ensemble des approches thérapeutiques nouvelles qui se développent, thérapies géniques et pharmacologiques, pour restaurer l’audition chez les malentendants. Si les approches expérimentales susmentionnées ne semblent pas à brève échéance susceptibles d’apporter une réponse satisfaisante a la demande de soins, elles constituent cependant un socle de connaissances pour les thérapies futures. En revanche, pour les surdités d’apparition tardive ou progressive, on peut espérer dans les prochaines années assister à des avancées portant sur la protection des cellules sensorielles auditives. On peut également s’attendre à ce que des stratégies associant ingénierie des tissus vivants et prothèses auditives puissent êtres rapidement mises en œuvre, implantation cochléaire et greffe de neurones par exemple. En attendant, ces difficultés appellent une prise de conscience sur la nécessité pour chacun de préserver son capital de cellules ciliées, et donc de se protéger contre les agressions environnementales qui le menacent. Si la législation encadre depuis longtemps et de façon assez efficace la protection auditive dans le milieu professionnel, le secteur des loisirs constitue une menace grandissante pour l’audition, en particulier chez les jeunes. |
Les auteurs déclarent n’avoir aucun confit d’intérêts concernant les données publiées dans cet article.
|
Les auteurs remercient Jean-Pierre Hardelin pour ses commentaires sur ce manuscrit, ANR-07-MRARE-009-01, Fondation R. & G. Strittmatter, et FP7-TREATRUSH pour leur soutien. Nous prions ceux dont les travaux ne sont pas mentionnés faute de place de bien vouloir nous en excuser.
|
1. Legendre K, Petit C, El-Amraoui A. La cellule ciliée externe de la cochlée des mammifères : un amplificateur aux propriétés exceptionnelles. Med Sci (Paris) 2009 ; 25 : 117-20. 2. Manley GA. Cochlear mechanisms from a phylogenetic viewpoint. Proc Natl Acad Sci USA 2000 ; 97 : 11736-43. 3. Fritzsch B, Beisel KW, Pauley S, Soukup G. Molecular evolution of the vertebrate mechanosensory cell and ear. Int J Dev Biol 2007 ; 51 : 663-78. 4. Brigande JV, Heller S. Quo vadis, hair cell regeneration? Nat Neurosci 2009 ; 12 : 679-85. 5. Kwan T, White PM, Segil N. Development and regeneration of the inner ear. Ann NY Acad Sci 2009 ; 1170 : 28-33. 6. Warchol ME. Sensory regeneration in the vertebrate inner ear: differences at the levels of cells and species. Hear Res 2010 (sous presse) doi : 10.1016/j. heares. 2010.05.004. 7. Cotanche DA, Kaiser CL. Hair cell fate decisions in cochlear development and regeneration. Hear Res 2010 ; 266 : 18-25. 8. Teo AK, Vallier L. Emerging use of stem cells in regenerative medicine. Biochem J 2010 ; 428 : 11-23. 9. Wei D, Levic S, Nie L, et al. Cells of adult brain germinal zone have properties akin to hair cells and can be used to replace inner ear sensory cells after damage. Proc Natl Acad Sci USA 2008 ; 105 : 21000-5. 10. Pauley S, Kopecky B, Beisel K, et al. Stem cells and molecular strategies to restore hearing. Panminerva Med 2008 ; 50 : 41-53. 11. Zine A. Des cellules souches pour corriger les surdités neurosensorielles ? Med Sci (Paris) 2004 ; 20 : 518-20. 12. Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell 2006 ; 126 : 663-76. 13. Jaenisch R, Young R. Stem cells, the molecular circuitry of pluripotency and nuclear reprogramming. Cell 2008 ; 132 : 567-82. 14. Oshima K, Shin K, Diensthuber M, et al. Mechanosensitive hair cell-like cells from embryonic and induced pluripotent stem cells. Cell 2010 ; 141 : 704-16. 15. Lumpkin EA, Collisson T, Parab P, et al. Math1-driven GFP expression in the developing nervous system of transgenic mice. Gene Expr Patterns 2003 ; 3 : 389-95. 16. Groves AK. The challenge of hair cell regeneration. Exp Biol Med (Maywood) 2010 ; 235 : 434-46. 17. White PM, Doetzlhofer A, Lee YS, et al. Mammalian cochlear supporting cells can divide and trans-differentiate into hair cells. Nature 2006 ; 441 : 984-7. 18. Shibata SB, Raphael Y. Future approaches for inner ear protection and repair. J Commun Disord 2010 ; 43 : 295-310. 19. El-Amraoui A, Lefèvre G, Hardelin JP, Petit C. Syndrome de Usher de type 1 et développement de la touffe ciliaire des cellules sensorielles de l’oreille interne. Med Sci (Paris) 2005 ; 21 : 737-40. 20. Jongkamonwiwat N, Zine A, Rivolta MN. Stem cell based therapy in the inner ear: appropriate donor cell types and routes for transplantation. Curr Drug Targets 2010 ; 11 : 888-97. |