Depuis de nombreuses années les chimistes organiciens ont cherché à former ces liaisons carbone-carbone qui permettent de créer des édifices moléculaires complexes et originaux. En 1912, le chercheur français Victor Grignard reçut le prix Nobel de chimie pour le développement et les applications en synthèse des organomagnésiens, composés organométalliques comportant ici une liaison carbone-magnésium et qui seront également appelés les réactifs de Grignard. Cette découverte ouvrit la voie à l’utilisation des composés organométalliques en synthèse organique, les chercheurs s’efforçant d’élargir le champ d’application de ces réactions de couplage et de faciliter leur mise en oeuvre.
Richard F. Heck, Ei-ichi Negishi et Akira Suzuki ont été récompensés pour avoir développé indépendamment des méthodes de couplage croisé catalysées par le palladium. Ces méthodes permettent de créer un lien - appelé liaison carbone-carbone - entre deux molécules organiques différant en un point précis, à l’aide d’un catalyseur contenant le palladium, pour former une molécule plus complexe difficile à synthétiser à l’aide de réactions conventionnelles. Leurs travaux ont ainsi permis de créer l’un des outils de synthèse les plus performants de la chimie organique moderne.
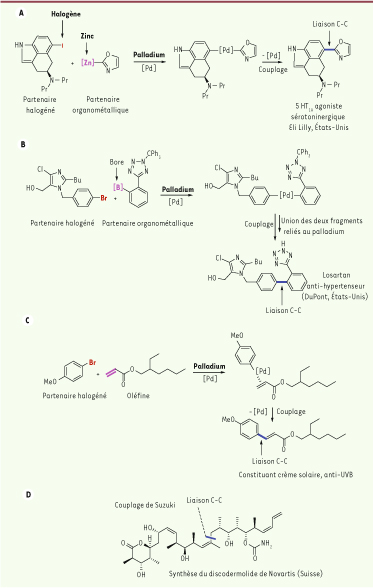
Un exemple d’application industrielle de ces réactions est la synthèse d’un agoniste du récepteur sérotoninergique 5-HT1A par le groupe pharmaceutique Eli Lilly (Figure 1A) [ 1]. Les deux molécules qui vont se coupler possèdent chacune un point d’ancrage (métal pour l’une, halogène pour l’autre) qui va leur permettre de se fixer sur le palladium. Les propriétés particulières de ce métal noble vont ensuite induire une union des deux molécules régénérant ainsi le catalyseur. La réaction mise en jeu porte le nom de son inventeur : Negishi. Cette réaction de couplage, découverte en 1976, utilise ici les dérivés du zinc comme partenaires organométalliques [ 2]. L’excellente compatibilité des organozinciques avec de nombreuses fonctions organiques va permettre de synthétiser une grande variété de composés de manière douce et sélective.
| Figure 1
Contribution des trois prix Nobel à l’établissement de méthodes utilisant le palladium pour former des liaisons carbone-carbone, prérequis pour créer des édifices moléculaires complexes et originaux. A. Méthode de couplage croisé mettant en jeu des dérivés du zinc appliquée à la synthèse d’un agoniste 5-HT1A. B. Variante de cette réaction de couplage utilisant des dérivés du bore et utilisée dans la synthèse du Losartan. C. Introduction des oléfines dans la réaction de couplage. D. Application à la synthèse du discodermolide, un composé naturel issu de plantes, par les laboratoires Novartis. |
Deux ans plus tard, Akira Suzuki développa une variante de cette réaction de couplage catalysée par le palladium. Ce chercheur japonais a montré que les dérivés du bore pouvaient être de très bons partenaires organométalliques pour ces réactions de couplage en raison de leur stabilité, de leur sélectivité, de leur non-toxicité et de leur facilité d’accès. Cette réaction a suscité un grand intérêt dans la communauté des chimistes organiciens et connaît de nombreuses applications aussi bien dans le milieu académique qu’industriel [ 3]. Un exemple d’application industrielle de ces réactions de couplage est la synthèse du Losartan, médicament de la famille des sartans (antagonistes des récepteurs AT1 de l’angiotensine II) développé par la Société DuPont et utilisé dans le traitement de l’hypertension artérielle (Figure 1B) [ 4].
Richard Heck avait auparavant fait progresser la chimie du palladium en synthèse organique, la technique élaborée par ce chercheur pour former les liaisons carbone-carbone étant ici différente, une oléfine remplaçant le partenaire organométallique1 [ 5]. Une association du palladium sur cette oléfine permet de créer un lien entre les deux partenaires mis en jeu dans cette réaction pour former en une seule étape des composés styréniques. La synthèse rapide et efficace d’un constituant de crème solaire utilise cette réaction (Figure 1C) [ 6].
La découverte de ces réactions de couplage catalysées par le palladium a également permis de synthétiser des substances organiques complexes présentes dans la nature et possédant des propriétés biologiques prometteuses. Un exemple est donné par le discodermolide, substance isolée en 1990 d’une éponge de la mer des Caraïbes avec un rendement de 0,002 % à partir de la matière sèche de l’éponge et qui s’est avéré posséder des propriétés antitumorales intéressantes [ 7]. La faible disponibilité naturelle de cette molécule complexe a nécessité de la reproduire en laboratoire afin de disposer de quantités suffisantes pour effectuer des tests biologiques. Des chimistes organiciens du groupe pharmaceutique Novartis ont ainsi développé une synthèse totale du discodermolide (environ 60 g) dont une étape permettant de relier deux fragments de la molécule utilise une réaction de Suzuki (Figure 1D) [ 8– 12].

Comme l’a souligné le comité Nobel, les réactions de couplage au palladium développées par ces trois chimistes interviennent dans de très nombreux processus chimiques (environ 25 %) utilisés actuellement dans l’industrie pharmaceutique [ 13, 14]. Ces travaux sont également exploités par l’industrie électronique puisqu’ils ont permis de synthétiser les OLED, diodes électroluminescentes organiques présentes dans les nouveaux prototypes d’écrans plats [ 15]. Nul doute que de nombreuses applications industrielles issues de ces travaux de recherche fondamentale innovante continueront à être développées dans des domaines très variés et inattendus.