| |
| Med Sci (Paris). 2010 December; 26(12): 1103–1109. Published online 2010 December 15. doi: 10.1051/medsci/201026121103.De l’imagerie médicale à la thérapie guidée par l’image Représentation en sciences du vivant (3) Jean-Louis Coatrieux,1* Jérôme Velut,1 Jean-Louis Dillenseger,1 and Christine Toumoulin1 1Laboratoire Traitement du signal et de l’image, Inserm U642, Université de Rennes 1, 35000 Rennes, France |
Présenter l’imagerie médicale se résume souvent a décrire les sources ou les modalités d’observation dans leurs principes physiques et le faire en quelques pages est déjà une gageure. Ce n’est cependant que la partie émergée de ce domaine et il convient à notre sens de resituer ces principes physiques dans une vision plus large afin de souligner toutes les composantes inter- venant non seulement dans les processus de formation ou de génération des images, mais aussi dans leur interprétation et leur exploitation à des fins thérapeutiques. C’est l’objet de cet article. Il n’est pas question cependant de prétendre décrire en détail ces différents aspects, des livres entiers leur étant consacrés, ni de parcourir l’ensemble des techniques disponibles. Nous avons donc choisi, de manière quelque peu arbitraire, de mettre l’accent sur un certain nombre de ces techniques, en les abordant de manière succincte à travers certaines de leurs facettes, en particulier leurs limites actuelles et les ruptures technologiques potentiellement attendues, afin de dégager une vue prospective des recherches en cours. Il s’agira aussi de montrer la place occupée par l’image dans des procédures non plus diagnostiques mais chirurgicales, et plus largement thérapeutiques, basées sur de nouveaux paradigmes d’effecteurs physiques couplés parfois à un volet pharmaceutique. |
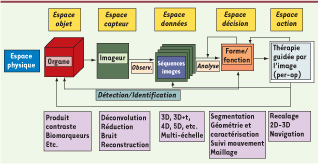
Une vision globale : la chaîne image Si la physique (et, comme nous le verrons plus loin, la chimie) joue un rôle essentiel dans la capture de l’information, elle est loin de couvrir tous les aspects indispensables à la formation de l’image et à son utilisation clinique. La Figure 1 illustre quelques-uns de ces maillons fondamentaux pour la formation de l’image, en séparant les différents espaces dans lesquels ils opèrent. 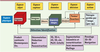 | Figure 1
Représentation conceptuelle de l’ensemble des composantes intervenant dans la chaîne d’imagerie. Ces composantes sont catégorisées sous forme d’espaces successifs : objet, capteurs, données, décision, action et mettant en évidence les différentes disciplines impliquées (physique, chimie, mathématiques, traitement de l’information, etc.). |
-
L’espace objet correspond bien entendu à un organe ou un ensemble d’organes (voire au corps entier) mais aussi à une lésion (fracture osseuse, tumeur, plaque d’athérome, etc.). Cet objet peut être statique ou en mouvement, un élément de tissu superficiel ou une structure volumique profonde.
-
L’espace capteur correspond à la technique d’observation concernée qui permet d’explorer cet objet dans son ensemble ou en partie, au niveau macroscopique comme au niveau microscopique (ou plus finement encore), dans sa forme, son architecture ou dans sa fonction. La mesure est constituée de signaux scalaires ou vectoriels dont les bandes de fréquence sont très variables1.
-
Les images (espace données, 2D, 3D ou séquences temporelles, etc.) ne sont obtenues qu’après la mise en œuvre de techniques de traitement du signal et d’algorithmes de reconstruction, la plupart du temps complexes, permettant de corriger des défauts intrinsèques aux capteurs (bruits, distorsions) et aux interactions multiples onde-matière. Ces méthodes relèvent en grande partie des mathématiques. Cependant, des artéfacts restent souvent présents et sont liés aux méthodes de reconstruction elles-mêmes mais aussi aux mouvements des objets au cours de l’acquisition. La résolution finale obtenue en espace et en temps et le contraste entre objets dépendent de l’ensemble de ces facteurs. L’accès à l’image s’accompagne souvent de l’injection d’agents de contraste (rehaussement des structures vasculaires en imagerie X), de biomarqueurs pour mettre en évidence des lésions ou des processus biologiques spécifiques et de composés radiopharmaceutiques (traceurs) qui sont à la base même de la génération de l’image de médecine nucléaire (voir le paragraphe intitulé « Les modalités d’imagerie médicale »).
-
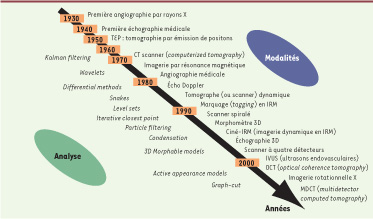
L’espace décision nous fait entrer dans une autre discipline : la vision par ordinateur, un domaine de recherche à part entière. Il s’agit là d’abord d’extraire l’information pertinente (un objet parmi d’autres, un mouvement, etc.) portée par les images à des fins d’interprétation clinique. Les méthodes de segmentation2 y tiennent une large place et ont évolué de manière importante (Figure 2), en parallèle et indépendamment des avancées constatées pour les capteurs (modèles déformables de Terzopoulos [
1] et de Sethian [
2], Graph-Cut de Boykov [
3], etc.). De même, les algorithmes d’estimation et de suivi de mouvement, pour caractériser la cinétique cardiaque par exemple ou améliorer la reconstruction par correction de la respiration, ont connu des avancées considérables [
4]. Ceci est également le cas pour les algorithmes portant sur les techniques de recalage utiles pour confronter des examens d’images de même type mais acquises à des moments distincts, pour fusionner des modalités d’images différentes (multimodales).
-
Il ne suffit pas cependant d’être capable de porter un diagnostic, il faut aussi pouvoir apporter une réponse thérapeutique. C’est dans l’espace action que l’image joue un rôle essentiel à la fois dans la préparation (c’est la phase de planning) et de réalisation (le guidage) de la thérapie. Cette phase action est loin d’être simple et met en jeu l’ensemble des composantes de la chaîne image mais en ajoute d’autres. Il peut s’agir dans le premier cas de simuler les déformations apportées par les actions à accomplir (interaction instrument-tissu comme lors de l’introduction d’une sonde endovasculaire) et, dans le second, de localiser en temps réel les instruments relativement aux organes (pour atteindre une cible, suivre une trajectoire précalculée, etc.).
 | Figure 2
Représentation simplifiée de l’évolution des sources d’imagerie médicale (partie supérieure) et des méthodes de traitement de l’information en signal et en image (partie inférieure). Cette représentation illustre l’importance du développement des méthodes d’analyse dans celui de l’imagerie. La plupart des méthodes algorithmiques indiquées traitent de la segmentation : wavelet (ondelette), snakes et level sets (modèles déformables). D’autres visent à l’estimation de mouvements comme differential methods (méthodes différentielles) ou particle filtering (filtre particulaire) et au recalage avec iterative closest point (algorithme du point le plus proche) (d’après [
5]). |
Plusieurs éléments ne sont pas représentés dans la Figure 1. Nous en évoquerons trois. Tout d’abord, les phases pré-, peret postopératoires n’y apparaissent pas alors qu’elles restent fondamentales dans la prise en compte clinique des patients et permettent d’apporter une vision complémentaire sur les processus suivis et les méthodes mises en œuvre. La dimension multimodale et multi-échelle peut quant à elle se projeter sur le même schéma par simple extension de l’espace capteur et de l’espace données. Cependant, et nous y reviendrons dans le prochain paragraphe, la conception de capteurs multimodaux intégrés (comme des antennes IRM [imagerie par résonance magnétique] couplées à l’optique), ou mieux, l’encodage dans un signal multiphysique (optique-ultrasons par exemple) à l’origine même de l’image, font partie des défis de demain. Enfin, seul l’espace physique est considéré ici. L’espace virtuel au sens de la modélisation des organes, mais aussi des capteurs, des simulations de segmentation, de recalage, peut y être ajouté en développant une chaîne parallèle identique à celle présentée dans la Figure 1 [
6]. Ces modélisations ont de multiples intérêts et en particulier celui d’établir un lien formel entre paramètres physiologiques et mesures effectuées sur l’image ou les séquences d’images. |
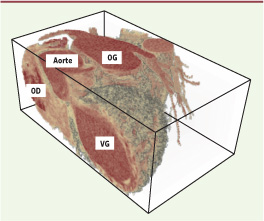
Les modalités d’imagerie médicale Les principes physiques mis en jeu dans les différentes sources d’images sont très divers et apportent des éclairages le plus souvent complémentaires sur le corps humain, que ce soit sur le plan morphologique ou sur le plan fonctionnel. Ces sources d’images sont aussi en compétition en termes de marché, ce qui explique certainement les avancées permanentes dont elles sont l’objet. À côté des sources reconnues comme majeures, l’imagerie par résonance magnétique, le tomodensitomètre ou scanner X, la tomographie par émission, des techniques comme les ultrasons et l’optique présentent des avantages de plus en plus concurrentiels (coût, portabilité, temps réel, diversité des applications, etc.). Les résolutions spatiales et temporelles représentent certes un enjeu permanent pour l’observation de structures et de processus dynamiques, mais l’accès à des paramètres physiologiquement interprétables est au moins aussi important. Nous n’aborderons pas toutes les sources d’image dans ce paragraphe. L’imagerie par rayons X en sera absente par exemple. Les derniers développements du scanner X ne sont pas pour autant négligeables avec les détecteurs multibarette qui donnent accès non seulement à la totalité (ou presque) des structures du cœur, y compris les artères et les veines (non accessibles par IRM avec une résolution suffisante), mais aussi au cœur 3D en mouvement avec une résolution temporelle de vingt images par seconde (Figure 3). Nous avons préféré nous concentrer sur l’imagerie par résonance magnétique, la tomographie d’émission, les ultrasons et l’optique. 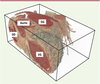 | Figure 3
Image tomodensitométrique du cœur. Visualisation 3D par rendu de volume avec coupe planaire. VG : ventricule gauche ; OG et OD : oreillettes gauche et droite et aorte. Résolution : 0,3 mm × 0,3 mm × 0,6 mm ; volume original : 512 × 512 × 132 voxels (projet IMOP, LTSI, UMR 642, Université de Rennes 1). |
Imagerie par résonance magnétique De nombreux développements ont eu lieu ces dernières années en spectroscopie et en imagerie par résonance magnétique (respectivement SRM et IRM 3,). Audelà de l’amplitude des champs magnétiques statiques (de 0,2 à 3 tesla et plus), les antennes (de surface ouendoscopiques) radiofréquence (RF) 4 et les réseaux d’antennes représentent un enjeu technologique majeur afin de garantir une uniformité d’intensité, un rapport signal-à-bruit satisfaisant, une résolution spatiale élevée avec des vitesses d’acquisition plus rapides tout en réduisant le nombre d’impulsions d’excitation (imagerie parallèle avec réseau d’antennes). Des méthodes de parcours (en spirale par exemple) du volume avec sousou sur-échantillonnage, uniforme ou pas, des techniques mathématiques de régularisation non quadratique et d’inversion non linéaire contribuent aussi significativement à ces avancées. L’IRM a de nombreuses applications cliniques : détection d’anomalies tissulaires (cancer), vasculaires (anévrismes) et cardiaques (y compris, mais plus récemment, les coronaires vues de manière statique). L’acquisition rapide écho-planaire (permettant l’acquisition du plan de Fourier d’une image en une seule impulsion radiofréquence au lieu d’une ligne de ce plan dans les techniques classiques) a permis l’émergence de l’IRM de diffusion traduisant statistiquement en chaque élément de volume (voxel) la distribution des déplacements microscopiques des molécules d’eau résumée par le coefficient de diffusion apparent proposé par D. Le Bihan [
7]. Cette mobilité moléculaire n’étant pas forcément identique dans toutes les directions de l’espace, une anisotropie peut être observée, en particulier pour les faisceaux nerveux majeurs du cerveau, et a donné naissance à l’imagerie en tenseur de diffusion (Figure 4) [
8].  | Figure 4
Imagerie de faisceaux nerveux du cerveau par IRM de tenseur de diffusion (avec l’autorisation de C. Poupon, J.F. Mangin, D. Le Bihan, et al. NeuroSpin/CEA, Orsay, France). |
Imagerie nucléaire Les principes mis en jeu en imagerie nucléaire (tomographie d’émission monophotonique, TEMP, ou à positons, TEP) sont radicalement différents de ceux de l’IRM [
9]. Ils sont fondés sur l’utilisation d’un traceur composé d’un vecteur moléculaire comportant un isotope radioactif qui permet de localiser la distribution de la molécule au sein de l’organisme (une imagerie 3D du corps entier est aujourd’hui disponible) sans modifier ses propriétés biologiques. En TEP, et sans entrer dans les détails, le positon est de masse égale à l’électron mais de charge opposée et, lors d’une réaction d’annihilation, deux photons de 511 keV sont émis dans des directions opposées. Le principe est donc de détecter ces photons par coïncidence temporelle (fenêtre de 5 à 15 ns, associée à une fenêtre en énergie) afin d’estimer le lieu de cette réaction. De nombreux facteurs vont intervenir cependant, expliquant les limites intrinsèques de cette modalité d’image en résolution spatiale (de l’ordre de 3-4 mm) : la nonconcordance entre le lieu de la réaction et la position de l’émission du rayonnement β+, la non-colinéarité des trajectoires, les évènements aléatoires, etc. D’autres difficultés sont à prendre en compte : technologiques (limitations des détecteurs, c’est-à-dire scintillateurs et photomultiplicateurs), méthodologiques (algorithmes de reconstruction tomographique) et physiques avec l’effet Compton (perte d’énergie et changements de direction), l’effet de volume partiel (sous-estimation des concentrations dans les lésions de petite taille, par exemple), l’atténuation par les tissus (sous-évaluation pour les lésions profondes), etc. Les développements récents de systèmes couplant tomodensitomètre et TEP vont permettre non seulement de corriger l’atténuation mais aussi d’offrir un repère anatomique essentiel à leur interprétation sans obliger à un recalage d’images. La résolution de cet ensemble de problèmes détermine les possibilités de quantification en tomographie d’émission. Il s’agit bien in fine de mesurer les concentrations radioactives dans les organes mais aussi de les corréler à des fonctions physiologiques (métabolisme cellulaire du glucose ou densité des récepteurs, modèles compartimentaux), de comparer ces mesures pour des populations de patients et de pouvoir évaluer une réponse thérapeutique. La TEP, par sa capacité à détecter les altérations métaboliques, a ainsi comme principale application clinique le diagnostic du cancer (côlon, poumon, cerveau, œsophage, etc.) mais aussi la mesure de viabilité fonctionnelle du myocarde. Elle peut aussi être utile dans l’évaluation du pronostic et du suivi d’une thérapie. En cancérologie, le traceur le plus courant est le 18-fluoro-2-déoxyglucose (18FDG), un analogue du glucose qui marque les sites tumoraux où une surexpression des transporteurs membranaires du glucose est observée. Ces traceurs, ou radiopharmaceutiques, sont donc des éléments essentiels sur lesquels une recherche active est menée, mais toute la chaîne image (capteurs, reconstruction, corrections,...) est évidemment concernée. Les ultrasons Les ultrasons (nous n’évoquerons pas ici le Doppler), une autre modalité d’image en pleine évolution [
10], permettent l’accès aux structures anatomiques à partir de l’amplitude des échos rétrodiffusés lors de la propagation d’impulsions mécaniques de haute fréquence dans les tissus (2 à 10 MHz). Ils occupent une place de plus en plus importante en médecine du fait de leur caractère non ionisant, de leur faible prix, de leur capacité à fournir des informations en temps réel et de la diversité des applications qu’ils offrent (les limitations étant la mauvaise propagation dans les gaz et la forte atténuation dans les structures osseuses). Les éléments technologiques-clés de cette imagerie sont entre autres les transducteurs (aujourd’hui basés sur des piézo-électriques mais qui pourraient demain faire appel à la technologie CMUT, capacitive micromachined ultrasonic transducers), la formation de voies (par combinaison des sorties du réseau de capteurs) et le traitement du signal associé, le type d’impulsions, les agents de contraste (microbulles par exemple). Les évolutions récentes et en cours concernent l’imagerie harmonique (fréquences multiples de la fréquence fondamentale), les sondes intravasculaires, l’élastographie, la tomographie ultrasonore et Doppler, la photoacoustique et la thermoacoustique. L’accès à la 3D, à des résolutions spatiales de l’ordre du micromètre, à des vitesses d’acquisition ultra rapides (plusieurs milliers voire dizaines de milliers d’images par seconde) font déjà partie de l’actualité et ces développements ne font que traduire le dynamisme du domaine. Tous mériteraient d’être explicités mais pour faire court, nous avons choisi de souligner une technique en émergence : l’imagerie de cisaillement supersonique permettant la cartographie in vivo du module de Young des tissus. Elle consiste en l’application d’une force de cisaillement (push-wave) produite par une série d’ondes ultrasonores focalisées à différentes profondeurs générant deux ondes planaires qui se propagent dans l’organe. Le retour à l’état d’équilibre observé par une imagerie ultra rapide (5 000 images par seconde) et une analyse du speckle (résultant de l’interférence des signaux rétrodiffusés par les inhomogénéités des tissus) permet de mesurer les déplacements tissulaires locaux et d’établir la carte d’élastographie par un algorithme d’inversion [
11]. Le concept « multi-onde » (multi-wave) mis en œuvre dans l’exemple précédent et proposé par M. Fink [
12] a une portée beaucoup plus générale. Il s’applique par exemple à l’imagerie acousto-optique [
13,
14] où un signal à faible résolution spatiale (optique) mais porteur de contraste peut être modulé par un autre (ultrason) à haute résolution et faible contraste. Imagerie optique L’optique dans le domaine visible, fondée sur la simple vision humaine ou à travers des microscopes, est certainement la plus ancienne modalité d’exploration du corps et des tissus. L’impact récent de la tomographie optique cohérente ( optical coherence tomography), en particulier pour l’imagerie micrométrique de l’œil [
15], ne doit cependant pas masquer les développements majeurs que l’on observe aujourd’hui pour des longueurs d’onde allant de l’ultraviolet à l’infrarouge. Les interactions avec les tissus sont complexes (dispersion, absorption, etc.) mais peuvent révéler des propriétés importantes sur leur structure et leur physiologie. L’imagerie optique haute résolution a déjà montré ce qu’elle peut apporter en exploration de surface par la mise en évidence de l’activation neuronale du cerveau ou des cancers de la peau (caractérisation des mélanomes par exemple). Dans la zone du proche infrarouge (0,78 à 1,4 μm), l’absorption par les tissus est plus réduite, ce qui ouvre de nombreuses perspectives pour l’analyse de la vascularisation et de la saturation en oxygène5 de structures profondes (quelques centimètres), d’autant plus que ce domaine bénéficie des développements de sondes fluorescentes (comme l’indocyanine vert). Dans le cancer du sein par exemple, les tumeurs très vascularisées sont détectables avec des résolutions de l’ordre du millimètre [
16]. L’imagerie optique diffuse (diffuse optical tomography) [
17], par résolution du problème direct puis inversion, représente une rupture technologique majeure par sa résolution, sa capacité à imager et quantifier indépendamment les propriétés d’absorption et de dispersion des tissus et de leur anomalies. L’utilisation de plusieurs longueurs d’onde peut de plus donner accès à des informations spectrales. La complémentarité offerte par l’imagerie optique vis-à-vis des autres sources d’images (IRM, TEP, ultrasons, etc.) conduit naturellement à des techniques hybrides ou multimodales. Celles-ci peuvent être envisagées simplement comme un enrichissement des mesures conduisant donc à une meilleure pertinence au plan diagnostique ou encore, et de manière similaire au couplage tomodensitomètre-TEP, comme un élément d’amélioration du modèle de problème direct en optique et donc de reconstruction de l’image optique. Les avancées technologiques en optique, le développement de sondes capables de marquer différentes fonctions physiologiques, l’amélioration de la résolution du problème inverse devraient amener une diversification croissante des applications médicales. |
Il serait paradoxal d’avoir à notre disposition des outils de plus en plus sophistiqués pour détecter et caractériser précocement les pathologies sans avoir simultanément des thérapies à proposer. Nous sommes donc ici dans l’espace action décrit précédemment et nous nous limiterons aux thérapies du cancer basées sur la physique et s’appliquant de manière externe, interstitielle ou intraluminale. L’imagerie conserve une place essentielle dans ce cadre dans la mesure où elle définit précisément la cible à atteindre, les organes sensibles à éviter et les trajectoires à suivre. Ces thérapies « physiques » ne sont pas si nombreuses [
18,
19], la première, et la référence pour le cancer, étant la radiothérapie [
20]. Outre les améliorations des dispositifs eux-mêmes comme la radiothérapie conformationnelle, la modulation d’intensité, le robot Cyber knife ou encore le Gamma knife (Figure 5) et l’arc thérapie (volumetric modulated arc therapy, VMAT), c’est l’intégration de l’image en planning et en guidage d’une part et, d’autre part, les techniques d’optimisation de dose par modélisation mathématique qui ont apporté des avancées importantes. 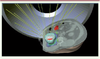 | Figure 5
Illustration du planning de traitement par un système Gamma knife rotationnel d’une lésion abdominale. Travaux du laboratoire LIST, SouthEast University, Chine, laboratoire international associé avec le LTSI, Inserm, Université de Rennes 1. Les lignes droites représentent les faisceaux d’irradiation convergeant sur la cible. |
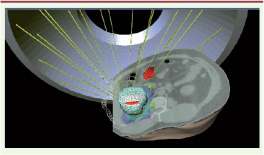
D’autres approches fondées sur la température (dont la mesure peut être faite soit par capteurs embarqués, soit par IRM) ont cependant émergé, comme la cryothérapie [
21] et les ultrasons haute énergie à côté des radiofréquences, des micro-ondes et des lasers [
22]. Elles procèdent par destruction des tissus. Arrêtons-nous un instant sur les ultrasons thérapeutiques ou HiFU (high intensity focused ultrasound) [
23]. Ils font partie, comme l’optique avec les lasers, de techniques permettant de voir (capture d’image) et d’agir (application d’une thérapie) et les transducteurs actuels intègrent ces deux fonctions (Figure 6). Leur validation clinique, en particulier pour le cancer de la prostate, est maintenant établie. Les recherches en cours visent à étendre leur spectre d’application et un des défis est de traiter des tumeurs cérébrales localisées en exploitant le principe de retournement temporel6 proposé par M. Fink et son équipe [
24,
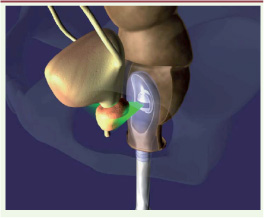
25]. 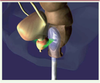 | Figure 6
Représentation par image de synthèse du transducteur HiFU pour le traitement du cancer de la prostate. En gris et bleu, le transducteur en forme de cuillère placé dans le rectum, au centre et en vert le faisceau échographique (avec l’autorisation de EDAP-TMS). |
Cette palette montre que l’imagerie multimodale peut trouver son alter ego en termes de thérapies multimodals. L’association de traitements pharmacologiques avec des dispositifs physiques en est un exemple. L’administration ciblée et contrôlée de molécules thérapeutiques (drug delivery) représente l’enjeu futur où la localisation de la cible apportée par l’image sera complétée par une activation optique, ultrasonore ou radiofréquence, etc. La convergence de ces approches nouvelles avec les procédures dites minimalement invasives et les techniques de thérapie assistée par l’image (la robotique médicale ou la chirurgie assistée par ordinateur, voir [
26] pour une revue récente) ne pourra qu’augmenter leur portée. |
Imageries moléculaire, métabolique, structurelle, toutes résultent d’une interaction entre ondes et propriétés du vivant, parfois encore mal comprise. Toutes sont issues d’un processus complexe de reconstruction et de traitement où tous les principes fondamentaux sont à l’œuvre, de la transmission et de l’émission à la réflexion. Ce que l’œil perçoit au final est une apparence d’une réalité qui par certains côtés nous échappe. Elles apportent cependant des informations de plus en plus précieuses et précoces sur les pathologies. Ainsi, en miroir, des exigences nouvelles sur le plan thérapeutique sont à affronter. Les évolutions observées ces dernières années en imagerie médicale vont se poursuivre et des ruptures technologiques vont voir le jour. Les capteurs resteront les acteurs-clés mais la chimie pour les biomarqueurs et les radiotraceurs, les mathématiques, le traitement du signal et de l’image seront aussi de la partie. Des tendances se font jour et devraient se renforcer, en particulier le couplage de modalités par intégration dans un même dispositif de modalités différentes et, plus intimement, dans la combinaison même des ondes émises. Il en sera de même avec le couplage capteur-effecteur. Le rapprochement entre traitements pharmacologiques dont l’effet est activé et amplifié par des moyens physiques s’inscrira dans la logique de guidage des thérapies par l’image. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
Footnotes |
1. Terzopoulos D, Fleischer K. Deformable models. The Visual Computer 1988; 4 : 306-31. 2.
Sethian J. Level set methods and fast marching methods-evolving interfaces in computational geometry, fluid mechanics, computer vision and materials science.Cambridge : Cambridge University Press, 1999. 3. Boykov Y, Kolmogorov V. An experimental comparison of min-cut/max-flow algorithms for energy minimization in vision. IEEE Trans Pattern Anal Mach Intell 2004; 26 : 1124-37. 4. Maintz JBA, Viergever MA. A survey of medical image registration. Medical Image Analysis 1998; 2 : 1-36. 5. Haigron P, Luo L, Coatrieux JL. Issues in image-guided therapy. IEEE Eng Med Biol Mag 2009; 28 : 96-8. 6. Coatrieux JL. Integrative science: biosignal processing and modelling. IEEE Eng Med Biol Mag 2004; 23 : 9-12. 7. Le Bihan D. Molecular diffusion nuclear magnetic resonance imaging. Magn Reson 1991; 7 : 1-30. 8. Le Bihan D. Major current applications of diffusion MRI. Phys Med Biol 2007; 52 : R57-90. 9. Muehllehner G, Karp JS. Positron emission tomography. Phys Med Biol 2006; 51 : R117-37. 10. Wells PNT. Ultrasound imaging. Phys Med Biol 2006; 51 : R83-98. 11. Bercoff J, Tanter M, Fink M. Supersonic shear imaging: a new technique for soft tissue elasticity mapping. IEEE Trans Ultrason Ferroelectr Freq Control 2004; 51 : 396-409. 12. Fink M, Tanter M. Multiwave imaging and super resolution. Physics Today 2010; 28-33. 13. Wang LV. Ultrasound-mediated biophotonic imaging: a review of acoustooptical tomography and photo-acoustic tomography. Disease Markers 2003; 19 : 123-38. 14. Selb J, Pottier L, Boccara AC. Nonlinear effects in acousto-optic imaging. Optics Letters 2002; 27 : 918-20. 15. Schmitt JM. Optical coherence tomography (OCT): a review. IEEE J Selected Topics in Quantum Electronics 1999; 5 : 1205-15. 16. Ntziachristos V, Chance B. Probing physiology and molecular function using optical imaging: applications to breast cancer. Breast Cancer Res 2001; 3 : 41-6. 17. Gibson AP, Hebden JC, Arridge SR. Recent advances in diffuse optical imaging. Phys Med Biol 2005; 50 : R1-43. 18. O’Rourke AP, Haemmerich D, Prakash P, et al. Current status of liver tumor ablation devices. Expert Rev Med Devices 2007; 4 : 523-37. 19. Haigron P, Dillenseger JL, Luo L, et al. Image-guided therapy: evolution and breakthrough. IEEE Eng Med Biol Mag 2010; 29 : 100-4. 20. Andrews DW, Bednarz G, Evans JJ, et al. A review of 3 current radiosurgery systems. Surg Neurol 2006; 66 : 559-64. 21. Seifert JK, Morris DL. World survey on the complications of hepatic and prostate cryotherapy. World J Surg 1999; 23 : 109-13. 22. Schindl A, Schindl M, Pernerstorfer-Schon H, et al. Low-intensity laser therapy: a review. J Investig Med 2000; 48 : 312-26. 23. Bouchoux G, Lafon C, Berriet R, et al. Dual-mode ultrasound transducer for image-guided interstitial thermal therapy. Ultrasound Med Biol 2008; 34 : 607-16. 24. Tanter M, Thomas JL, Fink M. Focusing and steering through absorbing and aberrating layers: application to ultrasonic propagation through the skull. J Acoust Soc America 1998; 103 : 2403-10. 25. Aubry JF, Tanter M, Pernot M, Fink M. Experimental demonstration of noninvasive transskull adaptive focusing based on prior computed tomography scans. J Acoust Soc America 2003; 113 : 84-93. 26. Troccaz J. Computer- and robot-assisted medical intervention. In : Nof S, ed. Handbook of automation. Berlin : Springer, 2009 : 1451-66. |