| |
| Med Sci (Paris). 2011 January; 27(1): 17–19. Published online 2011 February 10. doi: 10.1051/medsci/201127117.Détecter la pression ? Identification de deux protéines activées par les forces mécaniques Bertrand Coste1* 1Laboratory of Ardem Patapoutian, The Scripps Research Institute, 10550 North Torrey Pines Road, 92037, La Jolla, Californie, États-Unis MeSH keywords: Animaux, Lignée cellulaire tumorale, Ciliophora, physiologie, Séquence conservée, Ganglions sensitifs des nerfs spinaux, cytologie, Canaux ioniques, composition chimique, génétique, Transport des ions, Mécanorécepteurs, Mécanotransduction cellulaire, Souris, Neuroblastome, anatomopathologie, Stimulation physique, Cellules réceptrices sensorielles, Spécificité d'espèce, Contrainte mécanique, Relation structure-activité, Toucher, Vertébrés |
La transduction mécanique correspond à la conversion de forces mécaniques en signaux biologiques et participe de façon majeure à la physiologie et au comportement de tous les êtres vivants. Chez les plantes par exemple, la croissance des racines est largement dirigée par les forces mécaniques générées lors de la rencontre de matériaux résistants [
1]. Les eucaryotes unicellulaires tels que les Ciliés réagissent eux aussi au toucher par un changement de direction [
2]. Enfin chez les vertébrés, un grand nombre de fonctions sont influencées par des stimulations mécaniques, telles que le toucher ou encore l’audition, qui correspond à la détection des vibrations sonores par l’oreille interne [
8]. La douleur, la proprioception, le contrôle du tonus vasculaire ou du flux rénal, l’homéostasie musculaire et osseuse ainsi que l’embryogenèse sont autant d’exemples de processus contrôlés par des forces mécaniques [
3,
4]. |
La quête de canaux ioniques activés mécaniquement Depuis des décennies et à la suite des premiers enregistrements des courants activés mécaniquement dans l’oreille interne de vertébrés [
5], les scientifiques ont cherché à identifier les canaux ioniques activés directement en réponse à des stimulations mécaniques. De nombreuses études ont décrit la présence de tels courants dans divers types cellulaires. En particulier, les neurones sensoriels des ganglions dorsaux rachidiens (GDR), qui innervent notamment la peau, expriment différents types de courants activés mécaniquement [
6]. Ces courants, définis par leurs propriétés d’adaptation, sont responsables de l’activation des neurones impliqués dans le toucher, la proprioception ou la douleur. Un certain nombre de canaux ioniques activés mécaniquement ont été décrits à ce jour [3, 4], mais aucun n’a été impliqué de manière conclusive dans la détection des forces mécaniques chez les mammifères. La découverte de tels canaux ioniques représente un enjeu important en neurobiologie, et ce notamment dans le champ sensoriel, que ce soit pour les sens du toucher ou de l’audition. |
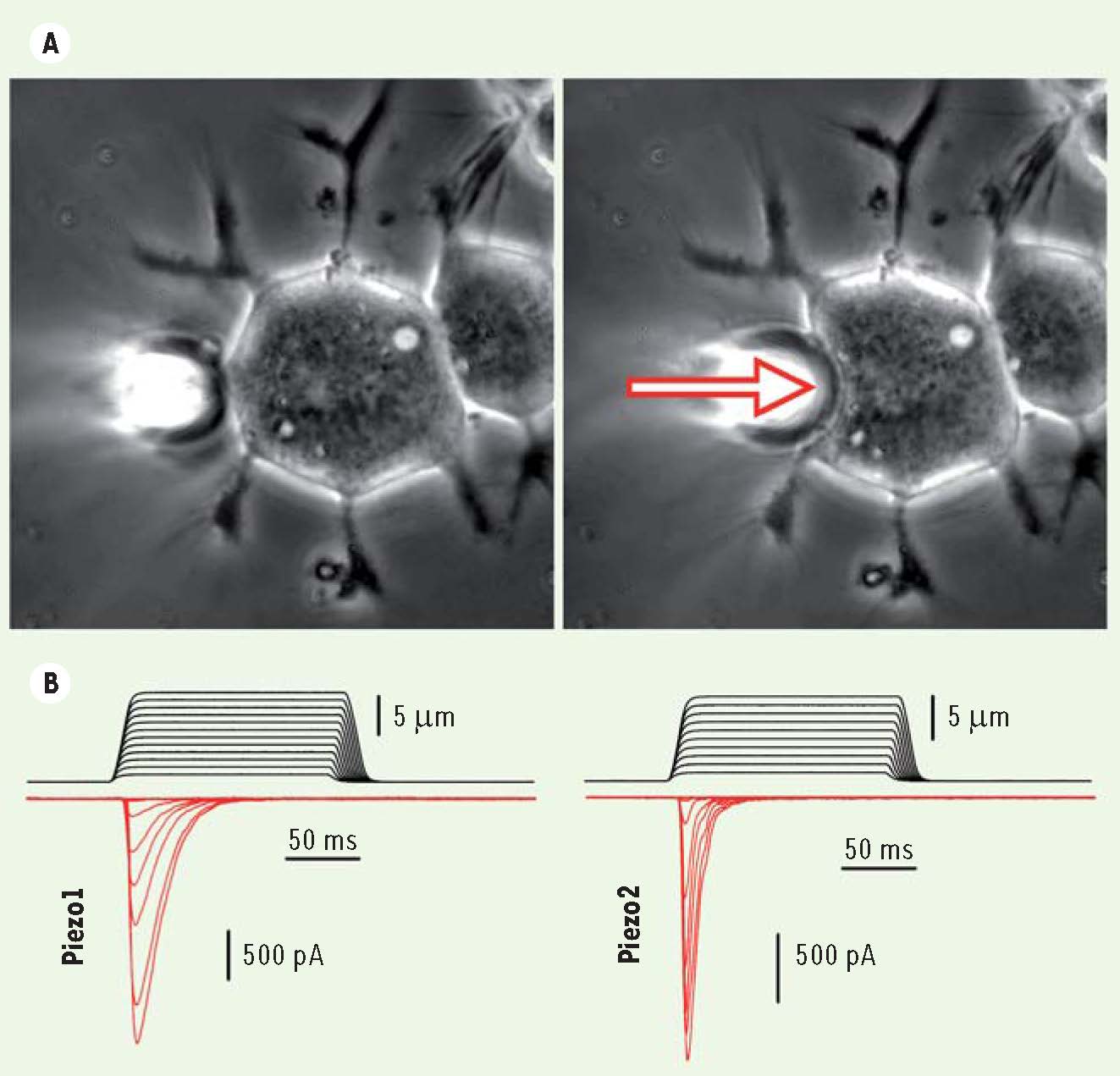
Piezo1 et Piezo2 contribuent à former des canaux activés mécaniquement Notre étude a eu pour but d’identifier les canaux ioniques qui sous-tendent l’activité induite par les stimulations mécaniques. Nous avons examiné les réponses mécaniques d’un certain nombre de lignées cellulaires immortalisées (dont l’intérêt est leur facilité d’utilisation, la disponibilité de nombres illimités de cellules, et le fait qu’elles représentent une population homogène). Notre protocole expérimental a consisté à enregistrer des courants à l’aide d’une pipette de patch-clamp en configuration « cellule entière », et d’appliquer une pression sur cette même cellule au moyen d’une autre pipette finement contrôlée, afin de provoquer l’ouverture des canaux activés mécaniquement (
Figure 1
). Cette caractérisation nous a conduits à nous focaliser sur les cellules Neuro2A (N2A), issues de neuroblastes de souris et qui expriment un courant activé mécaniquement de manière stable. La comparaison des gènes exprimés dans ces cellules et dans les autres lignées que nous avons testées grâce à l’utilisation de puces à ADN nous a permis de dresser une liste de gènes dont l’expression est enrichie dans les cellules N2A. Seuls les candidats pour lesquels les prédictions bio-informatiques indiquaient la présence d’au moins deux domaines transmembranaires (une propriété commune aux canaux ioniques) ont été considérés. Cette liste d’environ 450 candidats a été réduite à une centaine sur la base de ce qui était connu dans la littérature. Nous nous sommes focalisés sur les gènes codant pour des canaux ioniques et sur ceux dont la fonction est inconnue à ce jour. L’inhibition de l’expression de chacun de ces candidats, testée individuellement, via l’utilisation de petits ARN interférents (siARN) dans les cellules N2A, a conduit à l’identification de Piezo1 dont l’expression est nécessaire à la présence du courant activé mécaniquement. Des expériences dans lesquelles Piezo1 est surexprimé dans différentes lignées cellulaires ont montré qu’il était suffisant à l’induction d’un courant activé mécaniquement. La surexpression de Piezo2, un gène homologue de Piezo1 chez les mammifères, induit également un courant activé mécaniquement. Les deux protéines codées par ces gènes génèrent des courants aux propriétés légèrement différentes en termes d’adaptation à la stimulation mécanique (
Figure 1
).  | Figure 1
Courants activés par la stimulation mécanique des corps cellulaires de cellules exprimant Piezo1 ou Piezo2. A. Dispositif expérimental permettant de stimuler mécaniquement les cellules (la pipette d’enregistrement n’est pas présente pour plus de clarté). À gauche, la photo illustre une cellule N2A à côté de laquelle est positionnée la pipette de stimulation. À droite, la pipette de stimulation qui est déplacée vers la cellule (flèche rouge) produit une déformation mécanique de la membrane plasmique. B. Exemple de courants activés mécaniquement enregistrés à un potentiel de maintien de - 80 mV dans des cellules surexprimant Piezo1 (à gauche) et Piezo2 (à droite). Les traces en noir représentent les mouvements effectués par la pipette de stimulation, dont le déplacement est augmenté de 1 μm à chaque nouvelle stimulation. Les traces en rouge représentent le courant activé qui augmente parallèlement au mouvement de la pipette de stimulation. |
|
Piezo2 dans les neurones sensoriels somatiques Dans les neurones des GDR, alors que Piezo1 est absente, Piezo2 est, elle, exprimée dans une sous-population de neurones qui comprend à la fois des neurones exprimant des marqueurs de neurones nociceptifs, impliqués dans la douleur, ainsi que d’autres neurones non nociceptifs impliqués dans le toucher et la proprioception. Des expériences de siARN dans les neurones de GDR ont montré que Piezo2 sous-tend les courants activés mécaniquement dont la cinétique d’adaptation est la plus rapide, et qui représentent environ 30 % de la population totale de ces neurones. Ces résultats suggèrent que Piezo2 joue un rôle dans le toucher, la proprioception et/ou la douleur mécanique. |
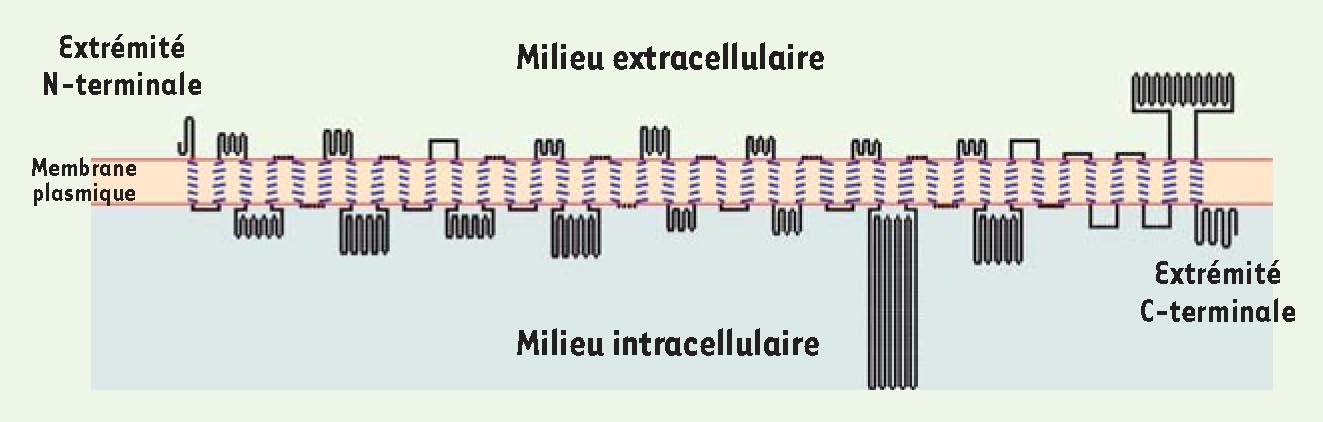
Piezo1 et 2 sont de grandes protéines transmembranaires conservées dans diverses espèces Beaucoup d’animaux, de plantes et d’autres espèces eucaryotes ne possèdent qu’un seul gène Piezo, et l’on trouve deux gènes chez les vertébrés, mais aucun homologue chez les levures et les bactéries. Cette conservation suggère que ces protéines jouent un rôle important, qui serait apparu chez les eucaryotes au cours de l’évolution. Les différentes protéines Piezo prédites chez ces espèces sont formées de 2 100 à 4 800 acides aminés, et sont formées d’un très grand nombre de domaines transmembranaires. Par exemple, Piezo1 et Piezo2 chez la souris possèdent 30 à 39 domaines transmembranaires selon différentes prédictions bioinformatiques, ces domaines étant distribués le long de la protéine (
Figure 2
). Chez la souris, Piezo1 et Piezo2 sont exprimées dans différents tissus mécanosensibles tels que les poumons, la vessie, le rein, le côlon ou la peau, suggérant un rôle possible de ces protéines dans la sensibilité mécanique de ces organes.  | Figure 2
Prédiction de la topologie membranaire de la protéine Piezo2. La protéine Piezo2 isolée à partir des GDR de souris est formée de 2 823 acides aminés. Le programme Phobius (http://www.ebi.ac.uk/Tools/phobius/) prédit 39 domaines transmembranaires (en bleu) dispersés le long de la séquence protéique. Notez que cette prédiction est basée sur les propriétés hydrophobes des acides aminés et varie selon le programme utilisé. |
|
Nos travaux ont permis de découvrir une famille de protéines qui sont impliquées directement dans l’étape initiale de la mécanotransduction [
7], et qui constituent des cibles importantes dans l’exploration des fonctions affectées par les stimulations mécaniques. De futures études permettront d’adresser plus précisément le rôle des protéines Piezo dans ces organes. De plus, l’expression de Piezo2 dans les neurones sensoriels des GDR fait de cette protéine potentiellement une cible de choix pour traiter certains types de douleurs mécaniques inflammatoires ou chroniques. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
L’auteur tient à remercier tout le personnel du laboratoire du Dr Ardem Patapoutian, ainsi que le Dr N. Grillet pour ses commentaires pertinents sur le manuscrit.
|
1.
Monshausen
GB
,
Gilroy
S
. Feeling green: mechanosensing in plants . Trends Cell Biol.
2009; ; 19 : :228.-235. 2.
Iwatsuki
K
,
Hirano
T
. Induction of the thigmotaxis in Paramecium caudatum . Comp Biochem Physiol A Physiol.
1995; ; 110 : :167.-170. 3.
Chalfie
M
. Neurosensory mechanotransduction . Nat Rev Mol Cell Biol.
2009; ; 10 : :44.-52. 4.
Hamill
OP
,
Martinac
B
. Molecular basis of mechanotransduction in living cells . Physiol Rev.
2001; ; 81 : :685.-740. 5.
Corey
DP
,
Hudspeth
AJ
. Response latency of vertebrate hair cells . Biophys J.
1979; ; 26 : :499.-506. 6.
Coste
B
,
Crest
M
,
Delmas
P
. Pharmacological dissection and distribution of nan/Nav1.9, T-type Ca2+ currents, and mechanically activated cation currents in different populations of DRG neurons . J Gen Physiol.
2007; ; 129 : :57.-77. 7.
Coste
B
,
Mathur
J
,
Schmidt
M
, et al. Piezo1 and Piezo2 are essential components of distinct mechanically activated cation channels . Science.
2010; ; 330 : :55.-60. 8.
El-Amraoui
A
,
Petit
C
. Thérapie cellulaire dans l’oreille interne : nouveaux développements et perspectives . Med Sci (Paris).
2010; ; 26 : :981.-985. |