| |
| Med Sci (Paris). 2011 January; 27(1): 28–31. Published online 2011 February 10. doi: 10.1051/medsci/201127128.SNARE, V-ATPase et neurotransmission Oussama El Far1* and Michael Seagar1 1Inserm UMR 641, Neurobiologie des canaux ioniques, Faculté de Médecine, Secteur Nord, Université de la Méditerranée, CS80011, boulevard Pierre Dramard, 13344 Marseille Cedex 15 France MeSH keywords: Adénosine triphosphate, physiologie, Animaux, Exocytose, Humains, Fusion membranaire, Modèles neurologiques, Agents neuromédiateurs, sécrétion, Cartographie d'interactions entre protéines, Structure tertiaire des protéines, Sous-unités de protéines, Protons, Protéines SNARE, Transmission synaptique, Vésicules synaptiques, enzymologie, Vacuolar Proton-Translocating ATPases, Synaptobrévine-2 |
La communication entre neurones repose principalement sur les synapses chimiques et par conséquent sur la libération de neurotransmetteurs. Au niveau des terminaisons nerveuses, des vésicules synaptiques remplies de neurotransmetteurs s’arriment à la membrane plasmique et subissent des étapes de maturation qui les rendent compétentes pour la fusion avec la membrane plasmique. La libération de neurotransmetteurs s’effectue par un processus d’exocytose dépendant du calcium. Quand l’influx calcique déclenche la machinerie de fusion membranaire, un pore de fusion connectant la lumière des vésicules synaptiques à la fente synaptique s’ouvre et permet la libération des neurotransmetteurs. |
Protéines SNARE et fusion membranaire L’exocytose nécessite l’assemblage de complexes moléculaires très conservés, comprenant des protéines SNARE (soluble NSF [N-ethylmaleimide-sensitive factor] attachment protein receptors) et des senseurs calciques, à l’interface entre vésicule synaptique et membrane plasmique [
1-
3]. Les protéines SNARE forment des complexes hétérotrimériques qui, comme une fermeture éclair, permettent de rapprocher les bicouches des membranes plasmique et vésiculaire (
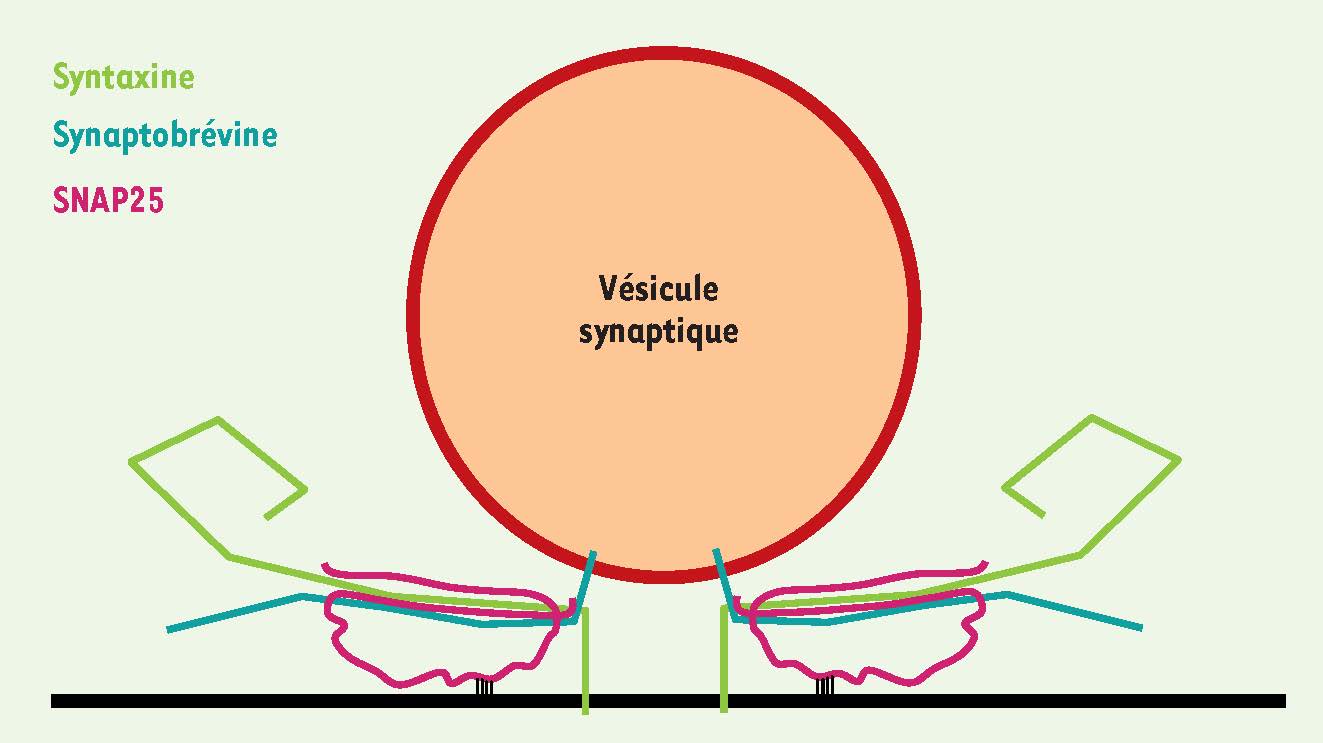
Figure 1
). Les SNARE synaptiques constituent la machinerie de fusion membranaire de base et incluent deux t-SNARE de la membrane plasmique : syntaxine 1 et SNAP-25, et une v-SNARE vésiculaire : VAMP2 (ou synaptobrévine) [
4,
5]. Une illustration évidente de l’importance fonctionnelle de ces protéines est donnée par le fait qu’elles sont les cibles des neurotoxines tétanique (TeNT) et botulique (BoNT), inhibiteurs très puissants de la libération de neurotransmetteurs. In vitro, le rapprochement de membranes artificielles portant les SNARE synaptiques conduit à une fusion membranaire [
6]. En présence d’ions calcium, cette fusion est accélérée par le senseur calcique vésiculaire synaptotagmine 1 nécessaire à la libération dépendant du calcium et synchrone de neurotransmetteurs [
7-
9].  | Figure 1
Représentation schématique de deux complexes SNARE assemblés à l’interface entre une vésicule synaptique et la membrane plasmique.
|
|
Implication du domaine V0 de la V-ATPase à protons dans la fusion SNARE dépendante L’ATPase à protons vacuolaire (V-ATPase) est un complexe multimoléculaire qui joue un rôle essentiel dans l’acidification des compartiments intracellulaires [
10]. Elle est aussi présente à la membrane plasmique de certaines cellules spécialisées [10]. Au niveau des vésicules synaptiques, le gradient de protons généré par la V-ATPase est essentiel pour la charge des vésicules synaptiques en neurotransmetteurs. La V-ATPase (
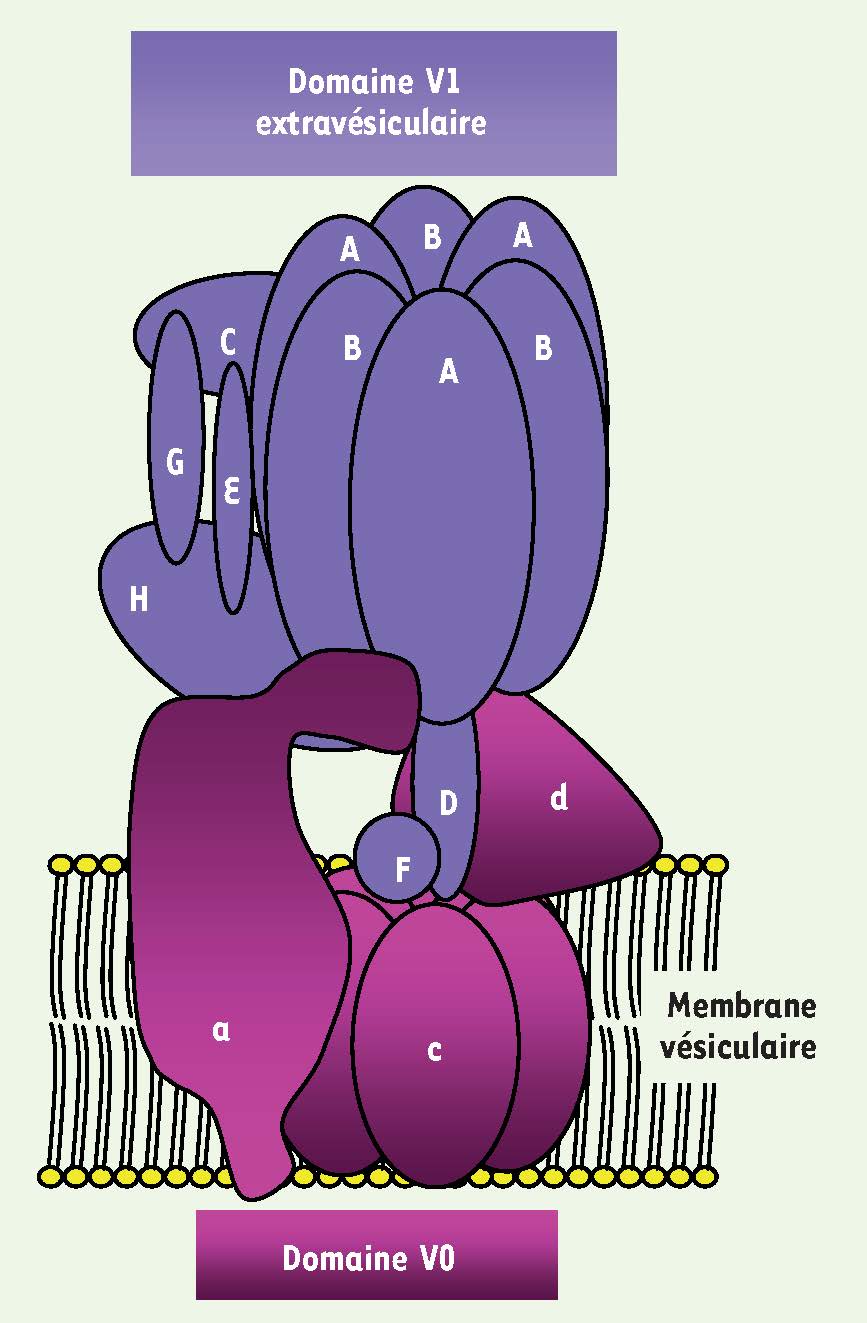
Figure 2
) est composée d’un domaine membranaire V0 (transporteur de protons) et d’un autre extramembranaire V1 portant l’activité ATPasique. Le domaine V0 est constitué d’un hexamère de sous-unités c et de deux autres sous-unités a et d.  | Figure 2
Représentation schématique de la V-ATPase : la pompe à protons vacuolaire.
|
Dans les années 1980, Israel et al. [
11] avaient purifié la protéine « médiatophore » à partir de synaptosomes de torpille. Reconstitué dans des liposomes chargés en acétylcholine, le médiatophore avait la capacité de libérer leur contenu, sous l’impulsion d’une élévation de la concentration calcique. Plus tard, le médiatophore s’est révélé être la sous-unité c du secteur V0 de la V-ATPase. Les auteurs ont interprété ces résultats dans le contexte de l’hypothèse d’une libération non-vésiculaire d’acétylcholine à partir d’un pool cytoplasmique. Avec le temps, l’hypothèse vésiculaire a pris le dessus et le médiatophore est tombé dans l’oubli. En 2001, des travaux sur la fusion vacuolaire chez la levure ont déclenché un regain d’intérêt pour le V0. En recherchant les partenaires moléculaires du senseur calcique de la fusion vacuolaire : la calmoduline (CaM), Peters et al. [
12] ont rapporté en 2001 l’importance capitale du secteur V0 de la V-ATPase dans la fusion membranaire à une étape tardive située après l’assemblage du complexe SNARE. Les auteurs ont ainsi suggéré que deux secteurs V0, assemblés en trans, à la manière d’une jonction gap, formeraient le pore initial lors de la fusion vacuolaire. Cette découverte a soulevé la question de l’ubiquité de l’intervention du secteur V0 de la V-ATPase dans la formation d’un pore de fusion et plus particulièrement dans la fusion des vésicules synaptiques avec la membrane présynaptique (
Figure 3
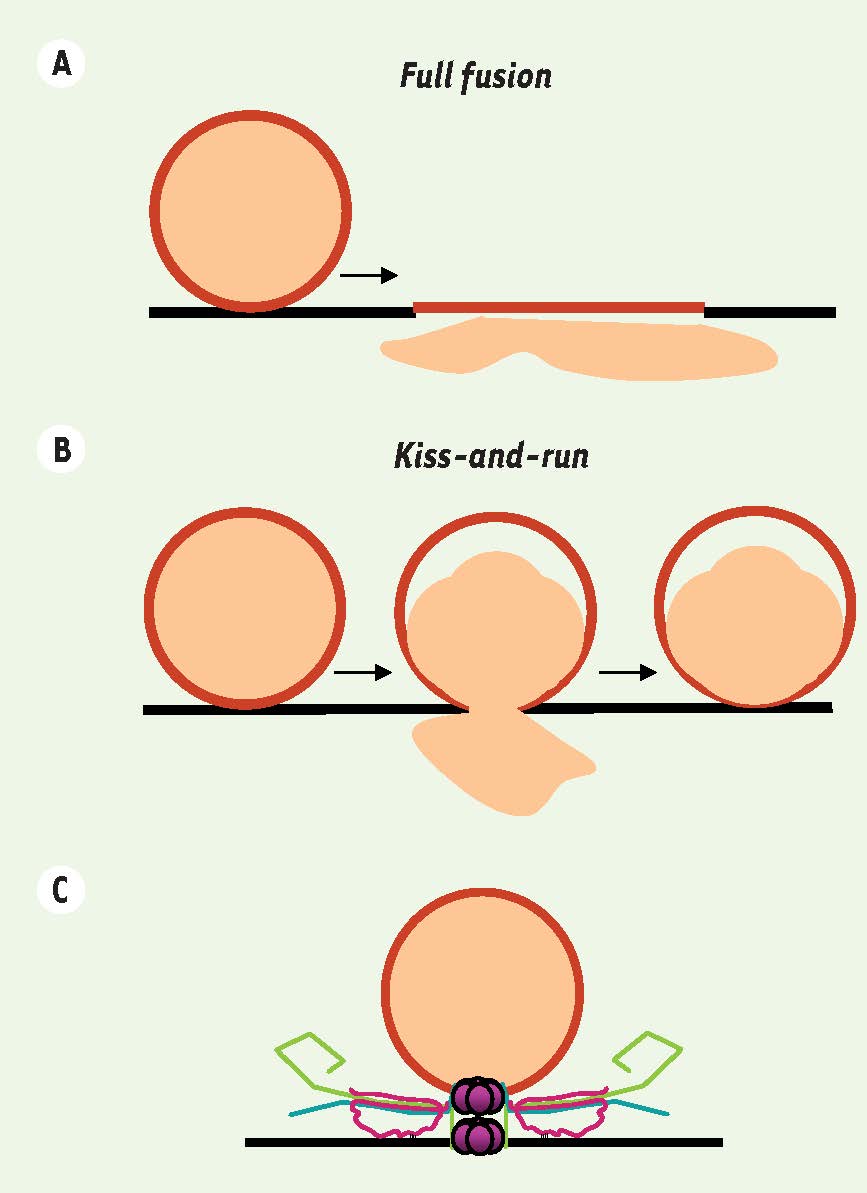
). 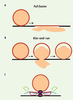 | Figure 3
Représentation schématique des deux principaux modes de fusion. A. Fusion complète ou full fusion, la vésicule synaptique fusionne totalement avec la membrane plasmique, libère son contenu et ses composants moléculaires se mélangent avec ceux de la membrane plasmique. B. Fusion partielle ou kiss-and-run, à l’interface de contact entre la vésicule synaptique et la membrane plasmique, un pore transitoire s’ouvre provoquant une libération partielle du contenu de la vésicule. Ce mode de libération préserve l’identité moléculaire de la vésicule et permet à une même vésicule d’exécuter plusieurs cycles de libération. C. Architecture moléculaire du pore de fusion : implication hypothétique du domaine V0 de la V-ATPase dans la formation du pore de fusion. |
Depuis, des travaux dans plusieurs organismes modèles (Drosophile, C. elegans, poisson zèbre et cellules pancréatiques) ont montré une implication du secteur V0 dans les mécanismes de sécrétion, indépendamment de son rôle de pompe à protons [
13-
16]. Biochimiquement, les sous-unités c, a et d du domaine V0 sont associées à un complexe synaptophysine/VAMP2 (vesicle-associated membrane protein 2) dans les membranes des vésicules synaptiques [
17]. De plus, la sous-unité d interagit avec la synaptophysine [
18], partenaire de la VAMP2, mais dont la fonction reste énigmatique. Toutes ces données suggèrent une implication du domaine V0 en association avec les protéines SNARE dans les mécanismes de fusion entre vésicules synaptiques et membrane plasmique de la zone active. |
La VAMP2 interagit avec la sous-unité c du domaine V0 Sur la base de ces données, nous avons voulu explorer les interactions potentielles entre la sous-unité c du domaine V0 de la V-ATPase et les protéines SNARE. La nature extrêmement hydrophobe de la sous-unité c a demandé une mise au point importante des conditions d’expression et de purification des protéines recombinantes à partir de E. coli. En utilisant le système double-hybride de levure ainsi que des expériences de pull down et de résonance plasmonique de surface, nous avons montré que la boucle cytoplasmique reliant les segments transmembranaires 3 et 4 (L3.4) de la sous-unité c interagit directement avec le domaine juxtamembranaire de la VAMP2. Ce même domaine de VAMP2 est connu pour son interaction avec la CaM. De plus, les mêmes déterminants moléculaires de la VAMP2 gouvernent son interaction avec la sous-unité c et la CaM [
19]. Effectivement, nous avons aussi montré que l’interaction VAMP2/sous-unité c est régulée par la Ca2+-CaM. |
Conséquences fonctionnelles de la perturbation de l’interaction VAMP2/sous-unité c Afin de comprendre les conséquences fonctionnelles de notre découverte, nous avons perturbé l’interaction VAMP2/sous-unité c dans les neurones en injectant un peptide interférent provenant de la séquence de la sous-unité c et correspondant à la séquence de sa boucle L3.4. In vitro ce peptide inhibe l’interaction des deux protéines, mais n’affecte pas la fonction pompe à protons de la V-ATPase. Le fait que le peptide L3.4 ne modifie pas l’activité de la pompe à protons de la V-ATPase est crucial pour pouvoir interpréter son effet sur la libération de neurotransmetteurs, évaluée en mesurant les réponses post-synaptiques. En effet, l’activité de la pompe à protons est nécessaire à la charge des vésicules synaptiques en neurotransmetteurs. En présence d’un inhibiteur de la pompe à protons, les vésicules synaptiques se trouveraient dépourvues de neurotransmetteurs. Dans ce cas, une inhibition de la neurotransmission sera due à la fusion de vésicules synaptiques vides et par conséquent, une perturbation du mécanisme de fusion membranaire per se ne sera pas détectable. L’introduction de ce peptide L3.4 dans des neurones périphériques cholinergiques (neurones des ganglions supérieurs cervicaux, SCG) ou centraux glutamatergiques (neurones pyramidaux de la couche 5 du cortex de rat) a eu pour conséquence une inhibition très significative de la neurotransmission. L’analyse des enregistrements électrophysiologiques dans les neurones pyramidaux a montré que le peptide L3.4 induit une diminution de la probabilité de libération. L’analyse des cinétiques de récupération après déplétion du stock vésiculaire suggère que le peptide n’affecte pas les étapes classiques d’endocytose. Par conséquent, nos travaux suggèrent une implication directe du domaine V0 de la V-ATPase dans la libération contrôlée par les SNARE. L’association V1-V0 est réversible, et il a été suggéré que le domaine V1 pourrait dissocier des vésicules synaptiques quand leur charge en neurotransmetteurs ou bien leur acidification atteint son niveau maximal [
20]. Cette dissociation modifie l’accessibilité du secteur V0 et pourrait le rendre accessible pour l’interaction avec VAMP2. Existe-t-il un lien régulateur entre le remplissage des vésicules synaptiques en neurotransmetteurs et leur disponibilité à l’arrimage ? De quelle manière, le domaine V0 pourrait-il influencer la neurotransmission ? Classiquement, l’influx calcique dans une terminaison synaptique aboutit à la fusion complète des vésicules synaptiques avec la membrane plasmique (full fusion) et la libération de tout leur contenu. Le pore de fusion peut toutefois s’ouvrir et se fermer sans se dilater. Ceci permet la libération des transmetteurs par kiss-and-run, un processus a minima [
21] qui évite l’incorporation des protéines vésiculaires dans la membrane plasmique. À l’heure actuelle, nous ne savons pas si une différence moléculaire dans l’organisation du pore de fusion est à l’origine de la distinction entre full fusion et kiss-and-run (
Figure 3
). Il est cependant tentant de spéculer que le V0 pourrait être impliqué dans l’exocytose par kiss-and-run. Nos travaux ouvrent la voie à de nouvelles investigations afin de déterminer si l’implication du V0 dans la neurotransmission contrôlée par les SNARE dévoile une différence architecturale du pore de fusion qui pourrait rendre compte de la différence entre full fusion et kiss-and-run [
22]. Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Jahn
R
. Recycling of synaptic vesicle membrane within nerve terminals . Brain Res Bull.
1999; ; 50 : :313.-314. 2.
Chen
YA
,
Scales
SJ
,
Duvvuri
V
, et al. Calcium regulation of exocytosis in PC12 cells . J Biol Chem.
2001; ; 276 : :26680.-26687. 3.
Jackson
MB
,
Chapman
ER
. Fusion pores and fusion machines in Ca2+-triggered exocytosis . Annu Rev Biophys Biomol Struct.
2006; ; 35 : :135.-160. 4.
Sollner
T
,
Bennett
MK
,
Whiteheart
SW
,
Scheller
RH
,
Rothman
JE
. A protein assembly-disassembly pathway in vitro that may correspond to sequential steps of synaptic vesicle docking, activation, and fusion . Cell.
1993; ; 75 : :409.-418. 5.
Sutton
RB
,
Fasshauer
D
,
Jahn
R
,
Brunger
AT
. Crystal structure of a SNARE complex involved in synaptic exocytosis at 2.4 Angstrom resolution . Nature.
1998; ; 395 : :347.-353. 6.
Weber
T
,
Zemelman
BV
,
McNew
JA
, et al. SNAREpins: minimal machinery for membrane fusion . Cell.
1998; ; 92 : :759.-772. 7.
Xu
J
,
Mashimo
T
,
Sudhof
TC
. Synaptotagmin-1, -2, and -9: Ca2+ sensors for fast release that specify distinct presynaptic properties in subsets of neurons . Neuron.
2007; ; 54 : :567.-581. 8.
Yoshihara
M
,
Littleton
JT
. Synaptotagmin I functions as a calcium sensor to synchronize neurotransmitter release . Neuron.
2002; ; 36 : :897.-908. 9.
Nishiki
T
,
Augustine
GJ
. Dual roles of the C2B domain of synaptotagmin I in synchronizing Ca2+-dependent neurotransmitter release . J Neurosci.
2004; ; 4 : :8542.-8550. 10.
Stevens
TH
,
Forgac
M
. Structure, function and regulation of the vacuolar H+-ATPase . Annual Rev Cell Dev Biol.
1997; ; 13 : :779.-808. 11.
Israel
M
,
Morel
N
,
Lesbats
B
,
Birman
S
,
Manaranche
R
. Purification of a presynaptic membrane protein that mediates a calcium-dependent translocation of acetylcholine . Proc Natl Acad Sci USA.
1986; ; 83 : :9226.-9230. 12.
Peters
C
,
Bayer
MJ
,
Buhler
S
,
Andersen
JS
,
Mann
M
,
Mayer
A
. Trans-complex formation by proteolipid channels in the terminal phase of membrane fusion . Nature.
2001; ; 409 : :581.-588. 13.
Hiesinger
PR
,
Fayyazuddin
A
,
Mehta
SQ
, et al. The v-ATPase V(0) subunit a1 is required for a late step in synaptic vesicle exocytosis in Drosophila . Cell.
2005; ; 121 : :607.-620. 14.
Liegeois
S
,
Benedetto
A
,
Garnier
JM
, et al. The V0-ATPase mediates apical secretion of exosomes containing Hedgehog-related proteins in Caenorhabditis elegans
. J Cell Biol.
2006; ; 173 : :949.-961. 15.
Sun-Wada
GH
,
Toyomura
T
,
Murata
Y
, et al. The a3 isoform of V-ATPase regulates insulin secretion from pancreatic beta-cells . J Cell Science.
2006; ; 119 : :4531.-4540. 16.
Peri
F
,
Nusslein-Volhard
C
. Live imaging of neuronal degradation by microglia reveals a role for v0-ATPase a1 in phagosomal fusion in vivo
. Cell.
2008; ; 133 : :916.-927. 17.
Galli
T
,
McPherson
PS
,
De Camilli
P
. The V0 sector of the V-ATPase, synaptobrevin, and synaptophysin are associated on synaptic vesicles in a Triton X-100-resistant, freeze-thawing sensitive, complex . J Biol Chem.
1996; ; 271 : :2193.-2198. 18.
Siebert
A
,
Lottspeich
F
,
Nelson
N
,
Betz
H
. Purification of the synaptic vesicle-binding protein physophilin. Identification as 39-kDa subunit of the vacuolar H+-ATPase . J Biol Chem.
1994; ; 269 : :28329.-28334. 19.
Quetglas
S
,
Leveque
C
,
Miquelis
R
,
Sato
K
,
Seagar
M
. Ca2+-dependent regulation of synaptic SNARE complex assembly via a calmodulin- and phospholipid-binding domain of synaptobrevin . Proc Natl Acad Sci USA.
2000; ; 97 : :9695.-9700. 20.
Morel
N
,
Dedieu
J-C
,
Philippe
J-M
. Specific sorting of the a1 isoform of the V-H+ATPase a subunit to nerve terminals where it associates with both synaptic vesicles and the presynaptic plasma membrane . J Cell Science.
2003; ; 116 : :4751.-4762. 21.
Harata
NC
,
Aravanis
AM
,
Tsien
RW
. Kiss-and-run and full-collapse fusion as modes of exo-endocytosis in neurosecretion . J Neurochem.
2006; ; 97 : :1546.-1570. 22.
Di Giovanni
J
,
Boudkkazi
S
,
Mochida
S
, et al. V-ATPase membrane sector associates with synaptobrevin to modulate neurotransmitter release . Neuron.
2010; ; 67 : :268.-279. 23.
Tareste
D
. Énergie libérée par la machinerie de fusion SNAREpin . Med Sci (Paris).
2008; ; 24 : :142.-143. |