| |
| Med Sci (Paris). 2011 January; 27(1): 82–87. Published online 2011 February 10. doi: 10.1051/medsci/201127182.Imagerie et cognition (1) - Imagerie fonctionnelle cérébrale appliquée à l’analyse des phénomènes douloureux Roland Peyron1* and Isabelle Faillenot2 1Département de neurologie et Centre de la douleur, CHU, F-42055 Saint-Étienne ; Inserm U879, UCBL Lyon 1, UJM Saint-Étienne, F-42023 Saint-Étienne, France 2Centre mémoire de ressources et de recherche, Inserm U879, CHU, 42055 Saint-Étienne, France |
Au début des années 1990, la connaissance des circuits de la douleur était fondée essentiellement sur les données issues de l’expérimentation animale. De rares cas de lésions étudiées en post mortem, ou par scanner ou IRM (imagerie par résonance magnétique) chez l’homme victime d’anomalies de la perception douloureuse, avaient permis de progresser dans la connaissance des mécanismes cérébraux conduisant à la douleur. C’est seulement à partir de 1991 que des techniques d’imagerie fonctionnelle ont permis l’accès au fonctionnement du cerveau in vivo chez des sujets volontaires auxquels on administre un stimulus douloureux [
1,
2]. De nombreuses équipes ont ensuite multiplié les études de physiologie douloureuse chez le volontaire sain pour essayer de mieux appréhender les différents mécanismes qui composent cette sensation composite caractéristique de la douleur physiologique, encore appelée nociception. Cette étape s’est vite avérée incontournable pour analyser les anomalies de réponses observées chez les patients. Les techniques d’imagerie ont en effet ensuite été appliquées à l’étude des douleurs dites neuropathiques qui caractérisent ces douleurs rebelles faisant suite à une lésion du système nerveux. Enfin, les équipes de cliniciens et/ou de soignants ont poursuivi en parallèle l’étude de certains mécanismes antalgiques lorsque sont utilisées des techniques susceptibles de contrôler la douleur. Nous décrirons donc successivement dans cette revue les avancées dans les domaines de la physiologie (nociception) et de la pathologie (douleur neuropathique et autres douleurs chroniques), et celles qui concernent les conditions de neurostimulations cérébrales qui soulagent ou contrôlent la douleur neuropathique. Les techniques d’imagerie fonctionnelle utilisées regroupent la tomographie par émission de positons (TEP), la résonance magnétique fonctionnelle (IRMf) et les potentiels évoqués (PE) [
53]. La TEP localise les molécules marquées par un émetteur de positons. Elle permet ainsi de mesurer, selon la molécule marquée, des variations de débit sanguin cérébral (DSC) ou du couplage des récepteurs avec leur ligand, éventuellement dans différentes conditions. L’IRMf mesure des variations du signal BOLD (blood oxygen level dependent), c’est-à-dire la réponse hémodynamique des populations neuronales à des stimulations. |
La physiologie de la douleur ou nociception Au début de l’exploration de la douleur par imagerie fonctionnelle, quelques aires cérébrales ont été désignées comme intégrant la sensation de douleur, notamment dans les régions préfrontale, pariétale et motrices. Ces aires n’ont en fait pas de spécificité vis-à-vis de l’intégration de la douleur. Il a été montré par la suite en TEP que les aires préfrontales et pariétales étaient impliquées dans des processus attentionnels [
3,
4] qui sont contemporains de toute stimulation douloureuse (on tourne naturellement son attention vers la zone douloureuse). Ces données ont, depuis lors, été répliquées par d’autres équipes de recherche, utilisant les techniques TEP et IRMf [
5,
6] (
Figure 1C
). Il faut toutefois noter que même si ces aires ne sont pas spécifiques, le contexte attentionnel peut influencer directement les aires de la nociception, et que la perturbation des aires attentionnelles détermine le degré d’attention accordé à la stimulation nociceptive [
7]. De même, les aires motrices sont souvent activées par des stimulations douloureuses physiologiques (nociception) [
8], or il est pour le moins naturel que le cerveau organise une riposte motrice pour échapper à l’agression. Ces aires concernent le cortex moteur primaire dont on sait maintenant (à partir d’enregistrements intracérébraux directs) qu’il est le siège d’une réponse très précoce à la stimulation douloureuse [
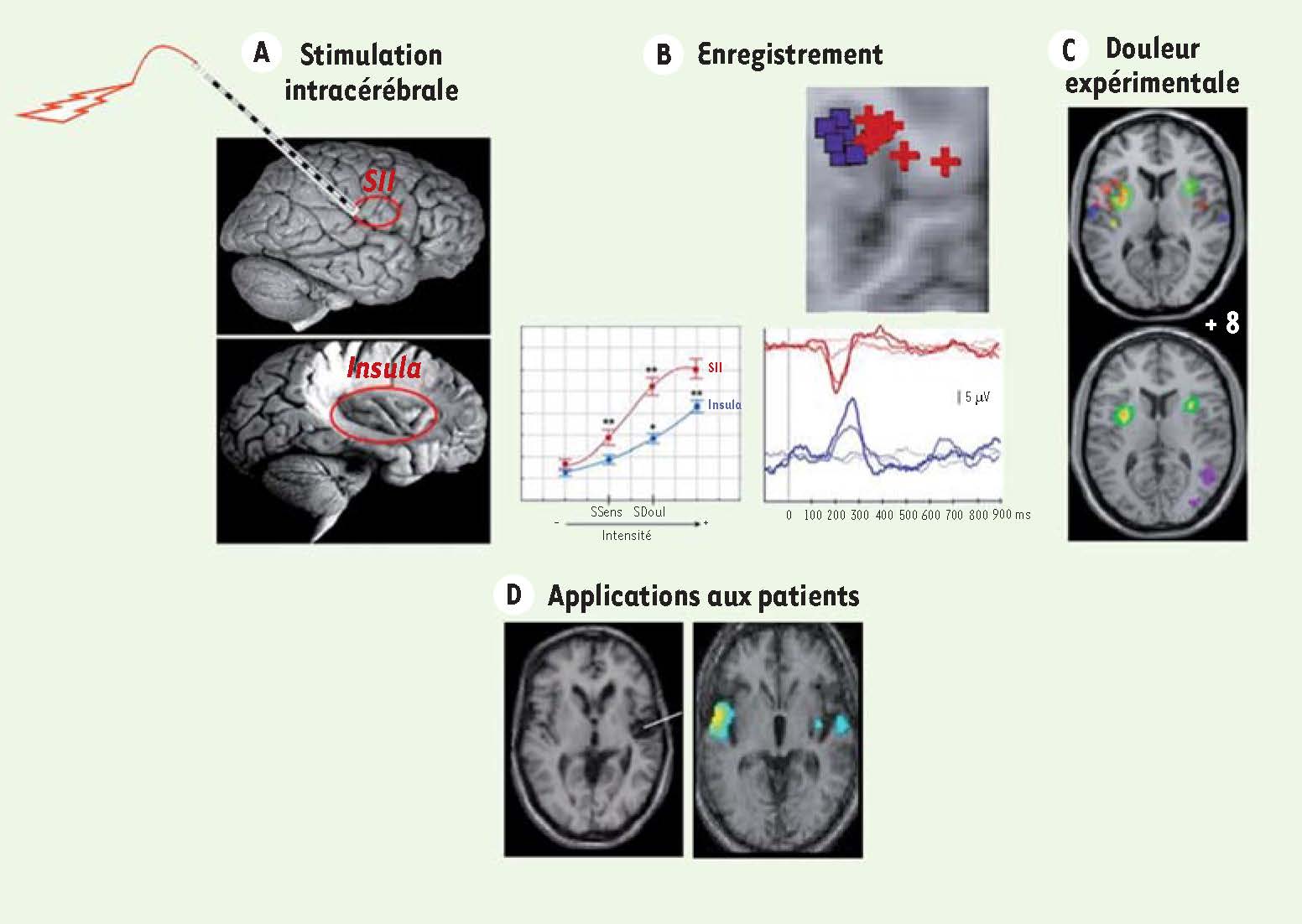
9], ainsi que l’aire 6, le cortex cingulaire antérieur, le cervelet.  | Figure 1
Structure et anatomie fonctionnelle de la région insulaire et de SII chez l’homme. La profondeur de ces structures (au centre) explique probablement la rareté de leur exploration et l’ignorance prolongée de leur participation dans les phénomènes d’intégration de la douleur. A. Stimulations intracérébrales : si les électrodes implantées (afin de déterminer le foyer épileptogène d’un patient à opérer) sont utilisées pour des stimulations électriques, pour une intensité de stimulation donnée seules les stimulations de l’aire SII et de l’ insula sont en mesure de provoquer une sensation douloureuse aiguë alors que la stimulation des autres aires cérébrales n’aboutit pas à ce résultat [
23]. B. Les enregistrements intracérébraux chez l’homme après stimulation laser douloureuse démontrent l’existence d’une réponse nociceptive [
27], chronologiquement dans l’aire SII (rouge) puis dans l’ insula (bleu). C. Les techniques PET et IRMf qui ont abordé sans a priori la question de la participation des structures cérébrales dans leur ensemble au processus d’intégration de la douleur ont montré que, dans certaines conditions expérimentales excluant l’effet attentionnel, les activations cérébrales à une stimulation douloureuse calorique pouvaient être restreintes aux cortex insulaires et SII bilatéralement (coupe inférieure) [ 4]. De manière rassurante, l’utilisation de l’IRMf aboutit à des résultats similaires (points bleu/violet, coupe supérieure), ces mêmes résultats étant aussi obtenus par l’enregistrement intracérébral en réponse à une stimulation laser nociceptive chez l’homme (points rouges) [
52]. D. Si l’on considère les modèles lésionnels, les lésions de l’aire SII et de l’ insula peuvent s’associer à des douleurs neuropathiques chroniques. Sur la coupe de gauche, il s’agit d’une patiente avec ischémie focale qui développe des douleurs centrales. Une étude de groupe en IRMf sur 27 de ces patients retrouve des activités bilatéralisées d’allure pathologiques en réponse à une stimulation normalement indolore mais déclenchant chez ces patients une douleur allodynique. Comparativement à la même stimulation sur une zone saine, la réponse est bilatéralisée dans la région insulaire [
29], activité qui renvoie aux réponses nociceptives physiologiques présentées en C. |
Dissection des réponses cérébrales associées aux différentes composantes de la douleur : des résultats inattendus D’autres travaux, poursuivant cette activité de localisation fonctionnelle des différentes composantes qui formeront au final la sensation composite qui caractérise la douleur, ont permis d’identifier des réponses cérébrales qui y sont associées et traduisent des processus menés en parallèle dans le cerveau. C’est le cas par exemple des réponses associées à l’anticipation d’une stimulation douloureuse [
10,
11], ou au contexte émotionnel [
12], aux phénomènes de mémorisation [
13], d’illusion [
14], de conditionnement [ 10], ou de suggestion [
15] de la douleur, qui, toutes, ont été étudiées spécifiquement. Depuis le début des années 2000, des travaux de synthèse ont été publiés. Ils attribuent une fonction potentielle à chacune des activités répertoriées au sein de ce qu’il est désormais commun d’appeler la pain matrix ou « matrice douleur » [
16,
17]. Plus récemment, toute une série d’expérimentations ont montré que cette matrice douleur pouvait être recrutée alors même qu’il n’y a pas d’ input sensoriels. Ces études ont révélé des réponses empathiques à la douleur d’autrui, et démontrent que, dans ce cas, la matrice douleur est activée de manière semblable à ce qu’elle serait en cas de douleur réelle [
18-
20], à l’exception d’aires sensorielles comme l’ insula, SI, SII ou de la partie caudale du cortex cingulaire antérieur [
21]. Cette dernière information suggère que certaines aires cérébrales, dites sensorielles, quatre au maximum, pourraient à l’inverse établir la différence entre une douleur réelle et une douleur perçue chez l’autre et transmise par des phénomènes empathiques. Ces résultats sont cohérents avec les méta-analyses récentes qui démontrent que les régions les plus constamment activées dans les différentes études sur la douleur étaient les insulae et les aires somato-sensorielles secondaires (SII), et ce de manière bilatérale [16, 17]. Ces résultats ont d’emblée contrasté avec les hypothèses a priori qui privilégiaient, sur la base d’hypothèses chez l’homme ou de données chez l’animal, l’implication cortex SI, du cortex cingulaire antérieur, du thalamus et de la SGPA (substance grise péri-aqueducale). Plusieurs explications à cela sont possibles : la méconnaissance du rôle fonctionnel de l’insula chez l’homme, une focalisation des à priori sur les aires somato-sensorielles, mieux connues, ou les difficultés d’extrapolation de l’anatomie animale à l’homme. En d’autres termes, les travaux d’imagerie des années 1990 ont fait émerger les aires SII et insulaires comme des aires principales d’intégration de la douleur. Cela n’était pas attendu et allait à l’encontre des hypothèses émises au départ. Confirmation de la responsabilité des aires insulaires et SII dans l’intégration de la douleur Comme toutes les situations dans lesquelles des techniques sans a priori apportent des résultats qui ne vont pas dans le sens attendu, une étape de confirmation de ces données, au besoin par d’autres techniques, a alors débuté. Certaines équipes ont la possibilité, par le biais d’électrodes implantées à des fins thérapeutiques dans le cerveau de patients épileptiques, d’enregistrer la réponse cérébrale à une stimulation douloureuse ou de stimuler électriquement le cerveau et de répertorier les sites de stimulation qui s’accompagnent de sensations douloureuses. Les électrodes sont implantées pour guider la résection chirurgicale du foyer épileptique des patients. Les stimulations intracérébrales sont effectuées pour localiser la zone épileptogène et les propagations de la décharge épileptique dont la méconnaissance s’accompagne de mauvais résultats thérapeutiques. Les électrodes sont utilisées aussi pour enregistrer les décharges épileptiques et définir leur localisation, celle-ci pouvant être utile à la compréhension des phénomènes douloureux si la crise épileptique génère une douleur. Enfin, pour utiliser les électrodes à des fins d’enregistrement de réponses suscitées par une stimulation douloureuse (laser), le patient donne un consentement éclairé car cette dernière étape ne sert pas directement la qualité de la chirurgie de l’épilepsie qui sera effectuée. En accord avec les données de l’imagerie fonctionnelle, les résultats de ces études ont démontré (
Figure 1A, B
) :
-
que les patients épileptiques chez lesquels la décharge épileptique est identifiée par l’électrode insulaire (épilepsie insulaire) peuvent avoir, pendant la crise, une sensation douloureuse, et qu’a contrario, il y a très peu d’autres régions cérébrales où les décharges produisent de la douleur [
22] ;
-
que sur plus de 4 000 stimulations disséminées dans le cerveau, seules les stimulations sur les électrodes insulaires et dans SII ont entraîné une perception de douleur par le patient. Jusqu’à 13 % des stimulations électriques insulaires et de l’aire SII induisent une sensation douloureuse [23] ;
-
que parmi les électrodes qui enregistrent en continu l’activité électrique cérébrale après une stimulation laser douloureuse, seules les électrodes placées dans l’insula, dans SII et plus rarement dans le gyrus cingulaire antérieur [
24], le cortex somato-sensoriel primaire ou le cortex moteur primaire [9] enregistrent des réponses. Ainsi, cette approche confirme l’intérêt essentiel de ces régions dans la réponse à la douleur [
25,
26]. Par ailleurs, et cela n’est vrai que pour l’insula, la réponse électrique est d’amplitude proportionnelle à l’intensité de la douleur perçue [27].
|
Les mécanismes possibles des douleurs neuropathiques Les études débouchant sur des conclusions formelles sur l’origine des douleurs neuropathiques sont encore rares. Cela s’explique par les difficultés liées au transfert de techniques chez les patients et par l’existence incontournable d’une lésion sur les voies de la sensibilité et parfois même au niveau cérébral. La démarche la plus simple est l’étude des patients ayant une lésion cérébrale ou médullaire et une douleur de type allodynique1. En effet, celle-ci, contrairement aux douleurs spontanées ou paroxystiques, peut être déclenchée à la demande, et au cours de l’examen d’imagerie, lors de protocoles contrôlés. La démarche expérimentale compare généralement une stimulation tactile indolore, associée ou non à des stimulations thermiques et appliquée sur le côté non douloureux, et la même stimulation, douloureuse (allodynique), sur le côté souffrant. Les régions insulaires et SII, thalamiques latérales, parfois SI ou le cortex préfrontal [
28-
30] sont les régions dans lesquelles sont détectés des excès de réponse, en général bilatéraux, à l’exception du thalamus où l’excès d’activation est détecté du côté opposé à la stimulation [
31] (
Figure 1D
). Il n’a pas été enregistré à ce jour d’anomalies dans des zones où des réponses excessives étaient éventuellement pressenties, comme dans le cortex cingulaire antérieur. Bien entendu, les données concernant ces régions candidates à des réorganisations post-lésionnelles chez des patients ayant des douleurs neuropathiques sont à interpréter en fonction des données obtenues dans le domaine physiologique. Là encore, la prépondérance notable des anomalies dans ces cortex insulaires, SII, parfois SI, et dans le thalamus, laisse penser que ces anomalies sont en rapport avec l’évolution douloureuse de ces patients et traduisent des réorganisations post-lésionnelles aberrantes dans des régions prédestinées à générer de la douleur. Des arguments issus de la littérature « lésionnelle » vont dans ce sens, puisque dans de rares observations, des patients souffrant de douleurs neuropathiques les ont vu disparaître après une deuxième lésion vasculaire survenant dans des aires que l’on considère maintenant comme étant le siège de ces réorganisations néfastes et génératrices de douleurs neuropathiques [
32,
33]. Récemment, des techniques qui étudient la connectivité, ou du moins les corrélations et les interactions entre plusieurs régions d’un réseau fonctionnel, se sont développées. L’application de ces techniques à l’analyse de l’état de base dans la douleur neuropathique démontre qu’il existe une interruption du feed-back thalamo-cortical [
34] chez des patients ayant une douleur neuropathique diabétique. Des études ont cherché à mettre en évidence les spécificités pharmacologiques qui pouvaient sous-tendre ces anomalies. La TEP est particulièrement adaptée à ces études ; elle compare des états qui diffèrent en termes d’intensité douloureuse. Ainsi, il a été montré que les patients ressentant des douleurs neuropathiques avaient des anomalies du système endorphinique et que celles-ci étaient essentiellement localisées dans les aires d’intégration de la douleur, insula, thalamus et SGPA [
35,
36]. Ces résultats suggèrent qu’en dépit d’une efficacité relative des opiacés dans le traitement de la douleur neuropathique, ces patients recrutent les systèmes endogènes de défense face à la douleur, et que ces endorphines viennent occuper massivement les sites récepteurs opiacés devenus inaccessibles au ligand marqué utilisé lors de l’imagerie. |
Les autres douleurs chroniques D’autres équipes ont inventorié les réponses des patients atteints de douleurs rhumatismales, de fibromyalgie, d’algodystrophie, de syndrome de l’intestin irritable et d’autres situations de douleurs chroniques. Il est très difficile de tirer des conclusions de ces études. La première raison est que les effectifs sont souvent notoirement insuffisants pour pouvoir conclure. La deuxième raison est l’hétérogénéité importante des patients ce qui est préjudiciable pour faire des études de groupe et donc pour généraliser les résultats. Enfin, il est quasiment impossible d’effectuer une synthèse de ces études tant les résultats sont divergents [
37]. Pourtant, il existe des théories séduisantes selon lesquelles un défaut d’inhibition de la douleur ou un excès de facilitation pourrait contribuer à la fibromyalgie, au côlon irritable ou aux douleurs pelviennes chroniques [
38]. Chez le volontaire sain, des situations d’hyperalgésie ont été rapportées en association avec une activité du tronc cérébral supposée refléter la sensibilisation [
39], mais aussi avec des activités excessives préfrontales [37]. Ces théories n’ont à ce jour pas pu être vérifiées expérimentalement par imagerie fonctionnelle [38]. Il n’est donc possible de livrer ici que quelques pistes, par exemple, une hyperactivité dans le tronc cérébral de patients soumis à une stimulation nociceptive dans la zone cérébrale correspondant à leurs douleurs ostéoathritiques [
40]. |
Imagerie cérébrale appliquée à l’étude des mécanismes analgésiques Vu du côté du soignant, il n’est pas possible de se contenter de développer des recherches sur la douleur sans s’intéresser aux mécanismes pouvant apporter un soulagement. De nombreuses études utilisant l’imagerie cérébrale ont testé les effets antalgiques, et en parallèle les effets sur l’activité cérébrale, d’un certain nombre de situations antalgiques. Ainsi, des situations physiologiques comme la diversion [6,
41], l’hypnose [
42], mais aussi des effets pharmacologiques, comme l’effet des opiacés [
43,
44] ou l’effet placebo [42,
45] créent, de manière surprenante, des activités qui convergent dans une zone cérébrale du cortex frontal médian, le cingulaire rostral, et dans le cortex orbito-frontal. Il est admis que ces structures puissent être à l’origine de contrôles inhibiteurs descendants sur la SGPA et que cette région puisse être impliquée dans des mécanismes antalgiques physiologiques, au sens large [
46]. Ainsi, les patients ayant une douleur neuropathique peuvent, en dernier recours, bénéficier d’une approche de neurostimulation du cortex moteur. Cette technique empirique soulage la douleur des patients dans 60 % des cas sans que l’on en comprenne les mécanismes. Nous avons tenté de les étudier au cours de trois études successives. Ces investigations ont révélé que les activités qu’induit ce neurostimulateur ne concernaient pas les aires à proximité de l’électrode mais plutôt les aires à distance dans le thalamus, le cortex cingulaire rostral ou la SGPA [
47-
49], et que les activités dans ces deux dernières aires étaient corrélées à l’effet antalgique [49]. Ces données nous ont rappelé que la neurostimulation de la SGPA avait été développée, de manière empirique elle aussi, avec certains succès thérapeutiques, dans les années 1950, et que le cortex cingulaire rostral pouvait être considéré comme une cible potentielle pour la neurostimulation de ces patients. La richesse en opioïdes des structures activées par la neurostimulation du cortex moteur nous a aussi conduit à nous interroger sur la possibilité d’une médiation endorphinique de l’effet antalgique de la neurostimulation, d’autant que les effets cliniques sont lents à obtenir, avec une inertie importante [
50]. De la même manière que pour la physiopathologie de la douleur, nous avons donc vérifié si le soulagement de ces patients pouvait passer par une médiation endorphinique. Cela est bien le cas, au moins en partie puisque lorsque l’on compare les patients avant et après traitement, il existe un défaut de fixation du ligand sur les sites récepteurs opioïdes au niveau de la SGPA et du cortex cingulaire antérieur et que ces anomalies sont corrélées au bénéfice antalgique [
51]. Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1.
Jones
AK
,
Brown
WD
,
Friston
KJ
, et al. Cortical and subcortical localization of response to pain in man using positron emission tomography . Proc Biol Sci.
1991; ; 244 : :39.-44. 2.
Talbot
JD
,
Marrett
S
,
Evans
AC
, et al. Multiple representations of pain in human cerebral cortex . Science.
1991; ; 251 : :1355.-1358. 3.
Garcia-Larrea
L
,
Peyron
R
,
Laurent
B
,
Mauguiere
F
. Association and dissociation between laser-evoked potentials and pain perception . Neuroreport.
1997; ; 8 : :3785.-3789. 4.
Peyron
R
,
Garcia-Larrea
L
,
Gregoire
MC
, et al. Haemodynamic brain responses to acute pain in humans: sensory and attentional networks . Brain.
1999; ; 122 : :1765.-1780. 5.
Frankenstein
UN
,
Richter
W
,
McIntyre
MC
,
Remy
F
. Distraction modulates anterior cingulate gyrus activations during the cold pressor test . Neuroimage.
2001; ; 14 : :827.-836. 6.
Valet
M
,
Sprenger
T
,
Boecker
H
, et al. Distraction modulates connectivity of the cingulo-frontal cortex and the midbrain during pain: an fMRI analysis . Pain.
2004; ; 109 : :399.-408. 7.
Legrain
V
,
Perchet
C
,
Garcia-Larrea
L
. Involuntary orienting of attention to nociceptive events: neural and behavioral signatures . J Neurophysiol.
2009; ; 102 : :2423.-2434. 8.
Peyron
R
,
Kupers
R
,
Jehl
JL
, et al. Central representation of the RIII flexion reflex associated with overt motor reaction: an fMRI study . Neurophysiol Clin.
2007; ; 37 : :249.-259. 9.
Frot
M
,
Magnin
M
,
Mauguière
F
,
Garcia-Larrea
L
. On SI responses to painful laser and non-painful electrical stimuli: an intracortical recording study . Glasgow : 12th World Congress on Pain, 2008 : PF134 (poster).. 10.
Ploghaus
A
,
Narain
C
,
Beckmann
CF
, et al. Exacerbation of pain by anxiety is associated with activity in a hippocampal network . J Neurosci.
2001; ; 21 : :9896.-9903. 11.
Peyron
R
,
Créac’h
C
,
Vinson
J
, et al. Réponses cérébrales à la stimulation laser en IRMf et réponses anticipatoires à cette même stimulation . Rev Neurol.
2007; ; 163 ( suppl 1) : :8.-11. 12.
Godinho
F
,
Magnin
M
,
Frot
M
, et al. Emotional modulation of pain: is it the sensation or what we recall? . J Neurosci.
2006; ; 26 : :11454.-11461. 13.
Bingel
U
,
Schoell
E
,
Herken
W
, et al. Habituation to painful stimulation involves the antinociceptive system . Pain.
2007; ; 131 : :21.-30. 14.
Craig
AD
,
Reiman
EM
,
Evans
A
,
Bushnell
MC
. Functional imaging of an illusion of pain . Nature.
1996; ; 384 : :258.-260. 15.
Rainville
P
,
Duncan
GH
,
Price
DD
, et al. Pain affect encoded in human anterior cingulate but not somatosensory cortex . Science.
1997; ; 277 : :968.-971. 16.
Peyron
R
,
Laurent
B
,
Garcia-Larrea
L
. Functional imaging of brain responses to pain. A review and meta- analysis . Neurophysiol Clin.
2000; ; 30 : :263.-288. 17.
Apkarian
AV
,
Bushnell
MC
,
Treede
RD
,
Zubieta
JK
. Human brain mechanisms of pain perception and regulation in health and disease . Eur J Pain.
2005; ; 9 : :463.-484. 18.
Botvinick
M
,
Jha
AP
,
Bylsma
LM
, et al. Viewing facial expressions of pain engages cortical areas involved in the direct experience of pain . Neuroimage.
2005; ; 25 : :312.-319. 19.
Jackson
PL
,
Brunet
E
,
Meltzoff
AN
,
Decety
J
. Empathy examined through the neural mechanisms involved in imagining how I feel versus how you feel pain . Neuropsychologia.
2006; ; 44 : :752.-761. 20.
Saarela
MV
,
Hlushchuk
Y
,
Williams
AC
, et al. The compassionate brain: humans detect intensity of pain from another’s face . Cereb Cortex.
2007; ; 17 : :230.-237. 21.
Singer
T
,
Seymour
B
,
O’Doherty
J
, et al. Empathy for pain involves the affective but not sensory components of pain . Science.
2004; ; 303 : :1157.-1162. 22.
Isnard
J
,
Guenot
M
,
Ostrowsky
K
, et al. The role of the insular cortex in temporal lobe epilepsy . Ann Neurol.
2000; ; 48 : :614.-623. 23.
Mazzola
L
,
Isnard
J
,
Peyron
R
, et al. Somatotopic organization of pain responses to direct electrical stimulation of the human insular cortex . Pain.
2009; ; 146 : :99.-104. 24.
Frot
M
,
Mauguiere
F
,
Magnin
M
,
Garcia-Larrea
L
. Parallel processing of nociceptive A-delta inputs in SII and midcingulate cortex in humans . J Neurosci.
2008; ; 28 : :944.-952. 25.
Frot
M
,
Rambaud
L
,
Guenot
M
,
Mauguiere
F
. Intracortical recordings of early pain-related CO2-laser evoked potentials in the human second somatosensory (SII) area . Clin Neurophysiol.
1999; ; 110 : :133.-145. 26.
Frot
M
,
Mauguiere
F
. Dual representation of pain in the operculo-insular cortex in humans . Brain.
2003; ; 126 : :438.-450. 27.
Frot
M
,
Magnin
M
,
Mauguiere
F
,
Garcia Larrea
L
. Human SII and posterior insula differently encode thermal stimuli . Cereb Cortex.
2007; ; 17 : :610.-620. 28.
Peyron
R
,
García-Larrea
L
,
Grégoire
MC
, et al. Parietal and cingulate processes in central pain. A combined positron emission tomography (PET) and functional magnetic resonance imaging (fMRI) study of an unusual case . Pain.
2000; ; 84 : :77.-87. 29.
Peyron
R
,
Schneider
F
,
Faillenot
I
, et al. An fMRI study of cortical representation of mechanical allodynia in patients with neuropathic pain . Neurology.
2004; ; 63 : :1838.-1846. 30.
Ducreux
D
,
Attal
N
,
Parker
F
,
Bouhassira
D
. Mechanisms of central neuropathic pain: a combined psychophysical and fMRI study in syringomyelia . Brain.
2006; ; 129 : :963.-976. 31.
Peyron
R
,
García-Larrea
L
,
Grégoire
MC
, et al. Allodynia after lateral-medullary (Wallenberg) infarct. A PET study . Brain.
1998; ; 121 : :345.-356. 32.
Helmchen
C
,
Lindig
M
,
Petersen
D
,
Tronnier
V
. Disappearance of central thalamic pain syndrome after contralateral parietal lobe lesion: implications for therapeutic brain stimulation . Pain.
2002; ; 98 : :325.-330. 33.
Daniele
O
,
Fierro
B
,
Brighina
F
, et al. Disappearance of haemorrhagic stroke-induced thalamic (central) pain following a further (contralateral ischaemic) stroke . Funct Neurol.
2003; ; 18 : :95.-96. 34.
Cauda
F
,
Sacco
K
,
D’Agata
F
, et al. Low-frequency BOLD fluctuations demonstrate altered thalamocortical connectivity in diabetic neuropathic pain . BMC Neuroscience.
2009; ; 10 : :138.. 35.
Willoch
F
,
Schindler
F
,
Wester
HJ
, et al. Central poststroke pain and reduced opioid receptor binding within pain processing circuitries: a [11C]diprenorphine PET study . Pain.
2004; ; 108 : :213.-220. 36.
Maarrawi
J
,
Peyron
R
,
Mertens
P
, et al. Differential brain opioid receptor availability in central and peripheral neuropathic pain . Pain.
2007; ; 127 : :183.-194. 37.
Seifert
F
,
Maihofner
C
. Central mechanisms of experimental and chronic neuropathic pain: findings from functional imaging studies . Cell Mol Life Sci.
2009; ; 66 : :375.-390. 38.
Bingel
U
,
Tracey
I
. Imaging CNS modulation of pain in humans . Physiology.
2008; ; 23 : :371.-380. 39.
Zambreanu
L
,
Wise
RG
,
Brooks
JC
, et al. A role for the brainstem in central sensitisation in humans. Evidence from functional magnetic resonance imaging . Pain.
2005; ; 114 : :397.-407. 40.
Gwilym
SE
,
Keltner
JR
,
Warnaby
CE
, et al. Psychophysical and functional imaging evidence supporting the presence of central sensitization in a cohort of osteoarthritis patients . Arthritis Rheum.
2009; ; 61 : :1226.-1234. 41.
Bantick
SJ
,
Wise
RG
,
Ploghaus
A
, et al. Imaging how attention modulates pain in humans using functional MRI . Brain.
2002; ; 125 : :310.-319. 42.
Kupers
R
,
Faymonville
ME
,
Laureys
S
. The cognitive modulation of pain: hypnosis- and placebo-induced analgesia . Prog Brain Res.
2005; ; 150 : :251.-269. 43.
Casey
KL
,
Svensson
P
,
Morrow
TJ
, et al. Selective opiate modulation of nociceptive processing in the human brain . J Neurophysiol.
2000; ; 84 : :525.-533. 44.
Petrovic
P
,
Kalso
E
,
Petersson
KM
,
Ingvar
M
. Placebo and opioid analgesia- imaging a shared neuronal network . Science.
2002; ; 295 : :1737.-1740. 45.
Bingel
U
,
Lorenz
J
,
Gläscher
J
, et al. Cognitive control of pain: a common system for pain expectation and placebo analgesia: a single trial fMRI study . In : 10th Annual meeting of the organization for human brain mapping . Budapest, Hongrie : HBM, 13-17 juin 2004, TU 202 (poster).. 46.
García-Larrea
L
,
Peyron
R.
. Motor cortex stimulation for neuropathic pain: From phenomenology to mechanisms . Neuroimage.
2007; ; 37 ( suppl 1) : :S71.-S79. 47.
Peyron
R
,
García-Larrea
L
,
Deiber
MP
, et al. Electrical stimulation of precentral cortical area in the treatment of central pain: electrophysiological and PET study . Pain.
1995; ; 62 : :275.-286. 48.
García-Larrea
L
,
Peyron
R
,
Mertens
P
, et al. Electrical stimulation of motor cortex for pain control: a combined PET- scan and electrophysiological study . Pain.
1999; ; 83 : :259.-273. 49.
Peyron
R
,
Faillenot
I
,
Mertens
P
, et al. Motor cortex stimulation in neuropathic pain. Correlations between analgesic effect and hemodynamic changes in the brain. A PET study . Neuroimage.
2007; ; 34 : :310.-321. 50.
Nuti
C
,
Peyron
R
,
García-Larrea
L
, et al. Motor cortex stimulation for refractory neuropathic pain: four year outcome and predictors of efficacy . Pain.
2005; ; 118 : :43.-52. 51.
Maarrawi
J
,
Peyron
R
,
Mertens
P
, et al. Motor cortex stimulation for pain control induces changes in the endogenous opioid system . Neurology.
2007; ; 69 : :827.-834. 52.
Peyron
R
,
Frot
M
,
Schneider
F
, et al. Role of operculoinsular cortices in human pain processing: converging evidence from PET, fMRI, dipole modeling, and intracerebral recordings of evoked potentials . Neuroimage.
2002; ; 17 : :1336.-1346. 53.
Coatrieux
JL
,
Velut
J
,
Dillenseger
JL
,
Toumoulin
C
. De l’imagerie médicale à la thérapie guidée par l’image . Med Sci.
2010; ; 26 : :1103.-1110. |