| |
| Med Sci (Paris). 2011 February; 27(2): 117–119. Published online 2011 March 8. doi: 10.1051/medsci/2011272117.Caresser la polarité planaire dans le sens du flot Benoît Aigouy,1* Raphaël Etournay,1 Andreas Sagner,1 Douglas B. Staple,2 Reza Farhadifar,2 Jens-Christian Röper,1 Suzanne Eaton,1 and Frank Jülicher2 1Max Planck institute of molecular cell biology and genetics, Pfotenhauerstrasse 108, Dresde 01307, Allemagne 2Max Planck institute for the physics of complex systems, Noethnitzer strasse 38, Dresde 01187, Allemagne MeSH keywords: Structures anatomiques de l'animal, cytologie, Animaux, Mouvement cellulaire, physiologie, Polarité de la cellule, Drosophila, anatomie et histologie |
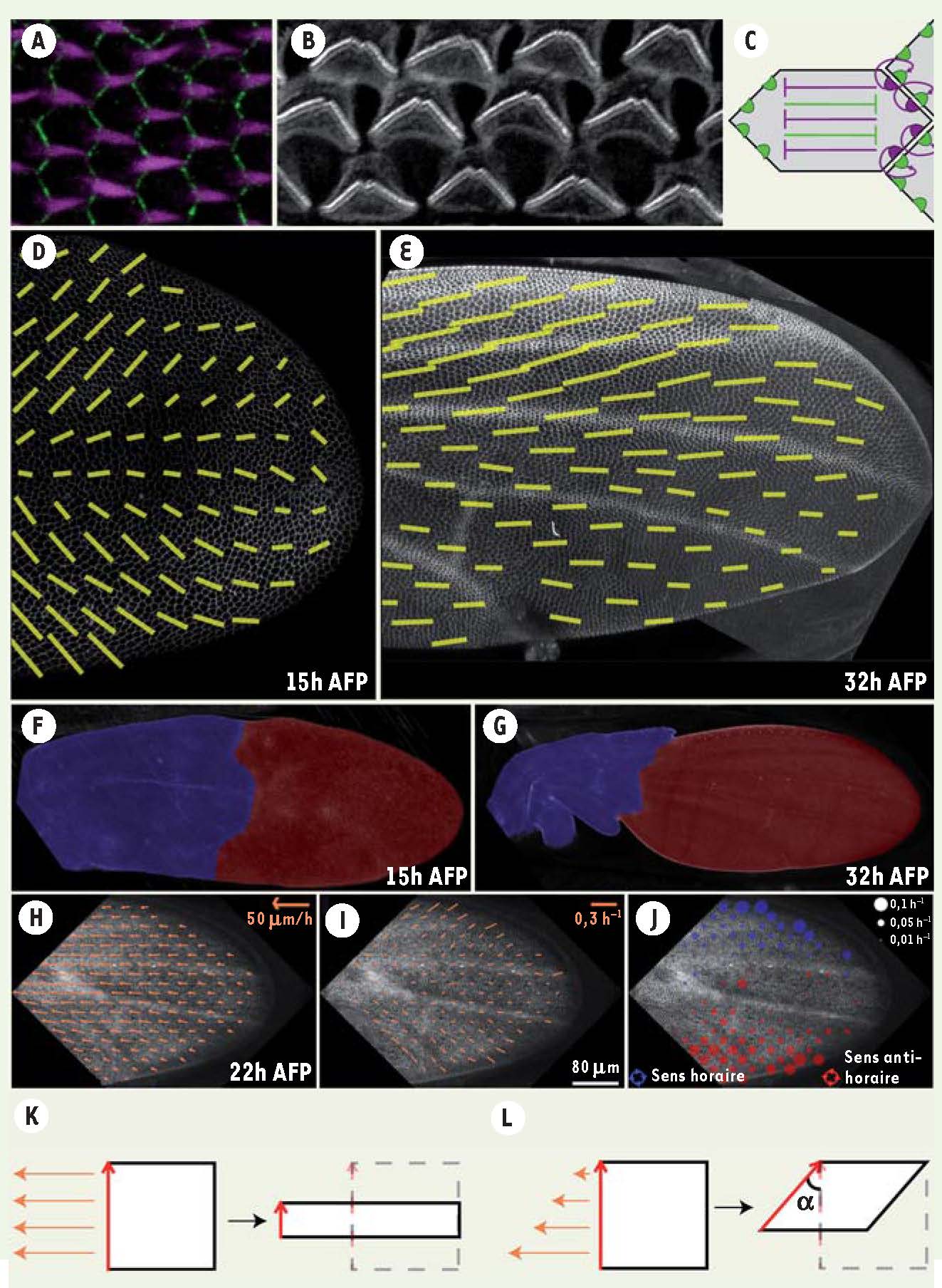
La plupart des cellules épithéliales sont polarisées dans le plan de l’épithélium [
1,
2]. Cette polarité, appelée polarité planaire, est particulièrement visible dans les épithelia qui produisent des structures externes telles que les touffes ciliaires dans les cochlées de mammifères [
3], ou les poils dans l’aile de drosophile (Figure 1A, B). Dans ces deux cas, l’alignement des structures externes est contrôlé par les protéines de polarité planaire. Ces protéines ont été décrites de manière approfondie dans l’aile de drosophile où elles s’auto-organisent en deux domaines distincts localisés asymétriquement dans chaque cellule, peu avant l’émergence des poils (Figure 1C). Un de ces domaines est localisé du côté proximal de la cellule et l’autre du côté distal. Cette ségrégation proximodistale (PD) est obtenue par exclusion mutuelle des domaines à l’intérieur d’une même cellule et par recrutement réciproque à l’interface entre deux cellules (Figure 1C) [1, 2]. Ces interactions sont suffisantes pour expliquer l’alignement local de la polarité [
4–
6]. En revanche, elles n’expliquent pas comment les cellules peuvent aligner leur polarité globalement à l’échelle du tissu. C’est ce dernier point que nous aborderons ici.  | Figure 1
La polarité planaire se réoriente au cours du développement. A-B. Exemples de tissus polarisés dans le plan. A. Immunomarquage d’une aile de drosophile après émergence des poils. Chaque cellule de l’aile produit un seul poil (violet) qui pointe du côté distal de l’aile. B. Cochlée de souris. Chaque cellule ciliée externe arbore une touffe ciliaire en forme de chevron. Ces chevrons pointent tous dans la même direction. C. Schéma de l’autorégulation des protéines de polarité planaire. Les domaines distaux (violets) et proximaux (verts) s’excluent intracellulairement et se recrutent entre cellules adjacentes. D-E. Polarité planaire (segments jaunes) dans une aile de drosophile à 15 heures AFP (D) et à 32 heures AFP (E). Chaque segment est obtenu en calculant la moyenne de la polarité d’un petit groupe de cellules. F-G. Changements morphologiques d’une aile de drosophile entre 15 heures AFP et 32 heures AFP. La partie proximale de l’aile est colorée en bleu et la partie distale en rouge. H. La contraction de la partie proximale de l’aile induit un flot cellulaire non homogène dans la partie distale de l’aile. I-J. Ce flot génère des contraintes mécaniques locales de type cisaillement (I) et rotation (J). K. Exemple de cisaillement pur causé par un flot homogène. L. Exemple de cisaillement simple causé par un flot non homogène : le cisaillement simple se décompose en un cisaillement pur (voir K) accompagné d’une rotation (α). AFP : après formation de la pupe. |
|
L’axe de la polarité planaire pivote au cours du développement de l’aile Afin de comprendre comment la polarité évolue pendant le développement pupal, nous avons quantifié la distribution des protéines de polarité planaire entre 15 heures et 32 heures après formation de la pupe (AFP). À 15 heures AFP, l’axe de polarité planaire est orienté vers la marge de l’aile, formant un angle d’environ 45 degrés avec l’axe PD du tissu (Figure 1D) [
7,
8]. Au cours du temps et jusqu’à 32 heures AFP, cet axe de polarité pivote et s’aligne sur l’axe PD [7] (Figure 1E). En conclusion, la polarité planaire ne se développe pas de novo, mais elle se réoriente au cours du développement. |
L’alignement de la polarité planaire est couplé aux changements morphologiques de l’aile Pendant la réorientation de la polarité planaire, l’épithélium subit d’importants changements morphologiques. La partie proximale de l’aile se contracte fortement (Figure 1F, G), entraînant un flot cellulaire dans la partie distale (Figure 1H). Ce flot est plus rapide au centre qu’à la périphérie de l’aile (flot non homogène), ce qui crée des contraintes mécaniques locales de type cisaillement et rotation (Figure 1I, J). Lorsque la partie distale de l’aile est déconnectée de la partie proximale, le flot cellulaire, la forme de l’aile et l’alignement global de la polarité planaire sont perturbés [7]. Ces résultats indiquent que la réorientation de la polarité planaire est couplée aux contraintes mécaniques générées dans l’aile (rotation et cisaillement). |
Cisaillement et rotation entraînent la réorientation de la polarité planaire La réorientation de polarité dans un flot non homogène a déjà été étudiée dans le cas des fluides complexes tels que les cristaux liquides polarisés et peut être décrite par l’équation phénoménologique suivante [
9,
10] :
Ici, la réorientation de l’axe de polarité (dθ/dt) dépend du taux de rotation locale (ω) et du taux de cisaillement pur (k
s
). Dans l’aile de drosophile, (k
s
) et (ω) peuvent être calculés à partir du flot cellulaire observé (voir
Figure 1H, J
). Le paramètre ν, qui est inconnu, décrit la manière dont le cisaillement pur1,
(Figure 1K) influence la réorientation de l’axe de polarité. Nous avons donc cherché à identifier les valeurs de ν permettant d’obtenir une rotation de polarité semblable à celle observée dans l’aile de drosophile. Nous avons d’abord considéré le cas ν = 0, pour lequel la réorientation de la polarité dépend uniquement des rotations locales et non du cisaillement pur. Dans ce cas, l’axe de polarité planaire pivote vers l’axe PD mais cette réorientation est incomplète [7]. Ce résultat indique que les rotations locales, à elles seules, ne suffisent pas à expliquer la réorientation observée expérimentalement et que le cisaillement pur doit lui aussi jouer un rôle (c’est-à-dire : ν ≠ 0). Dans les cas où ν est positif, la polarité tend à s’aligner perpendiculairement à l’axe PD, à l’opposé de l’orientation observée dans l’aile. En revanche, pour un large éventail de valeurs négatives de ν, la réorientation de la polarité prédite par l’équation (1) est en accord avec la réorientation observée dans l’aile (Figure 2). L’ensemble de ces résultats montre que la réorientation de la polarité est la conséquence des rotations locales et de l’alignement de la polarité dans la direction du cisaillement (ν < 0).  | Figure 2
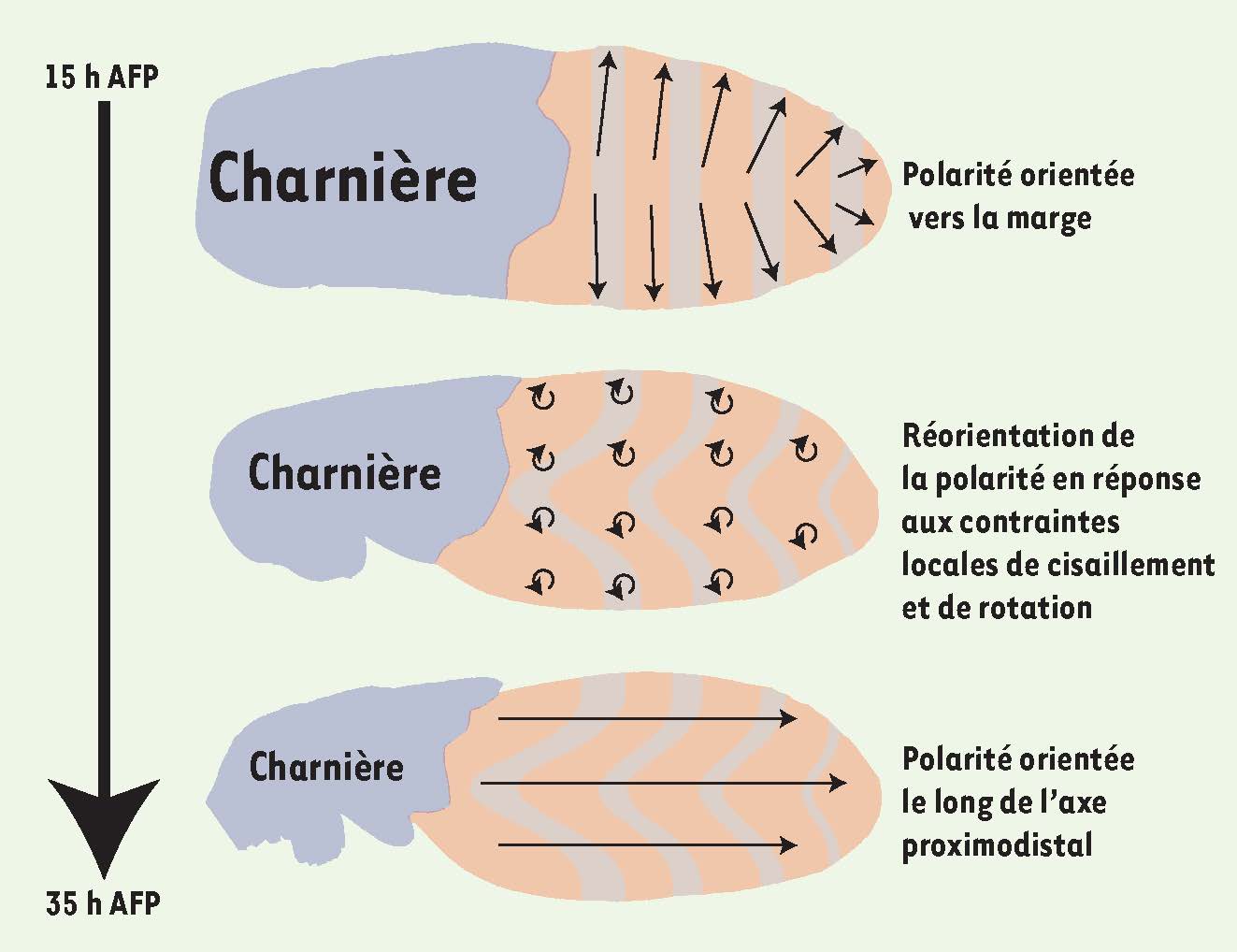
Modèle de la réorientation de la polarité planaire dans un flot non homogène. A. La polarité planaire (flèches noires) pointe initialement vers la marge de l’aile. B. La partie proximale de l’aile (charnière) se contracte, entraînant des contraintes locales de type cisaillement et rotation dans la partie distale de l’aile. C. En réponse à ces contraintes, la polarité s’aligne le long de l’axe proximo-distal de l’aile. AFP : après formation de la pupe. |
|
Nous avons identifié un nouveau mécanisme coordonnant la polarité planaire avec la forme de l’aile. En particulier, nous avons décrit comment un flot cellulaire induit des contraintes mécaniques orientées qui concourent au pivotement de la polarité vers l’axe le plus long de l’aile (axe PD). Notre analyse théorique prédit aussi que le fait de changer la valeur de ν, c’est-à-dire la manière dont le tissu répond au cisaillement, permettrait d’aligner la polarité perpendiculairement au cisaillement, dans l’axe court de l’épithélium, comme c’est le cas dans la cochlée. Enfin, nos travaux montrent l’existence et l’importance d’une polarité planaire initiale dont l’origine reste à déterminer. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Les auteurs remercient Christine Petit pour la relecture de l’article et pour l’image de la cochlée dans la
Figure 1
.Ces travaux ont été soutenus par la Max Planck Gesellschaft, la Fondation pour la Recherche Médicale, le 7th EU Framework Program, le Natural Sciences and Engineering Research Council of Canada, le Deutscher Akademischer Austausch Dienst et les Boehringer Ingelheim Fonds.
|
Footnotes |
1.
Schweisguth
F
. Bases génétiques de la polarité planaire . Med Sci (Paris).
2004; ; 20 : :424.-430. 2.
Simons
M
,
Mlodzik
M
. Planar cell polarity signaling: from fly development to human disease . Annu Rev Genet.
2008; ; 42 : :517.-540. 3.
El-Amraoui
A
,
Petit
C
. Thérapie cellulaire dans l’oreille interne : nouveaux développements et perspectives . Med Sci (Paris).
2010; ; 26 : :981.-985. 4.
Amonlirdviman
K
,
Khare
NA
,
Tree
DR
, et al.
Mathematical modeling of planar cell polarity to understand domineering nonautonomy . Science.
2005; ; 307 : :423.-426. 5.
Tree
DR
,
Ma
D
,
Axelrod
JD
. A three-tiered mechanism for regulation of planar cell polarity . Semin Cell Dev Biol.
2002; ; 13 : :217.-224. 6.
Tree
DR
,
Shulman
JM
,
Rousset
R
, et al.. Prickle mediates feedback amplification to generate asymmetric planar cell polarity signaling . Cell.
2002; ; 109 : :371.-381. 7.
Aigouy
B
,
Farhadifar
R
,
Staple
DB
, et al.
Cell flow reorients the axis of planar polarity in the wing epithelium of Drosophila . Cell.
2010; ; 142 : :773.-786. 8.
Classen
AK
,
Anderson
KI
,
Marois
E
,
Eaton
S
. Hexagonal packing of Drosophila wing epithelial cells by the planar cell polarity pathway . Dev Cell.
2005; ; 9 : :805.-817. 9.
De Gennes
PG
,
Prost
J
. The physics of liquid crystals. (2e ed) , 2e ed . Gloucestershire, UK: : Clarendon Press; , 1993. 10.
Joanny
JF
,
Julicher
F
,
Kruse
K
,
Prost
J
. Hydrodynamic theory for multi-component active polar gels . N J Phys.
2007; ; 9 : :422.. |