| |
| Med Sci (Paris). 2011 February; 27(2): 122–125. Published online 2011 March 8. doi: 10.1051/medsci/2011272122.Initiation de l’endocytose par vésicules de clathrine Des « sculpteurs de membrane » au travail Emmanuel Boucrot1* and Harvey T. McMahon1 1Laboratoire de biologie moléculaire du MRC, Hills Road, CB2 0QH Cambridge, Royaume-Uni MeSH keywords: Complexe protéique adaptateur 2, physiologie, Vésicules tapissées de clathrine, Endocytose, Protéines membranaires, Protéines |
L’endocytose par vésicules recouvertes de clathrine est une voie majeure d’internalisation dans les cellules de nombreux récepteurs transmembranaires ayant des rôles-clés dans de multiples fonctions cellulaires [
1,
2]. Cette voie d’endocytose contrôle l’entrée sélective de nombreux facteurs de croissance (hormones) et nutriments [2]. Elle est aussi détournée par certains virus et bactéries qui infectent les cellules de cette façon. La formation de vésicules recouvertes de clathrine requiert l’action concertée de plusieurs dizaines de protéines. Les étapes nécessaires sont le tri et la concentration des récepteurs, la déformation de la membrane plasmique et le recrutement du manteau de clathrine pour former un puits recouvert de clathrine, et enfin la scission de la vésicule de la surface cellulaire (Figure 1). Les principales protéines impliquées lors de ces étapes sont l’adaptateur AP2, les triskèles de clathrine (voir plus loin et [
33]), la mécano-enzyme dynamine et de nombreuses protéines dites accessoires ayant des fonctions diverses, comme l’aide au tri sélectif des récepteurs ou la déformation de la membrane plasmique [
3,
4].  | Figure 1
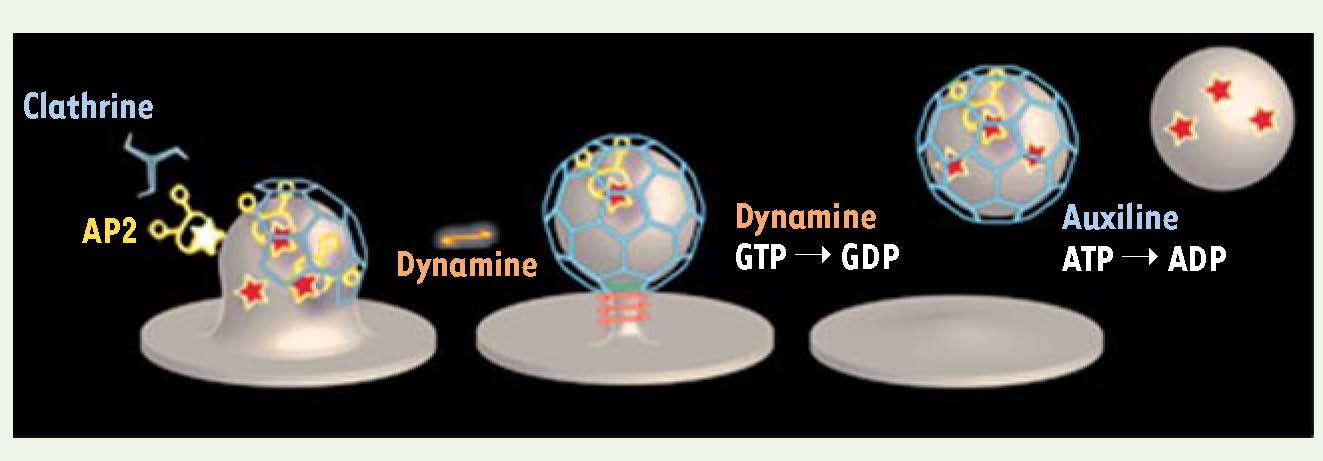
Modèle classique de la formation des vésicules de clathrine. L’adaptateur AP2 (jaune) se lie à la membrane plasmique en reconnaissant le lipide Pi(4,5)P2 et des motifs endocytiques de certains récepteurs transmembranaires (étoiles rouges). Les triskèles de clathrine (bleu) ne peuvent pas lier directement la membrane plasmique et ne sont recrutés que par l’intermédiaire d’AP2 ou d’autres adaptateurs. La polymérisation du manteau de clathrine induit la déformation de la membrane plasmique et la formation d’un puits recouvert de clathrine. La mécano-enzyme dynamine se polymérise au cou de la vésicule naissante et, par hydrolyse de GTP, induit la scission de la vésicule. À ce stade, l’auxiline recrute Hsc70 qui induit la dépolymérisation du manteau de clathrine. La vésicule continue alors son chemin en route pour les endosomes précoces, et les composants de la machinerie de la clathrine sont libérés pour un nouveau cycle. |
La clathrine est présente dans le cytosol sous forme de triskèles1 qui se polymérisent en cages formées d’hexagones et de pentagones (de forme similaire à un ballon de football) [
5,
6]. La clathrine ne peut pas se lier directement à la membrane plasmique ou aux récepteurs transmembranaires et sa polymérisation est dépendante de protéines adaptatrices, comme AP2 (Figure 1) [3]. Formée de quatre sous-unités (α2, β2, μ2 et σ2), AP2 fait la connexion entre de nombreux récepteurs, les triskèles de clathrine et de nombreuses protéines accessoires [3,
7]. Plusieurs dizaines d’autres protéines se lient soit à la clathrine soit à l’adaptateur AP2 et sont impliquées dans la formation des vésicules de clathrine [3, 4]. La fonction précise de nombre d’entre elles est toujours inconnue. Le détachement des vésicules de clathrine de la membrane plasmique requiert l’action de la dynamine, une mécano-enzyme qui induit la fission de la base (« au cou ») de la vésicule [
8]. Enfin, le désassemblage du manteau de clathrine de la vésicule nouvellement formée est assuré par l’ATPase Hsc70, recrutée par la protéine auxiline (Figure 1) [
9–
11]. La vésicule poursuit alors son chemin vers les endosomes précoces, et les composants de la machinerie du manteau de clathrine sont de nouveau disponibles pour un cycle. Les récents progrès technologiques, comme la vidéomicroscopie, la spectrométrie de masse et la déplétion ciblée de protéines par des ARN interférents ont permis d’acquérir une meilleure connaissance du processus de formation des vésicules de clathrine. L’utilisation de la vidéomicroscopie a permis l’observation en temps réel de la formation de vésicules de clathrine individuelles [
12–
14]. Des études utilisant la spectrométrie de masse ont identifié de nombreuses nouvelles protéines présentes dans les vésicules de clathrine [
15,
16] dont les fonctions ont été identifiées grâce à l’effet d’ARN interférents [
17,
18]. Cependant, plusieurs étapes de la formation des vésicules de clathrine restent incomprises, dont l’initiation, ou nucléation, des puits de clathrine. |
Induction des vésicules de clathrine : le rôle controversé d’AP2 L’initiation de la formation de vésicules de clathrine est une étape difficile à étudier : les puits recouverts de clathrine se forment et deviennent des vésicules relativement rapidement (20 à 90 secondes), sont trop petits (environ 100 nm) pour être observés directement par microscopie optique et se forment aléatoirement sur la surface des cellules [
19,
20]. L’adaptateur AP2 a longtemps été considéré comme responsable de la nucléation des puits de clathrine. En effet, cet adaptateur tétramérique est idéalement placé au centre du réseau d’interactions protéiques impliquées dans la formation des vésicules de clathrine [3]. AP2 se lie simultanément aux motifs endocytiques des récepteurs transmembranaires via ses sous-unités μ2 and σ2, et aux triskèles de clathrine via β2 [4]. AP2 se lie aussi au phosphatidylinositol bisphosphate (Pi[4,5]P2), un lipide spécifique de la membrane plasmique, via μ2 et α2 et à de nombreuses protéines accessoires via μ2 et β2 [4]. Le rôle central d’AP2 a été remis en question par les résultats d’une étude qui suggérait que la déplétion d’AP2 ne bloquait pas totalement la formation des vésicules de clathrine [
21]. On pouvait donc prédire que d’autres protéines accessoires pourraient remplir le rôle d’AP2, tout du moins en son absence. Cependant, faute de preuves de la formation de vésicules de clathrine dépourvues d’AP2, et compte tenu de certains détails importants des protocoles expérimentaux employés, le rôle central et indispensable d’AP2 a été réétabli [3, 17,
22]. Néanmoins, même s’il est central, AP2 n’a pas une grande affinité pour la membrane plasmique (Pi[4,5]P2) et les récepteurs transmembranaires, caractéristiques attendues pour induire la formation de puits de clathrine. De plus, l’arrimage à la membrane des triskèles de clathrine par le biais des adaptateurs (AP2 ou autres) et leur polymérisation ne sont pas suffisants pour induire la courbure de la membrane plasmique nécessaire à la formation de puits, puis de vésicules. Ceci est bien illustré par les fréquents treillis plats de clathrine observés à la surface de nombreuses cellules [
23]. Le rôle actif de certaines protéines capables de « sculpter » la membrane plasmique a été établi [
24–
27]. En revanche, parmi les protéines connues ayant ces propriétés, la plupart ont un rôle tardif lors de la transition, au moment où les puits de clathrine deviennent des vésicules. |
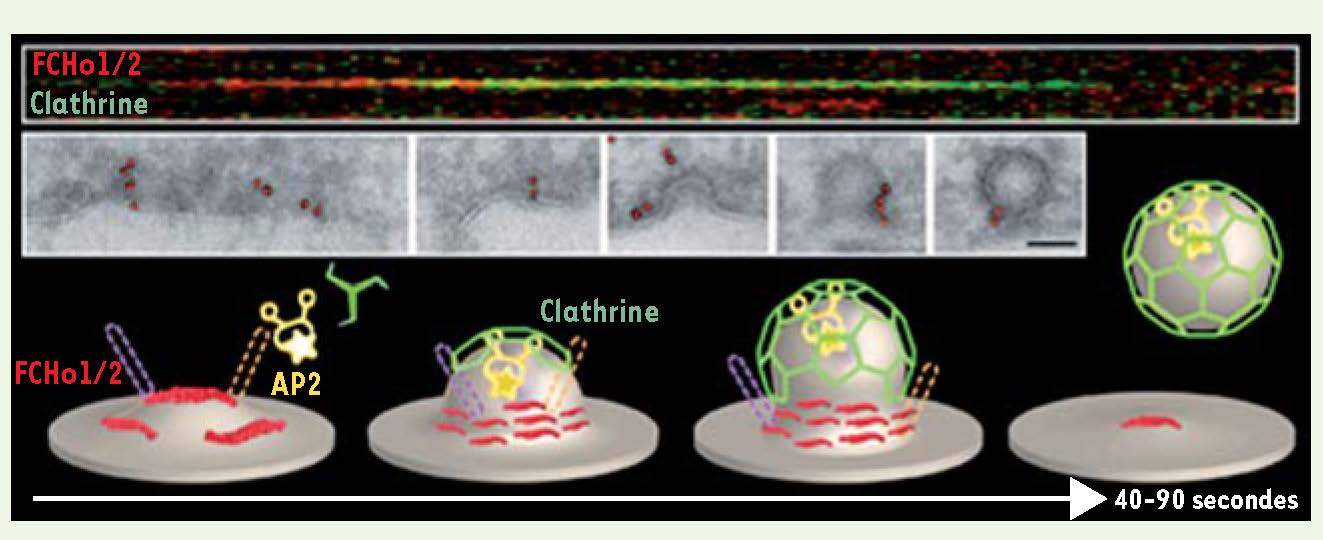
Les protéines FCHo sont des nucléateurs de la formation des vésicules de clathrine Parmi les protéines récemment associées à la formation des vésicules de clathrine, une nouvelle petite famille, celle des protéines FCHo (Fer/Cip4 homology domain-only), a montré des propriétés particulières. Dans des cellules épithéliales et neuronales mammifères, les protéines FCHo ont été détectées, par vidéomicroscopie et microscopie électronique, à la membrane plasmique avant même AP2 et la clathrine (Figure 2) [
28]. Elles définissent ainsi l’endroit où les puits de clathrine se formeront. Ce sont les premières protéines à avoir été détectées, et elles précéderaient la mise en place de la machinerie de formation des vésicules de clathrine [28]. Chez l’homme, il existe trois protéines FCHo, produits des gènes FCHO1 (deux isoformes) et FCHO2. Chez la levure Saccharomyces cerevisiae, il existe un seul homologue, le gène SYP1 (suppressor of yeast profilin deletion). La protéine Syp1 a aussi été détectée au tout début de la formation des vésicules de clathrine [
29,
30]. Contrairement aux autres protéines associées à la formation des puits de clathrine, les FCHo ne sont pas présentes dans les vésicules de clathrine, le « produit final » [15, 16]. Elles ne sont plus détectées après la constriction du cou de la vésicule, juste avant son détachement [28]. Les manipulations des niveaux d’expression des protéines FCHo ont révélé l’influence directe de ces protéines sur la nucléation des vésicules de clathrine. Lorsque les niveaux des protéines FCHo sont diminués par ARN interférence, le nombre de puits de clathrine à la membrane plasmique chute de manière drastique [28]. Il y a une inhibition parallèle de l’internalisation de ligands qui dépendent de la clathrine pour leur entrée dans les cellules, comme la transferrine (qui transporte le fer dans les cellules), le cholestérol (LDL) et le facteur de croissance EGF (epidermal growth factor). À l’inverse, la titration des niveaux d’expression des protéines FCHo par surexpression induit une augmentation parallèle du nombre de puits et vésicules de clathrine [28]. Comme il existe une corrélation directe entre la dose de protéines FCHo surexprimées et le nombre de vésicules de clathrine produites, cela suggère un rôle direct des protéines FCHo. Les vésicules de clathrine additionnelles sont productives car il y a une augmentation parallèle de l’internalisation de la transferrine dans les cellules. Les protéines FCHo ont un rôle redondant car la déplétion simultanée de FCHo1 et FCHo2 est nécessaire pour inhiber la formation des vésicules de clathrine. À l’inverse, la surexpression de chacune des protéines est suffisante pour induire la formation de vésicules de clathrine additionnelles [28]. Ces études ont permis d’ajouter une étape supplémentaire en amont du modèle classique de formation des puits de clathrine (Figure 2).  | Figure 2
Les protéines FCHo initient la formation des vésicules de clathrine.
En haut : en vidéomicroscopie (kymographe), les protéines FCHo1 et 2 (rouge) sont détectées avant la clathrine (vert). Au milieu : l’immunomarquage de FCHo2 (points rouges) observé par microscopie électronique cryogénique (pour préserver les membranes) montre que FCHo2 est présent sur des surfaces planes, avant le recrutement d’un manteau de clathrine, puis se concentre au cou de la vésicule naissante. En bas : nouveau modèle de formation des vésicules de clathrine. Les protéines FCHo1 et 2 (rouge) lient la membrane plasmique riche en Pi(4,5)P 2, recrutent les protéines Eps15, Eps15R (violet) et les intersectines (jaune), qui à leur tour regroupent et maintiennent les protéines FCHo et recrutent l’adaptateur AP2 et les triskèles de clathrine (vert), induisant l’initiation de la formation d’un puits de clathrine. Les protéines FCHo restent au cou de la vésicule naissante où leur activité de « sculpteur » de membrane est nécessaire pour la génération de la courbure requise pour la déformation de la membrane. Le reste du processus est le même que celui décrit en
Figure 1
. D’après [ 28]. |
|
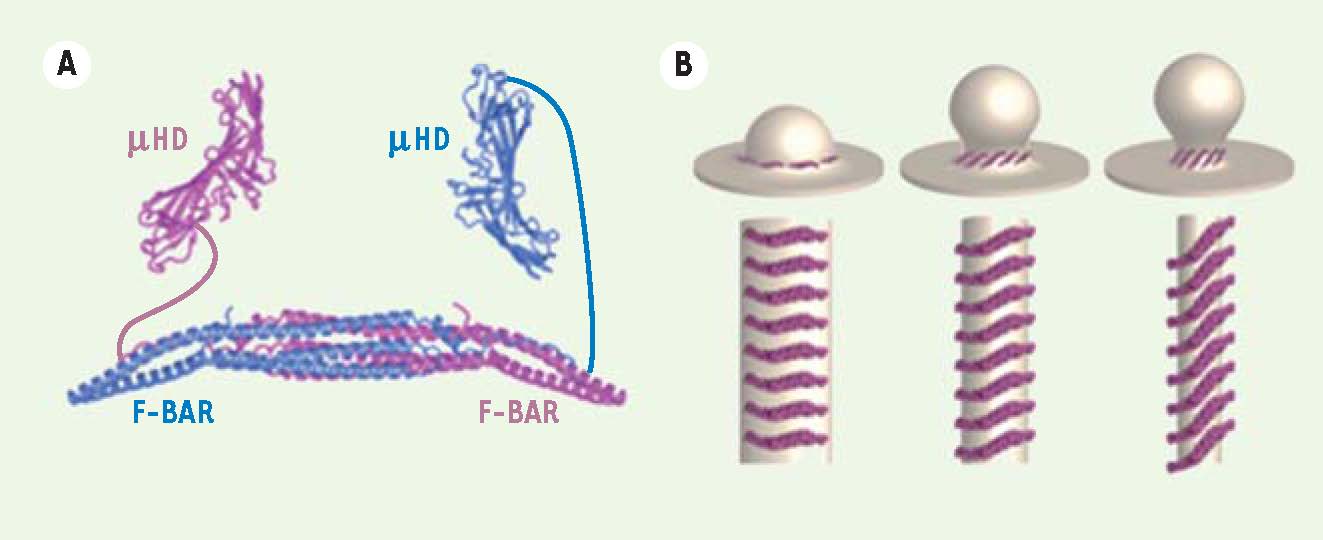
Comment les protéines FCHo induisent-elles la formation des vésicules de clathrine ? Les trois protéines FCHo sont composées de domaines similaires : elles possèdent un domaine F-BAR (Fes/CIP4 homology-BAR) à leur extrémité amino-terminale et un domaine d’homologie à la sous-unité μ de AP2, appelé μHD (μ homology domain) à leur extrémité carboxy-terminale (Figure 3). Ce dernier est un domaine de séquence et de structure similaires à la sous-unité μ2 de l’adaptateur AP2, présent dans les protéines FCHo et SGIP1 (SH3-containing GRB2-like protein 3-interacting protein 1) [29]. Les protéines FCHo ne se lient directement ni à AP2 ni à la clathrine [28]. En revanche, via leur domaine μHD, elles forment un complexe direct avec plusieurs autres protéines impliquées dans la formation des vésicules de clathrine, en particulier Eps15 (epidermal growth factor receptor substrate 15
) et Eps15R et les intersectines [28, 29]. Ces dernières se lient aussi à AP2, à la clathrine et à plusieurs autres protéines importantes pour la formation de vésicules, telle la dynamine. Ces protéines sont recrutées aux zones qui deviendront des puits de clathrine aussi précocement que les protéines FCHo, et indépendamment d’AP2 [28]. La fonction et la concentration en zones définies des protéines FCHo dépendent d’Eps15, Eps15R et des intersectines, car la diminution simultanée de leur expression induit la même inhibition de la formation de puits de clathrine que la déplétion des protéines FCHo. En revanche, les FCHo agissent en amont de ces protéines car, en absence des FCHo, elles ne sont pas recrutées à la membrane plasmique [28]. Les FCHo se lient à la membrane plasmique indépendamment de toute autre protéine grâce à leurs domaines F-BAR. Les protéines à domaines F-BAR forment une sous-classe de la famille des protéines à domaines BAR (Bin/Amphiphysin/Rvs) [
31]. Les domaines BAR sont des modules de dimérisation intermoléculaires en forme de croissant, ayant des faces concaves riches en résidus chargés positivement et pouvant lier les lipides des membranes cellulaires chargés négativement (Figure 3) [
26]. En plus de leur capacité à se lier aux membranes, les domaines BAR ont aussi celle de sentir et d’induire une courbure chez celles-ci [26]. Les domaines F-BAR peuvent également se lier aux membranes et induire une courbure, mais, en raison de la formation d’un angle moins prononcé, ils n’induisent pas de courbure aussi extrême que celle qu’induisent les domaines BAR [27,
32]. Le domaine F-BAR des protéines FCHo a une préférence pour le Pi(4,5)P2 par rapport aux autres lipides [28], ce qui explique pourquoi ces protéines sont exclusivement recrutées à la membrane plasmique, qui est très riche en Pi(4,5)P2. Lors d’expériences de tubulation in vitro, le domaine F-BAR de FCHo2 est capable de déformer des liposomes en tubes de diamètres allant de 130 à 18 nm selon la concentration de protéines [28]. Plusieurs autres protéines telles que l’amphiphysine, SNX9, FBP17, l’endophiline et l’epsine sont impliquées dans la formation de vésicules de clathrine et ont la capacité d’induire une courbure de la membrane [
25–27, 31]. En revanche, toutes ces protéines ont un rôle plus tardif que les FCHo et n’induisent pas la nucléation des puits de clathrine. Le domaine F-BAR des protéines FCHo joue un rôle crucial dans leurs fonctions. Des mutations visant à réduire leur dimérisation ou leur capacité à se lier aux membranes suffisent à abolir la capacité des protéines FCHo à induire la formation de puits de clathrine [28, 29]. De plus, la capacité des FCHo à « sculpter » la membrane plasmique à travers leurs domaines F-BAR est cruciale pour la progression des puits de clathrine en vésicules. En effet, deux mutations indépendantes qui abolissent la formation en tube des membranes par le domaine F-BAR (mais pas sa capacité à se lier aux membranes) bloquent la progression des puits de clathrine à un stade précoce [28].  | Figure 3
Les protéines FCHo sont des « sculpteurs de membrane » . A. Les protéines FCHo sont composées d’un domaine F-BAR ( Fes/CIP4 homology-BAR) à leurs extrémités amino-terminales et un domaine d’homologie à la sous-unité μ de AP2, « μHD » ( μ homology domain) à leur extrémité carboxy-terminale. Deux molécules de FCHo2 sont représentées ici (une bleue et une magenta), formant un dimère fonctionnel. La dimérisation des domaines F-BAR crée un domaine en forme de croissant, avec une face concave riche en résidus chargés positivement qui se lie et déforme les membranes. Les domaines μHD se lient aux protéines Eps15, Eps15R et intersectines qui, à leur tour, recrutent l’adaptateur AP2 et les triskèles de clathrine. B. Les domaines F-BAR des protéines FCHo peuvent induire plusieurs degrés de courbure de la membrane plasmique. Il existe un parallèle entre l’arrangement des domaines F-BAR de FCHo2 sur les tubes de diamètres allant de 130 à 18 nm qu’ils induisent in vitro (bas) et l’arrangement qu’ils pourraient avoir au cou de la vésicule naissante (haut). Les protéines FCHo restent au cou de la vésicule (voir images de microscopie électronique de la
Figure 2
) (d’après [ 28]). |
Les protéines FCHo sont des nucléateurs des puits de clathrine à la membrane plasmique et induisent la courbure initiale nécessaire à la formation des puits. Cependant, de nombreuses questions restent encore sans réponse. Y a-t-il d’autres protéines capables d’induire la formation des puits de clathrine ? Comment les récepteurs sont-ils recrutés et concentrés dans les puits ? Comment la formation des puits de clathrine est-elle régulée ? Les études des prochaines années vont vraisemblablement y répondre. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Les auteurs remercient le Medical Research Council (MRC) et la Human Frontier Science Program Organization (HFSP) pour leur soutien et M
lle
Wendy Tsang Man Pun pour la relecture de cette nouvelle.
|
Footnotes |
1.
Doherty
GJ
,
McMahon
HT
. Mechanisms of endocytosis . Annu Rev Biochem.
2009; ; 78 : :857.-902. 2.
Scita
G
,
Di Fiore
PP
. The endocytic matrix . Nature.
2010; ; 463 : :464.-473. 3.
Schmid
EM
,
McMahon
HT
. Integrating molecular and network biology to decode endocytosis . Nature.
2007; ; 448 : :883.-888. 4.
Traub
LM
. Tickets to ride: selecting cargo for clathrin-regulated internalization . Nat Rev Mol Cell Biol.
2009; ; 10 : :583.-596. 5.
Crowther
RA
,
Pearse
BM
. Assembly and packing of clathrin into coats . J Cell Biol.
1981; ; 91 : :790.-797. 6.
Fotin
A
,
Cheng
Y
,
Sliz
P
, et al.. Molecular model for a complete clathrin lattice from electron cryomicroscopy . Nature.
2004; ; 432 : :573.-579. 7.
Edeling
MA
,
Smith
C
,
Owen
D
. Life of a clathrin coat: insights from clathrin and AP structures . Nat Rev Mol Cell Biol.
2006; ; 7 : :32.-44. 8.
Marks
B
,
Stowell
MH
,
Vallis
Y
, et al.
GTPase activity of dynamin and resulting conformation change are essential for endocytosis . Nature.
2001; ; 410 : :231.-235. 9.
Braell
WA
,
Schlossman
DM
,
Schmid
SL
,
Rothman
JE
. Dissociation of clathrin coats coupled to the hydrolysis of ATP: role of an uncoating ATPase . J Cell Biol.
1984; ; 99 : :734.-741. 10.
Greene
LE
,
Eisenberg
E
. Dissociation of clathrin from coated vesicles by the uncoating ATPase . J Biol Chem.
1990; ; 265 : :6682.-6687. 11.
Massol
RH
,
Boll
W
,
Griffin
AM
,
Kirchhausen
T
. A burst of auxilin recruitment determines the onset of clathrin-coated vesicle uncoating . Proc Natl Acad Sci USA.
2006; ; 103 : :10265.-10270. 12.
Rappoport
JZ
,
Simon
SM
,
Benmerah
A
. Understanding living clathrin-coated pits . Traffic.
2004; ; 5 : :327.-337. 13.
Merrifield
CJ
. Seeing is believing: imaging actin dynamics at single sites of endocytosis . Trends Cell Biol.
2004; ; 14 : :352.-358. 14.
Kirchhausen
T
. Imaging endocytic clathrin structures in living cells . Trends Cell Biol.
2009; ; 19 : :596.-605. 15.
Blondeau
F
,
Ritter
B
,
Allaire
PD
, et al.
Tandem MS analysis of brain clathrin-coated vesicles reveals their critical involvement in synaptic vesicle recycling . Proc Natl Acad Sci USA.
2004; ; 101 : :3833.-3838. 16.
Borner
GH
,
Harbour
M
,
Hester
S
, et al.
Comparative proteomics of clathrin-coated vesicles . J Cell Biol.
2006; ; 175 : :571.-578. 17.
Huang
F
,
Khvorova
A
,
Marshall
W
,
Sorkin
A
. Analysis of clathrin-mediated endocytosis of epidermal growth factor receptor by RNA interference . J Biol Chem.
2004; ; 279 : :16657.-16661. 18.
Mettlen
M
,
Stoeber
M
,
Loerke
D
, et al.
Endocytic accessory proteins are functionally distinguished by their differential effects on the maturation of clathrin-coated pits . Mol Biol Cell.
2009; ; 20 : :3251.-3260. 19.
Ehrlich
M
,
Boll
W
,
Van Oijen
A
, et al.
Endocytosis by random initiation and stabilization of clathrin-coated pits . Cell.
2004; ; 118 : :591.-605. 20.
Loerke
D
,
Mettlen
M
,
Yarar
D
, et al.
Cargo and dynamin regulate clathrin-coated pit maturation . PLoS Biol.
2009; ; 7 : :e57.. 21.
Motley
A
,
Bright
NA
,
Seaman
MN
,
Robinson
MS
. Clathrin-mediated endocytosis in AP-2-depleted cells . J Cell Biol.
2003; ; 162 : :909.-918. 22.
Boucrot
E
,
Saffarian
S
,
Zhang
R
,
Kirchhausen
T
. Roles of AP-2 in clathrin-mediated endocytosis . PLoS One.
2010; ; 5 : :e10597.. 23.
Heuser
J
. Three-dimensional visualization of coated vesicle formation in fibroblasts . J Cell Biol.
1980; ; 84 : :560.-583. 24.
Ford
MG
,
Pearse
BM
,
Higgins
MK
, et al.
Simultaneous binding of PtdIns(4, 5)P2 and clathrin by AP180 in the nucleation of clathrin lattices on membranes . Science.
2001; ; 291 : :1051.-1055. 25.
Ford
MG
,
Mills
IG
,
Peter
BJ
, et al.
Curvature of clathrin-coated pits driven by epsin . Nature.
2002; ; 419 : :361.-366. 26.
Peter
BJ
,
Kent
HM
,
Mills
IG
, et al.
BAR domains as sensors of membrane curvature: the amphiphysin BAR structure . Science.
2004; ; 303 : :495.-499. 27.
Shimada
A
,
Niwa
H
,
Tsujita
K
, et al.. Curved EFC/F-BAR-domain dimers are joined end to end into a filament for membrane invagination in endocytosis . Cell.
2007; ; 129 : :761.-772. 28.
Henne
WM
,
Boucrot
E
,
Meinecke
M
, et al.
FCHo proteins are nucleators of clathrin-mediated endocytosis . Science.
2010; ; 328 : :1281.-1284. 29.
Reider
A
,
Barker
SL
,
Mishra
SK
, et al.
Syp1 is a conserved endocytic adaptor that contains domains involved in cargo selection and membrane tubulation . EMBO J.
2009; ; 28 : :3103.-3116. 30.
Stimpson
HE
,
Toret
CP
,
Cheng
AT
, et al.
Early-arriving Syp1p and Ede1p function in endocytic site placement and formation in budding yeast . Mol Biol Cell.
2009; ; 20 : :4640.-4651. 31.
Frost
A
,
Unger
VM
,
De Camilli
P
. The BAR domain superfamily: membrane-molding macromolecules . Cell.
2009; ; 137 : :191.-196. 32.
Henne
WM
,
Kent
HM
,
Ford
MG
, et al.
Structure and analysis of FCHo2 F-BAR domain: a dimerizing and membrane recruitment module that effects membrane curvature . Structure.
2007; ; 15 : :839.-852. 33.
Benmerah
A
,
Lamaze
C
. Endocytose : chaque voie compte ! . Med Sci (Paris).
2002; ; 18 : :1126.-36. |