| |
| Med Sci (Paris). 2011 February; 27(2): 132–135. Published online 2011 March 8. doi: 10.1051/medsci/2011272132.Effet des protéines de la myéline sur la régénération axonale et le bourgeonnement Cédric Geoffroy1* 1Department of neurosciences, University of California San Diego, 9500 Gilman Drive, MC 0691, 92093-0691 La Jolla, États-Unis MeSH keywords: Animaux, Axones, physiologie, Cellules cultivées, Humains, Protéines de la myéline, Régénération nerveuse |
L’une des principales conséquences d’une lésion de la moelle épinière (LME) chez l’adulte est la détérioration, voire la rupture des axones, empêchant la transmission de l’information nerveuse du corps cellulaire jusqu’aux cibles et se traduisant par des déficits sensoriels et/ou moteurs. Ces axones n’ont pas la capacité de se régénérer dans le système nerveux central (SNC). Cette absence de régénération est attribuée à plusieurs facteurs : le manque de capacités intrinsèques des neurones à repousser [
1], la présence d’une cicatrice gliale au niveau de la lésion [
2], l’insuffisance de facteurs neurotrophiques nécessaires à la repousse des axones [
3] et enfin la nature inhibitrice des composants de la myéline [
4]. Il existe trois protéines majeures de la myéline : Nogo (réticulon 4), MAG (myelin-associated glycoprotein) et OMgp (oligodendrocyte myelin associated protein) (Figure 1). Ces protéines ont été très étudiées in vitro et sont, individuellement, capables d’inhiber la repousse axonale [4]. Malgré leur manque d’homologie, ces inhibiteurs partagent les mêmes récepteurs neuronaux - NgR1 (Nogo receptor 1) et PirB (paired immunoglobulin-like receptor B) - et corécepteurs (TROY, LINGO-1 et p75NTR ou récepteur des neurotrophines), ainsi que des voies de signalisation similaires (par exemple la voie Rho). MAG se lie également au récepteur NgR2. Bien que ces mécanismes aient été largement étudiés in vitro, la contribution relative de ces protéines in vivo n’est toujours que partiellement définie. 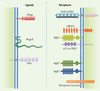 | Figure 1
Les protéines de la myéline et leurs récepteurs inhibant la repousse axonale. Le récepteur PirB (LILRB2 chez l’homme) se lie avec Nogo (réticulon 4), MAG (myelin associated glycoprotein) et OMgp (oligodendrocyte myelin glycoprotein). Le récepteur NgR1 (Nogo receptor 1) se lie avec Nogo, MAG et OMgp en formant des complexes avec LINGO1 et p75 ou TROY. NgR2 interagit uniquement avec MAG. D’autres récepteurs inconnus peuvent certainement exister. Ces protéines sont susceptibles de jouer des rôles redondants dans l’inhibition de la régénération axonale, et par conséquent enlever ces trois ligands pourrait augmenter la régénération des axones. |
L’implication de ces protéines dans la régénération axonale après une lésion de la moelle épinière a été étudiée à l’aide de différentes souris knock out (KO) pour les gènes codant pour l’une ou l’autre de ces protéines. Les résultats de ces études, bien que variables [
5–
9], et le fait que ces protéines partagent des mécanismes moléculaires communs, ont conduit à l’hypothèse selon laquelle Nogo, MAG et OMgp jouent dans la myéline un rôle redondant sur l’inhibition de la repousse axonale [
10]. Nous avons donc évalué, in vitro et in vivo, l’effet de l’absence simultanée de ces trois protéines sur la régénération axonale et la croissance compensatoire d’axones non lésés (bourgeonnement) [
11] en utilisant une souris triple KO dans laquelle ni Nogo, ni MAG, ni OMgp ne sont exprimées. Ces souris triple transgéniques (TKO) ont été créées à partir d’animaux simples transgéniques caractérisés précédemment, Nogo-A, B, C KO [
12], OMgp KO [
13], MAG KO [
14]. Ces animaux TKO sont viables, fertiles et ne présentent pas d’anomalies morphologiques. |
Effet in vitro de l’absence combinée des trois protéines de la myéline sur la repousse axonale Nous avons tout d’abord testé in vitro l’effet d’inhibition de la repousse axonale par la myéline. La myéline de la moelle épinière des animaux sauvages, simple mutants et triple mutants, a pour cela été purifiée, et, après vérification de l’absence des protéines Nogo, MAG et OMgp par Western blot, elle a été utilisée comme substrat pour la culture de neurones cérébelleux. En accord avec les études antérieures, nous avons montré que la myéline de type sauvage (WT) inhibe la pousse axonale des neurones. Cette inhibition est partiellement corrigée lorsque les trois variants d’épissage de la famille Nogo, Nogo-A, -B et -C sont absents. Cependant, l’absence combinée des trois protéines de la myéline n’a pas augmenté la repousse des axones au-delà de celle observée en l’absence de Nogo. En utilisant un autre type cellulaire (neurones adultes des ganglions spinaux) et un modèle plus physiologique (cryosections de la moelle épinière), nous avons ensuite confirmé ce résultat. |
Effet in vivo des protéines de la myéline sur le bourgeonnement Afin d’étudier l’hypothèse d’un effet redondant des trois protéines inhibitrices sur la croissance axonale in vivo après lésion du SNC, nous avons examiné deux faisceaux possédant des caractéristiques distinctes : le faisceau raphé-spinal (faisceau sérotoninergique provenant du raphé), dont la capacité de régénération est importante, et le faisceau cortico-spinal (ou faisceau pyramidal, provenant du cortex cérébral), réfractaire à la régénération. Faisceau raphé-spinal Nous avons tout d’abord induit une lésion de la moelle épinière en effectuant une hémisection latérale de la moelle épinière au niveau thoracique T8, ce qui entraîne une déplétion des informations sérotoninergiques. Le bourgeonnement des axones non lésés a été évalué par immunomarquage par la 5-hydroxytryptamine (5-HT) du côté controlatéral au niveau lombaire (localisation caudale par rapport à la lésion). Quatre semaines après la lésion, les souris KO pour MAG et OMgp, mais pas les souris déficientes pour Nogo, présentaient un niveau d’immunoréactivité environ deux fois supérieur à celui des souris sauvages, alors qu’il n’était pas accru chez les TKO. Néanmoins, aucune des souris mutantes n’a mieux exécuté les tests fonctionnels que les souris contrôles (un test de coordination motrice, le gridwalk, et un test de comportement en champ libre, le basso mouse scale (BMS) open-field). Ces résultats montrent qu’il n’y a pas d’effet synergique lié à la délétion de ces trois protéines. Faisceau cortico-spinal (ou faisceau pyramidal) Nous avons ensuite réalisé une lésion latérale droite du faisceau pyramidal (pyramidotomie,
Figure 2A
), au-dessus de la décussation pyramidale 1, résultant en une dénervation du côté gauche de la moelle épinière. Après injection d’un traceur (BDA, biotin-dextran amine) dans le cortex moteur, les axones en provenance du côté non lésé et croisant la ligne médiale ont été comptés. Les souris KO pour Nogo présentent une augmentation du bourgeonnement comparé aux souris sauvages (Figure 2B-C), en adéquation avec des travaux précédents [
15]. Tandis que les souris déficientes pour OMgp ne diffèrent pas des souris sauvages, les mutants MAG montrent, étonnamment, une diminution de ce bourgeonnement. En adéquation avec ces observations, les bourgeonnements des axones du faisceau pyramidal sont comparables pour les souris TKO et sauvages, et à un niveau intermédiaire entre ceux des souris invalidées pour Nogo et MAG (Figure 2D). Cependant, ce bourgeonnement ne se traduit pas par une différence au niveau fonctionnel. En effet, les différentes lignées de souris présentent sensiblement le même profil de réponse lors du test d’utilisation préférentielle des pattes antérieures. L’utilisation d’un autre modèle de LME, l’hémisection dorsale de la moelle épinière, nous a permis de confirmer ce résultat. Ainsi, une élimination de la protéine Nogo augmente le bourgeonnement, alors que la délétion de MAG le diminue. En outre, il n’y pas d’effet synergique des trois protéines majeures de la myéline.  | Figure 2
Bourgeonnement et régénération après lésion de la moelle épinière. A-D. Après pyramidotomie, les axones du faisceau pyramidal non lésé (marqués par injection du traceur BDA dans le cortex moteur) présentent des extensions au niveau contralatéral (bourgeonnement) de la moelle épinière cervicale. Les animaux déficients pour Nogo (C) montrent plus de bourgeonnements que les animaux contrôles (B), tandis que les animaux TKO (D) présentent un niveau de bourgeonnement similaire à celui des animaux sauvages. A. Image représentative d’une section coronale de la moelle épinière cervicale après pyramidotomie et injection de BDA. B-D. Images représentatives à fort grossissement correspondant au rectangle dans A, pour chacun des animaux mutants et contrôles. E-F. Après complète transection de la moelle épinière (la flèche indique le site de la lésion, et les astrocytes, marqués en vert par le GFAP, montrent les bordures de la lésion), les axones sérotoninergiques ne régénèrent pas, chez aucun mutant testé, bien que le marquage 5-HT (en rouge) des animaux TKO soit environ trois fois supérieur à celui des sauvages, au niveau rostral de la lésion. Échelle : 500μm pour A et E-F, 50μm pour B-D. |
|
Effet sur la régénération des axones lésés Nous avons ensuite examiné l’effet de l’absence de ces protéines sur la régénération d’axones lésés. Nous avons employé un modèle de transection complète de la moelle épinière et un modèle d’hémisection dorsale pour étudier respectivement le faisceau raphé-spinal et le faisceau pyramidal. Faisceau raphé-spinal À la suite d’une transection complète de la moelle épinière, l’intensité de marquage 5-HT des axones sérotoninergiques présents au niveau rostral de la lésion dans les souris TKO est supérieure à celle des animaux contrôles (Figure 2E-F). Cependant, aucun axone n’a été observé traversant le site de lésion, pour aucun des phénotypes testés. En outre, les souris sauvages et TKO affichent le même score minimum BMS après le test open-field. Faisceau cortico-spinal L’injection de BDA dans le cortex après une hémisection dorsale de la moelle épinière a démontré que les axones du faisceau pyramidal étaient rarement détectés au niveau de la lésion et en aval de la lésion, que ce soit pour les animaux sauvages ou pour les animaux TKO. La quantification de la densité axonale a conforté ce résultat. De même, aucun des tests de locomotion utilisés dans notre étude (le gridwalk, l’ open-field et le rotarod ou test de la tige tournante) n’a révélé de différence significative entre ces deux génotypes. Enfin, aucun des animaux simples KO n’a montré une régénération significative des axones lésés. |
Nos travaux démontrent tout d’abord que les protéines de la myéline Nogo, MAG et OMgp ne sont pas les principaux responsables de la régénération limitée des axones après une lésion de la moelle épinière. Si l’absence de régénération des axones sérotoninergiques après une transection complète peut être liée à la présence de la cicatrice gliale au niveau de la lésion, dans le cas d’une hémisection dorsale, la partie ventrale de la moelle épinière peut servir de support pour la régénération. Par conséquent, d’autres mécanismes (dont le potentiel intrinsèque des neurones) sont certainement nécessaires à la régénération. Par ailleurs, nos résultats confirment l’implication de ces protéines sur le bourgeonnement des axones, Nogo ayant le rôle majeur, et confortent l’idée selon laquelle cibler Nogo, MAG ou OMgp peut moduler ce bourgeonnement. Cependant, aucun bénéfice fonctionnel n’a été observé lors de l’augmentation de ce bourgeonnement. De plus, aucun effet additif sur le bourgeonnement (ni sur la régénération) n’a résulté de la délétion simultanée de Nogo, MAG et OMgp, suggérant une absence de redondance fonctionnelle de ces trois protéines. Il convient de noter qu’une étude similaire à la nôtre a été publiée au même moment [
16], dont les résultats étaient très différents, puisqu’une augmentation de la régénération du faisceau pyramidal et une amélioration fonctionnelle ont été observées chez des animaux KO pour Nogo (simple KO et TKO), ainsi qu’un effet additif des protéines de la myéline. Le fond génétique des animaux, la nature des différentes mutations (les modèles de KO Nogo et OMgp diffèrent), le type de lésion effectuée (seule une lésion dorsale de la moelle épinière a été utilisée dans toute l’étude), de même que la distinction stricte entre régénération et bourgeonnement peuvent avoir des impacts importants sur les résultats expérimentaux, et expliquer les différences entre les deux études. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1.
Park
KK
,
Liu
K
,
Hu
Y
, et al.
Promoting axon regeneration in the adult CNS by modulation of the PTEN/mTOR pathway . Science.
2008; ; 322 : :963.-966. 2.
Silver
J
,
Miller
JH
. Regeneration beyond the glial scar . Nat Rev Neurosci.
2004; ; 5 : :146.-156. 3.
Lu
P
,
Tuszynski
MH
. Growth factors and combinatorial therapies for CNS regeneration . Exp Neurol.
2008; ; 209 : :313.-320. 4.
Filbin
MT
. Myelin-associated inhibitors of axonal regeneration in the adult mammalian CNS . Nat Rev Neurosci.
2003; ; 4 : :703.-713. 5.
Zheng
B
,
Ho
C
,
Li
S
, et al.
Lack of enhanced spinal regeneration in Nogo-deficient mice . Neuron.
2003; ; 38 : :213.-224. 6.
Bartsch
U
,
Bandtlow
CE
,
Schnell
L
, et al.
Lack of evidence that myelin-associated glycoprotein is a major inhibitor of axonal regeneration in the CNS . Neuron.
1995; ; 15 : :1375.-1381. 7.
Kim
JE
,
Li
S
,
GrandPre
T
, et al.
Axon regeneration in young adult mice lacking Nogo-A/B . Neuron.
2003; ; 38 : :187.-199. 8.
Simonen
M
,
Pedersen
V
,
Weinmann
O
, et al.
Systemic deletion of the myelin-associated outgrowth inhibitor Nogo-A improves regenerative and plastic responses after spinal cord injury . Neuron.
2003; ; 38 : :201.-211. 9.
Steward
O
,
Zheng
B
,
Banos
K
, et al.
Axon regeneration in young adult mice lacking Nogo-A/B. Neuron 38, 187-199 . Neuron.
2007; ; 54 : :191.-195. 10.
Zheng
B
,
Atwal
J
,
Ho
C
, et al.
Genetic deletion of the Nogo receptor does not reduce neurite inhibition in vitro or promote corticospinal tract regeneration in vivo
. Proc Natl Acad Sci USA.
2005; ; 102 : :1205.-1210. 11.
Lee
JK
,
Geoffroy
CG
,
Chan
AF
, et al.. Assessing spinal axon regeneration and bourgeonnement in Nogo-, MAG-, and OMgp-deficient mice . Neuron.
2010; ; 66 : :663.-670. 12.
Lee
JK
,
Chan
AF
,
Luu
SM
, et al.
Reassessment of corticospinal tract regeneration in Nogo-deficient mice . J Neurosci.
2009; ; 29 : :8649.-8654. 13.
Lee
JK
,
Case
LC
,
Chan
AF
, et al.
Generation of an OMgp allelic series in mice . Genesis.
2009; ; 47 : :751.-756. 14.
Li
C
,
Tropak
MB
,
Gerlai
R
, et al.
Myelination in the absence of myelin-associated glycoprotein . Nature.
1994; ; 369 : :747.-750. 15.
Cafferty
WB
,
Strittmatter
SM
. The Nogo-Nogo receptor pathway limits a spectrum of adult CNS axonal growth . J Neurosci.
2006; ; 26 : :12242.-12250. 16.
Cafferty
WB
,
Duffy
P
,
Huebner
E
, et al.
MAG and OMgp synergize with Nogo-A to restrict axonal growth and neurological recovery after spinal cord trauma . J Neurosci.
2010; ; 30 : :6825.-6837. 17.
Elliott
J
,
Cayouette
M
. La protéine de polarité Par-3. Chef d’orchestre dans la formation de la myéline . Med Sci (Paris).
2007; ; 23 : :259.-260. |