| |
| Med Sci (Paris). 2011 February; 27(2): 138–141. Published online 2011 March 8. doi: 10.1051/medsci/2011272138.Le génome de l’éponge Amphimedon queenslandica nous aide à reconstruire notre ancêtre précambrien Claire Larroux1* 1Département des sciences de la terre et de l’environnement, de paléontologie et de géobiologie, Ludwig-Maximilians-Universität, Richard-Wagner-Strasse 10, 80333 Munich, Allemagne MeSH keywords: Animaux, Évolution moléculaire, Génome, Porifera, génétique |
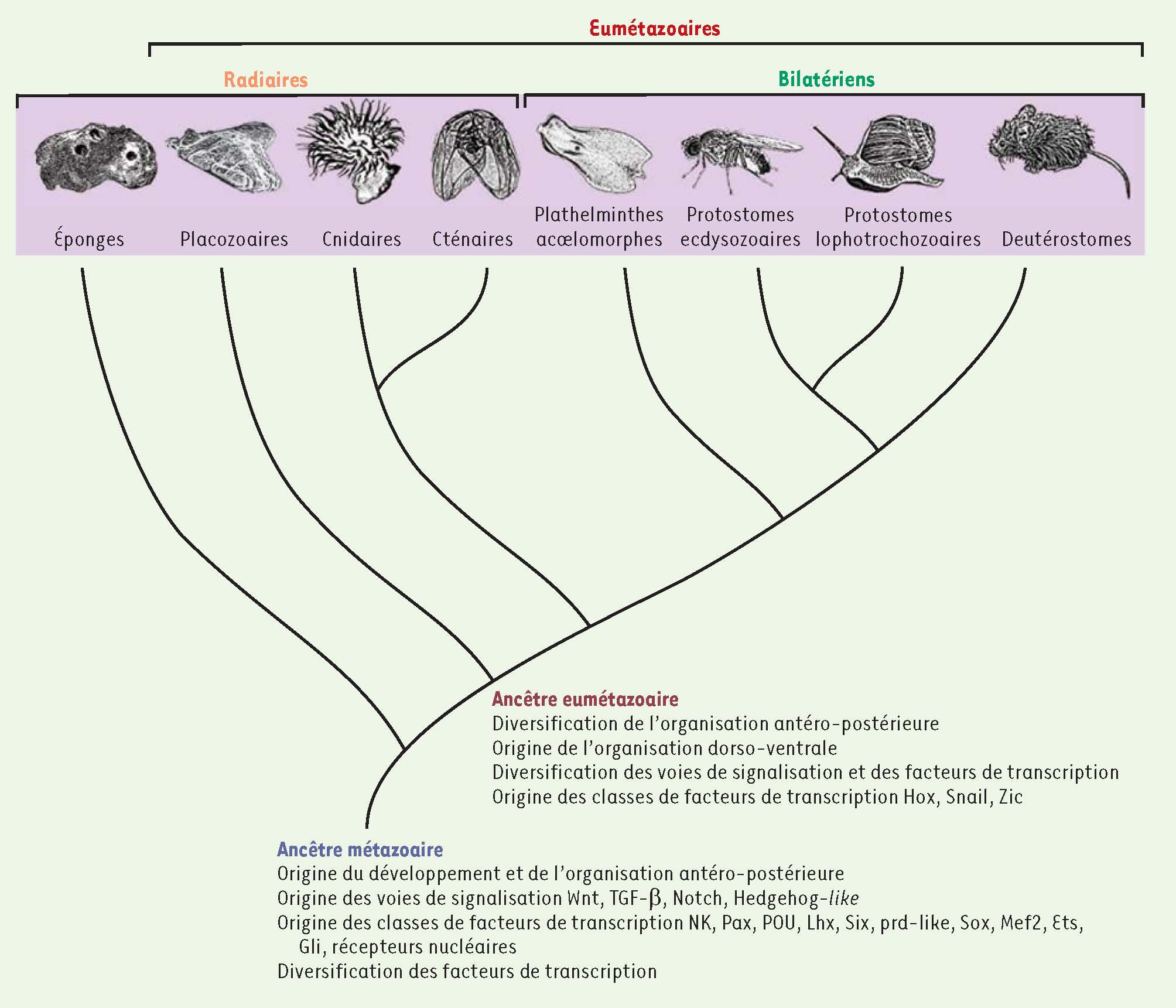
Ces vingt dernières années ont vu un chamboulement dans notre perception de l’évolution des animaux grâce aux outils de la phylogénie moléculaire. Les relations entre les différents phylums sont encore l’objet de débats, mais les éponges semblent appartenir au plus ancien groupe vivant, datant du Précambrien, il y a plus de 600 millions d’années [
1,
2]. Les embranchements suivants auraient été les placozoaires et les cœlentérés (cnidaires et cténaires) qui, comme les éponges, ont généralement un seul axe de symétrie. Puis, après la séparation des plathelminthes acœlomorphes, les métazoaires se seraient divisés en trois grands groupes bilatériens (avec deux axes de symétrie), les deutérostomes et les protostomes, eux-mêmes séparés en écdysozoaires et lophotrochozoaires (Figure 1).  | Figure 1
Arbre des métazoaires selon Philippe et al. [1]. Dans leur article, ces auteurs réfutent les analyses qui placent les cténaires ou les placozoaires à la racine de l’arbre. Les conditions ancestrales hypothétiques dans le domaine du développement sont indiquées. |
|
Reconstruire le génome de l’ancêtre des métazoaires Grâce aux récents séquençages de génomes de taxons proches de la racine de l’arbre métazoaire, nous pouvons enfin entrevoir les événements lointains qui ont contribué à l’évolution du premier animal pluricellulaire à partir d’un organisme unicellulaire. Grâce à un travail collaboratif d’équipes internationales, dont la nôtre, le génome d’une éponge démosponge de la grande barrière de corail en Australie a été récemment publié dans Nature, sous le titre (traduit) : « Le génome d’Amphimedon queenslandica et l’évolution de la complexité » [2]. Dans cet article, nous avons comparé ce génome avec celui d’un choanoflagellé (du groupe des protozoaires qui sont les plus apparentés aux métazoaires) ainsi qu’avec ceux d’eumétazoaires (nom donné au groupe des métazoaires sans les éponges, voir
Figure 1
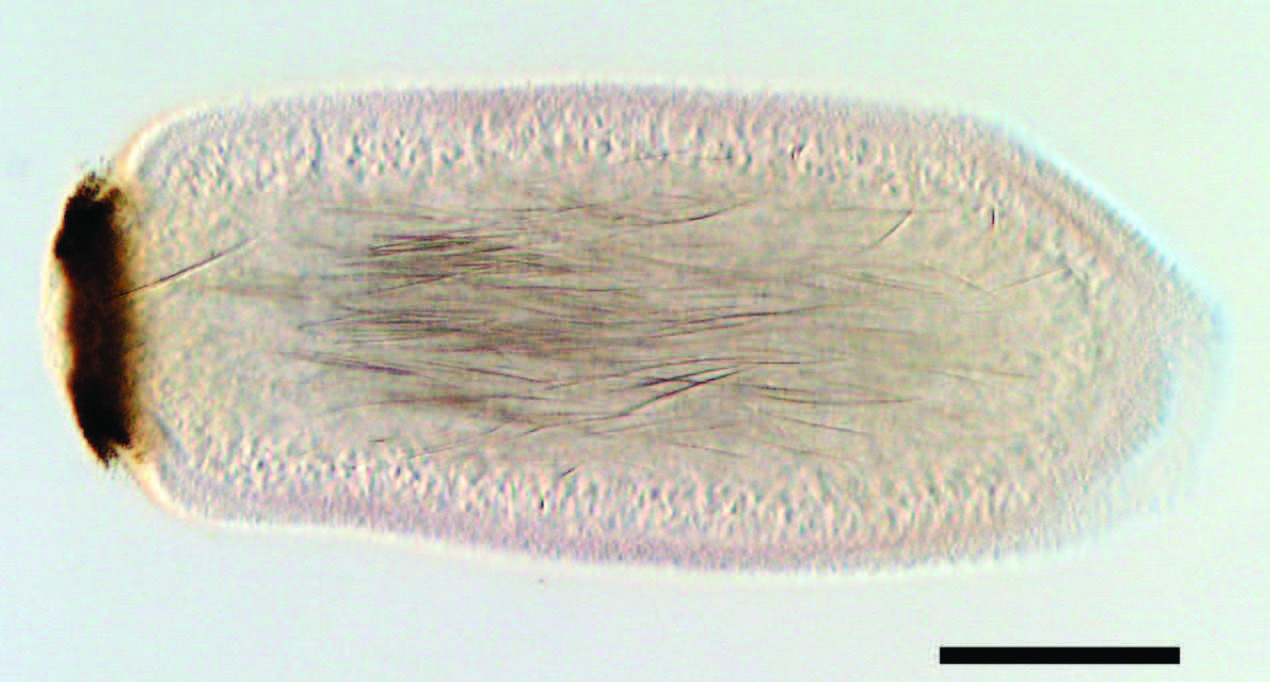
) : un cnidaire, un placozoaire et plusieurs bilatériens. Notre but était de reconstruire le génome de l’ancêtre commun des métazoaires et de définir les caractères génétiques fondamentaux des animaux. Cette reconstruction est une estimation minimale des gènes dans l’ancêtre car, pour détecter les pertes de gènes, il faudrait échantillonner plus de génomes. Toutefois, nous pouvons à présent commencer à comprendre comment la complexité et la diversité animales ont évolué. Les éponges se distinguent du reste des métazoaires par le manque de traits considérés comme fondamentaux à la condition animale. Généralement sans symétrie apparente, les éponges adultes ne possèdent ni tissu ni organe, ni neurone ni muscle, et leur système digestif n’est pas homologue à celui du reste des animaux. En revanche, pendant le développement embryonnaire, une éponge est plus évidemment animale. Le plan d’organisation de la larve parenchymella d’Amphimedon est clairement radiaire et environ onze types de cellules sont organisés en trois couches cellulaires le long de l’axe de symétrie (Figure 2) [
3].  | Figure 2
La larve parenchymella de l’éponge Amphimedon queenslandica. Cette larve choisit son lieu de fixation sur le substrat grâce à des cellules chémo- et photosensorielles aneurales, ces dernières formant un anneau pigmenté au pôle postérieur. Échelle : 200 μm. |
Dans l’article sur le génome d’Amphimedon, nous avons passé en revue du point de vue génétique les caractères nécessaires à l’état pluricellulaire : (1) le contrôle social de la division et de la croissance cellulaires et celui de la mort cellulaire programmée (apoptose), grâce auquel l’organisme garde son équilibre et lutte contre le cancer ; (2) la matrice extracellulaire et l’adhésion entre les cellules qui maintiennent la cohésion de l’animal ; (3) les mécanismes de reconnaissance du soi et du non-soi, pour la défense contre les organismes étrangers [
18] ; et (4) le développement, qui permet la division du travail entre les cellules (grâce à la différenciation cellulaire) et l’arrangement des cellules dans un plan d’organisation [
19]. La majorité des gènes responsables de ces caractères fondamentaux des animaux sont présents dans le génome d’Amphimedon et étaient donc sûrement nécessaires à l’évolution de la multicellularité [2]. Il est intéressant de constater que ces gènes essentiels à la condition animale sont très souvent associés au cancer chez l’homme. La multicellularité aurait donc évolué en parallèle avec cette maladie. Cela n’est en fait pas surprenant car le cancer est le résultat du dysfonctionnement des mécanismes de contrôle de l’état pluricellulaire [2]. |
L’évolution des gènes du développement chez les premiers animaux La majorité des innovations génétiques acquises au cours de l’évolution des animaux concernent le domaine du développement. L’analyse comparative du génome de l’éponge Amphimedon indique que la grande majorité des outils génétiques communs au processus d’embryogenèse chez les vertébrés et la drosophile, les facteurs de transcription et les voies de signalisation, avaient déjà évolué chez l’ancêtre commun à tous les métazoaires mais sous une forme plus simple. Les classes de facteurs de transcription bHLH (basic helix-loop-helix), T-box1,, Fox (forkhead box), GATA2,, bZIP (basic-region leucine zipper) et TALE (three-amino acid loop extension) précèdent l’émergence des animaux. En revanche, les classes de gènes à homéoboîtes NK, Pax (paired box), POU3,, Lhx (lim homeobox), Six (sine oculis homeobox) et paired-like ainsi que les classes Sox (Sry-related HMG [high mobility group] box), Mef2 (myocyte enhancer factor-2), Ets (E26 transformation-specific), Gli4 et les récepteurs nucléaires semblent être apparues dans la lignée menant à l’ancêtre métazoaire (Figure 1) [
4,
5]. Plus tard, une importante diversification de toutes les classes de facteurs de transcription a conduit à un ancêtre eumétazoaire avec un complément de gènes très similaire à celui de l’ancêtre bilatérien [5–
8]. Par exemple, le nombre de gènes à homéoboîtes est égal à deux chez l’ancêtre protiste des métazoaires et il serait passé à 17-20 chez l’ancêtre métazoaire puis à 59-60 chez l’ancêtre eumétazoaire et enfin à 82-83 chez l’ancêtre bilatérien. Cette diversification ne semble pas s’être faite par duplication de génome entier mais surtout par des duplications de gènes en tandem [2]. Les fameux gènes Hox ainsi que les gènes Snail et Zic semblent avoir évolué dans la lignée eumétazoaire [2,
9]. De la même manière, les voies de signalisation Wnt, TGF-β (transforming growth factor β) et Notch seraient apparues dans la lignée menant à l’ancêtre métazoaire (Figure 1). Cependant, la voie Hedgehog semble avoir été limitée chez cet ancêtre à la signalisation entre cellules voisines (comme la voie Notch) et non sur de plus longues distances comme c’est le cas chez les bilatériens actuels [
10]. Comme pour les facteurs de transcription, il y a ensuite eu une diversification des cascades dans la lignée de l’ancêtre eumétazoaire, particulièrement au niveau des ligands, des récepteurs et des répresseurs, plutôt que pendant la troisième période entre les ancêtres eumétazoaire et bilatérien [2,
11–
13]. En effet, l’ancêtre eumétazoaire possédait déjà 12 des 13 gènes Wnt qui sont partagés par les bilatériens, alors que l’éponge Amphimedon n’en a que trois. Aussi, les ligands de type Jagged/Serrate de la voie Notch et les pièges à ligand (ou antagonistes) des molécules de la famille TGF-β/BMP - chordine, follistatine et de type Cerberus/DAN/Gremlin - sont présents uniquement chez les eumétazoaires. En revanche, le répresseur nucléaire groucho qui est utilisé dans de nombreux contextes, y compris dans la cascade Wnt, est une innovation des métazoaires. |
Le développement des premiers animaux Puisqu’une approche fonctionnelle avec les gènes d’éponge était impossible, les domaines d’expression de ces gènes ont été comparés à ceux des autres métazoaires. L’objectif était d’avoir une idée de la fonction hypothétique d’un gène chez l’ancêtre métazoaire [4]. L’expression des composants des voies de signalisation a suggéré que l’on pouvait retrouver chez l’ancêtre métazoaire des rôles similaires à ceux des bilatériens. Chez Amphimedon, l’expression du ligand Hedgling (apparenté à Hedgehog) délimite l’anneau pigmentaire lorsqu’il se développe, ce qui rappelle le rôle de cette voie dans la démarcation de segments chez la drosophile et l’annélide Platynereis [10,
14]. La voie Notch, elle, comme chez les bilatériens, semble être utilisée pour donner différentes identités à deux cellules filles pendant la division cellulaire [
15]. L’inhibition chimique de la voie Wnt chez l’éponge homoscléromorphe Oscarella lobularis modifie l’organisation de l’épithélium, ce qui fait penser au rôle des voies Wnt canonique et non canonique chez les eumétazoaires [
16]. Chez Amphimedon, l’expression des ligands Wnt et TGF-β, ainsi que des autres gènes de la cascade canonique Wnt, suggère que ces deux voies de signalisation établissent la symétrie radiaire de la larve et participent à l’organisation spatiale des cellules de l’anneau pigmentaire [11,
17]. En comparant ces données avec celles obtenues pour les eumétazoaires, nous pouvons postuler que la fonction ancestrale des voies Wnt et TGF-β aurait été dans l’organisation de l’embryon selon l’axe antéro-postérieur. La voie TGF-β aurait ensuite évolué vers un rôle d’organisation selon l’axe dorso-ventral chez les eumétazoaires ; cet axe serait apparu tôt dans cette lignée puis aurait été perdu chez de nombreux cœlentérés (Figure 1). L’organisation antéro-postérieure de la larve d’Amphimedon est très simple et semble être régie uniquement par des signaux venant des deux pôles. Cela contraste de façon frappante avec l’établissement de la symétrie radiaire par les gènes Hox. Chez les bilatériens, le positionnement des cellules et des organes tout le long de l’axe résulte des domaines d’expression décalés de ces gènes. La symétrie radiaire a peut-être évolué en complexité chez les premiers animaux grâce à l’évolution des gènes Hox dans la lignée eumétazoaire (Figure 1) [9]. |
L’évolution de la complexité L’analyse du génome de l’éponge Amphimedon et l’étude de l’expression de gènes pendant son développement semblent indiquer que l’ancêtre des métazoaires, qui vivait il y a plus de 600 millions d’années, était bien plus simple que celui des eumétazoaires, en particulier du point de vue du développement (Figure 1). La multiplication du nombre des composants des cascades de signalisation chez les eumétazoaires aurait permis que ces voies soient utilisées dans de nombreux nouveaux contextes pendant l’embryogenèse. Plus généralement, la diversification de ces voies et celle des facteurs de transcription ont sûrement été accompagnées d’une complexification des réseaux génétiques et donc d’un développement plus complexe et modulable. Cela aurait permis aux animaux d’explorer de nouveaux plans d’organisation pendant l’explosion cambrienne, aboutissant finalement à la complexité et à la diversité que l’on rencontre chez les animaux actuels. |
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1.
Philippe
H
,
Derelle
R
,
Lopez
P
, et al.. Phylogenomics revives traditional views on deep animal relationships . Curr Biol.
2009; ; 19 : :706.-712. 2.
Srivastava
M
,
Simakov
O
,
Chapman
J
, et al.
The Amphimedon queenslandica genome and the evolution of animal complexity . Nature.
2010; ; 466 : :720.-727. 3.
Leys
SP
,
Degnan
BM
. Cytological basis of photoresponsive behavior in a sponge larva . Biol Bull.
2001; ; 201 : :323.-338. 4.
Larroux
C
,
Fahey
B
,
Liubicich
D
, et al.
Developmental expression of transcription factor genes in a demosponge: insights into the origin of metazoan multicellularity . Evol Dev.
2006; ; 8 : :150.-173. 5.
Larroux
C
,
Luke
GN
,
Koopman
P
, et al.
Genesis and expansion of metazoan transcription factor gene classes . Mol Biol Evol.
2008; ; 25 : :980.-996. 6.
Simionato
E
,
Ledent
V
,
Richards
GS
, et al.
Origin and diversification of the basic helix-loop-helix gene family in metazoans: insights from comparative genomics . BMC Evol Biol.
2007; ; 7 : :33.. 7.
Bridgham
JT
,
Eick
GN
,
Larroux
C
, et al.
Protein evolution by molecular tinkering: diversification of the nuclear receptor superfamily from a ligand-dependent ancestor . PLoS Biol.
2010; ; 8 : :e1000497.. 8.
Degnan
BM
,
Vervoort
M
,
Larroux
C
, et al.
Early evolution of metazoan transcription factors . Curr Opin Genet Dev.
2009; ; 19 : :591.-599. 9.
Larroux
C
,
Fahey
B
,
Degnan
SM
, et al.
The NK homeobox gene cluster predates the origin of Hox genes . Curr Biol.
2007; ; 17 : :706.-710. 10.
Adamska
M
,
Matus
DQ
,
Adamski
M
, et al.
The evolutionary origin of hedgehog proteins . Curr Biol.
2007; ; 17 : :R836.-R837. 11.
Adamska
M
,
Larroux
C
,
Adamski
M
, et al.
Structure and expression of conserved Wnt pathway components in the demosponge Amphimedon queenslandica
. Evol Dev.
2010; ; 12 : :494.-518. 12.
Richards
GS
,
Degnan
BM
. The dawn of developmental signaling in the metazoa . Cold Spring Harb Symp Quant Biol.
2009; ; 74 : :81.-90. 13.
Gazave
E
,
Labépie
P
,
Richards
GS
, et al.
Origin and evolution of the Notch signalling pathway: an overview from eukaryotic genomes . BMC Evol Biol.
2009; ; 9 : :249.. 14.
Dray
N
,
Tessmar-Raible
K
,
Le Gouar
M
, et al.
Hedgehog signaling regulates segment formation in the annelid Platynereis . Science.
2010; ; 329 : :339.-342. 15.
Richards
GS
,
Simionato
E
,
Perron
M
, et al.
Sponge genes provide new insight into the evolutionary origin of the neurogenic circuit . Curr Biol.
2008; ; 18 : :1156.-1161. 16.
Labépie
P
,
Gazave
E
,
Ereskovsky
A
, et al.
WNT/beta-catenin signalling and epithelial patterning in the homoscleromorph sponge Oscarella
. PLoS One.
2009; ; 4 : :e5823.. 17.
Adamska
M
,
Degnan
SM
,
Green
K
, et al.
Wnt and TGF-b expression in the sponge Amphimedon queenslandica and the origin of metazoan embryonic patterning . PLoS One.
2007; ; 2 : :e1031.. 18.
Du Pasquier
L
. Diversification des immuno-récepteurs au cours de l’évolution des métazoaires . Med Sci (Paris).
2009; ; 25 : :273.-280. 19.
Balavoine
G
. Un retournement de situation à l’origine des vertébrés . Med Sci (Paris).
2007; ; 23 : :1027.-1028. |