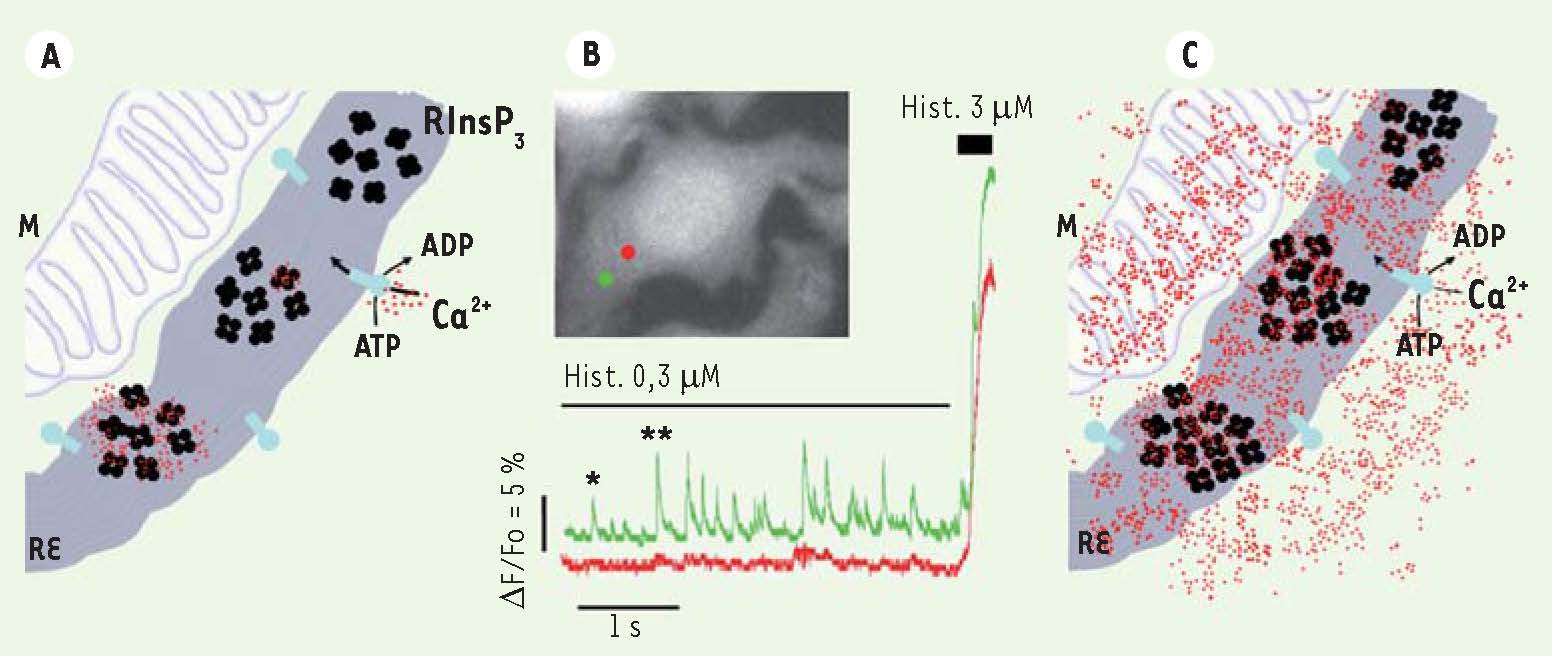
Il est maintenant bien connu que les augmentations de Ca2+ qui se propagent dans la cellule en réponse à une stimulation externe se présentent sous forme de pics répétés [2]. Ces pics, ou oscillations de Ca2+, sont principalement dus à la libération de Ca2+ depuis le réticulum endoplasmique (Figure 1). De nombreux modèles théoriques ont montré que les caractéristiques de la régulation des InsP3R, qui sont soumis à un rétrocontrôle à la fois positif et négatif par le Ca2+ (voir plus haut), sont responsables de la nature oscillatoire des signaux calciques. Ce même mécanisme fondamental s’applique à la très grande majorité des types cellulaires.
Trois types de récepteurs de l’InsP3
Les caractéristiques détaillées de ces oscillations dépendent toutefois du type cellulaire et de l’agoniste, et pour expliquer ces spécificités, il faut introduire dans ce schéma de régulation globale plusieurs éléments distinctifs. Une différence majeure est liée à l’existence de trois types d’InsP
3R [
9], qui diffèrent par leur affinité pour l’InsP
3 : le type 2 a la plus grande affinité et le type 3 la plus faible. De plus les trois types d’InsP
3R sont régulés différemment par le Ca
2+. Par exemple, le type 3 pourrait ne pas être inhibé par le Ca
2+ au moins pour des concentrations de Ca
2+ physiologiques [
10]. Ces différences sont importantes pour le décours des signaux calciques. Ainsi, des expériences dans lesquelles les niveaux d’expression des trois formes d’InsP
3R sont modifiés (surexpression ou inhibition), montrent que les proportions des trois types de récepteurs InsP
3 affectent profondément le décours des signaux calciques [
11]. Les modélisations mathématiques que nous avons réalisées rendent compte de ces observations et suggèrent que le récepteur InsP
3 de type 2, qui présente la dépendance la plus sensible au Ca
2+, est l’oscillateur principal. Autrement dit, plus une cellule exprime de récepteurs de l’InsP
3 de type 2, plus elle aura tendance à présenter des oscillations de Ca
2+. La stimulation de l’InsP
3R de type 1 induit aussi des oscillations, mais plus irrégulières et moins soutenues. L’activation du récepteur de type 3, quant à elle, tend à supprimer les oscillations. Cet effet inattendu s’explique par le comportement de l’InsP
3R de type 3, qui n’est pas inhibé par le Ca
2+, et permet une sortie constante de Ca
2+ qui va inhiber les deux autres récepteurs. Cependant, comme le montrent les simulations, cet effet ne se produit que pour de fortes densités d’InsP
3R. Au contraire, pour de faibles densités, le flux constant de Ca
2+ induit par l’ouverture de l’InsP
3R de type 3 pourrait stimuler l’activation des deux autres types de récepteurs de l’InsP
3 et favoriserait donc l’apparition des oscillations [
12].
Régulation par le Ca2+ du métabolisme de l’InsP3
Comme d’autres phénomènes oscillants, rythmes circadiens ou cycle cellulaire par exemple, les oscillations de Ca
2+ sont soumises à des mécanismes de régulation qui, sans vraiment affecter leur existence, peuvent influencer significativement leurs caractéristiques. L’effet du Ca
2+ sur le métabolisme de l’InsP
3 en est un exemple : la concentration de Ca
2+ intracellulaire peut en effet affecter à la fois la synthèse et la dégradation d’InsP
3 [
13,
14]. Cependant, alors que la stimulation par le Ca
2+ de la production d’InsP
3 est un mécanisme qui peut générer des oscillations même en l’absence de régulation de l’InsP
3R par le Ca
2+ [
15,
16], la stimulation de la dégradation d’InsP
3 par le Ca
2+ induit simplement des oscillations passives d’InsP
3 qui affectent peu les oscillations de Ca
2+ [
17]. La distinction entre ces deux types d’oscillations peut être identifiée en suivant les variations du niveau d’InsP
3 pendant les oscillations de Ca
2+. Les résultats obtenus montrent que les situations varient en fonction du type cellulaire étudié [
18]. En outre, des approches de modélisation ont établi que la réponse d’une cellule présentant des oscillations de Ca
2+ à un
pulse supplémentaire d’InsP
3 est qualitativement différente selon que les oscillations de Ca
2+ entraînent celles d’InsP
3 ou
vice-versa [
19].
Deux scénarios pour la propagation spatiale des vagues de Ca2+
Du point de vue spatial, les oscillations de Ca
2+ correspondent en réalité à des ondes qui se propagent de manière périodique dans le cytoplasme. Tout se passe comme si, à partir d’un certain niveau d’InsP
3, les augmentations locales de Ca
2+ (
blips et
puffs) devenaient suffisamment fréquentes et importantes pour envahir tout le cytoplasme sous forme de vagues, et qu’en plus, cette augmentation globale se produisait alors de manière régulière dans le temps
(Figure 2
A3 pour exemple
). La transition entre ces deux régimes - microscopique et aléatoire d’une part, et cellulaire et régulier d’autre part - observée en réponse à la simple augmentation de la stimulation cellulaire reste mal comprise par les théoriciens. Deux scénarios sont en effet possibles. Selon le premier, la transition
puffs-oscillations serait due à un processus dit de nucléation : dans cette hypothèse, étant donné la mauvaise communication entre
clusters, une vague ne peut être déclenchée que si, par hasard, plusieurs sites
puffs voisins sont actifs en même temps. L’augmentation de Ca
2+ qui en résulte est suffisamment importante pour activer de proche en proche l’ensemble des récepteurs à l’InsP
3 de la cellule. La relative régularité de ce processus d’initiation serait due au nombre élevé de sites
puffs fonctionnels (c’est-à-dire ayant lié l’InsP
3) présents dans la cellule, mais la description déterministe ne serait pas valable. En effet, la mauvaise communication entre les sites
puffs ne permet pas de décrire correctement la dynamique en termes de concentration moyenne en Ca
2+ [
20]. Selon l’autre scénario, la transition
puffs-oscillations résulterait simplement de l’augmentation du nombre de récepteurs de l’InsP
3 fonctionnels. Celle-ci améliore la communication entre les sites
puffs tandis que l’impact des fluctuations moléculaires s’amenuise car, en moyenne, les fluctuations se compensent et la dynamique calcique correspond à un comportement périodique déterministe. Cette deuxième hypothèse est corroborée par une confrontation entre résultats expérimentaux et simulations stochastiques : celle-ci montre que, dans les hépatocytes, le niveau d’irrégularité des oscillations peut être relié au nombre de récepteurs à l’InsP
3 [
21].
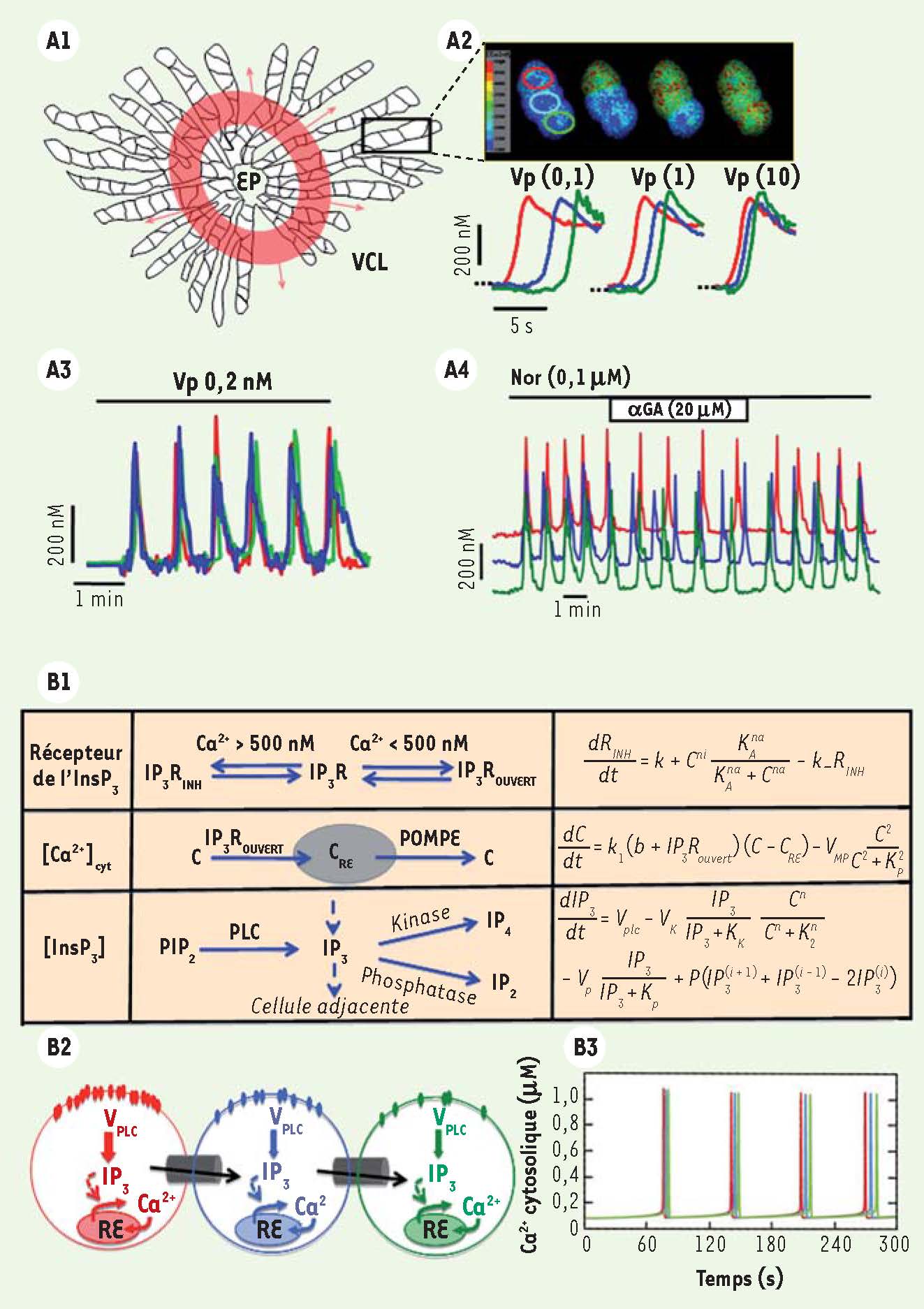
 | Figure 2
Vagues calciques. A. Vagues calciques dans le foie. La perfusion, dans des foies entiers (schématisés en A1) ou sur des triplets d’hépatocytes (A2), d’agonistes dépendants de l’InsP3 tels que la vasopressine (Vp) ou la noradrénaline (Nor) provoque des augmentations de Ca2+ séquentielles donnant l’apparence de vagues calciques intercellulaires. Dans le foie, ces vagues sont unidirectionnelles et se propagent de l’espace porte (EP) vers la veine centro-lobulaire (VCL) des lobules (A1). Les trois traces de différentes couleurs représentent les mesures de Ca2+ dans les différentes cellules d’un triplet d’hépatocytes et l’image montre les cellules avant (en bleu) et après (en vert) l’augmentation de la concentration en Ca2+
(A2). Les traces montrent que, quelle que soit la concentration de l’agoniste (ici vasopressine Vp de 0,1 à 10 nM), l’ordre de la séquence des réponses reste le même, seul le délai intercellulaire diminue. Ces vagues apparentes de Ca2+ se répètent dans le temps donnant naissance à des oscillations calciques coordonnées (A3). L’effet d’une inhibition des jonctions communicantes par de l’α-glycyrrhetinic acid (αGA, 20 µM) montre l’importance de ces jonctions pour assurer la coordination de ces oscillations calciques (A4). B. Modélisation des vagues calciques se propageant dans des fragments de travées hépatocytaires. Le modèle est fondé sur la description de la dynamique calcique intracellulaire par trois variables (fraction de récepteurs de l’InsP3 dans un état inhibé, concentration en Ca2+ cytosolique et concentration en InsP3). Les processus de régulation, transport et métabolisme dans lesquels ces variables sont impliquées sont représentés dans la colonne centrale du panneau B1 et les équations d’évolution correspondantes dans la colonne de droite. Pour modéliser la dynamique d’un triplet d’hépatocytes, trois systèmes semblables d’équations sont couplés, via le passage d’InsP3 d’une cellule à l’autre (B2). Les cellules diffèrent par leur nombre de récepteurs hormonaux, et donc par leur vitesse de synthèse d’InsP3. Le panneau B3 représente les résultats d’une simulation du modèle : la cellule qui est la plus sensible à l’hormone (rouge) présente le pic de Ca2+ en premier lieu. Les pics de Ca2+ sont ensuite émis de manière répétitive et séquentielle par les cellules adjacentes (bleue puis verte, B2), donnant l’apparence d’un processus de propagation d’onde. |
Rôle physiologique des ondes de Ca2+
Bien que les mécanismes qui engendrent les oscillations et ondes de Ca
2+ commencent à être bien connus, le rôle physiologique de ces oscillations reste beaucoup moins bien documenté. Dès leur mise en évidence, ces signaux ont été proposés comme un exemple de codage par fréquence de l’activation cellulaire ; on sait que ce type de codage est plus résistant au « bruit »
2 que le codage en amplitude [
22]. Un tel codage par fréquence pourrait impliquer la CaMKII (
Ca
2+
/calmodulin-dependent protein kinase II), une enzyme ubiquitaire dont le taux d’activité dépend de la fréquence des oscillations de Ca
2+ [
23]. Cette kinase, constituée de 10 à 12 sous-unités, possède la particularité de pouvoir s’autophosphoryler une fois qu’un nombre suffisant de monomères ont fixé le complexe Ca
2+-calmoduline. Dans cet état, la CaMKII, dite autonome, garde son activité de kinase, même en l’absence de Ca
2+. Des pics de Ca
2+ suffisamment rapprochés permettent de déclencher cette activité autonome. En revanche, un intervalle de temps trop important entre deux pics de Ca
2+ laisse au complexe Ca
2+-calmoduline le temps de se dissocier, empêchant l’autophosphorylation [
24].
Il peut y avoir d’autres avantages physiologiques à un signal oscillant de Ca2+ que le seul codage de fréquence, notamment pour éviter les effets délétères d’une augmentation soutenue de Ca2+ [
25]. Des oscillations de Ca2+ variant à la fois en amplitude, en durée et en fréquence sont ainsi capables d’activer des ovocytes non fécondés de mammifères [
26], certains profils d’augmentations calciques semblant plus efficaces que d’autres pour engager les premières divisions du développement embryonnaire [
27]. Dans d’autres cellules, par exemple les lymphocytes B, les oscillations permettent de sensibiliser les cellules à de faibles taux de stimulation [
28].
Coordination des signaux Ca2+ au niveau supracellulaire
Des observations datant de plus de 20 ans, faites dans des expériences réalisées notamment sur des foies entiers perfusés, suggèrent une organisation des signaux calciques dans l’espace et dans le temps au niveau d’un tissu entier [
29]. Plus récemment, il a été montré dans certains organes ou dans des systèmes multicellulaires que les vagues calciques intracellulaires observées dans une cellule se propageaient aux cellules adjacentes, que ces dernières soient de même type ou d’un type différent [
18]. Par exemple, dans des expériences utilisant des tranches d’hypothalamus de rat, une activité calcique spontanée et coordonnée peut être observée dans les astrocytes [
30]. Cette activité peut même se transmettre à un autre type cellulaire : la stimulation électrique de certains neurones peut induire des vagues calciques dans les astrocytes adjacents [
31]. Différents mécanismes, non exclusifs, expliquent ces observations. Citons les jonctions communicantes (
gap junctions) qui permettent la diffusion de petites molécules entre cellules connectées, et dont le rôle a été très bien étudié [
18]. Dans la plupart des cas, les vagues intercellulaires résultent de la diffusion d’InsP
3 d’une cellule à une autre. Certaines observations suggèrent que d’autres messagers intracellulaires tels que l’ADP ribose ou le Ca
2+, pourraient participer à ces vagues calciques [
18]. Quel que soit le messager, les vagues intercellulaires qui ne sont portées que par leur diffusion au travers des jonctions communicantes sont limitées dans le temps et dans l’espace, ne se propageant qu’à quelques cellules adjacentes. Dans les tissus, qui comportent un nombre beaucoup plus élevé de cellules, un mécanisme de régénération de ces vagues est nécessaire pour permettre leur propagation. Le plus commun fait intervenir la voie de synthèse de l’InsP
3 (voir ci-dessus),
via la libération dans le milieu extracellulaire de molécules capables d’activer cette voie de signalisation. En fonction des types cellulaires étudiés, l’ATP, le glutamate ou encore le monoxyde d’azote (NO) sont ainsi les molécules le plus souvent impliquées dans la propagation des vagues calciques intercellulaires [
18]. En fait, des études réalisées sur des cellules en culture montrent que des voies paracrines et directes (jonctions communicantes) s’associent pour assurer la propagation des signaux calciques intercellulaires. C’est sans doute aussi le cas
in vivo, bien qu’il soit difficile de l’étudier.
L’importance relative de ces deux voies peut varier en fonction des situations physiologiques. Le foie nous en offre un exemple remarquable. Dans le foie normal, la perfusion d’agonistes dépendants du Ca2+, vasopressine ou noradrénaline, provoque des vagues de Ca2+ répétitives qui se propagent de façon synchronisée aux différents lobules constitutifs du foie [
32]. Des expériences réalisées sur des fragments de travées hépatocytaires, dans lesquels les hépatocytes restent connectés par leurs jonctions communicantes, montrent que ces vagues de Ca2+ ne sont qu’apparentes et résultent d’un léger décalage de phase d’oscillations dont les fréquences sont très proches (Figure 2A). Ce décalage de phase est dû à un gradient de récepteurs de la vasopressine ou de la noradrénaline le long des travées d’hépatocytes, lui-même responsable d’un gradient de vitesses d’activation de la phospholipase C (PLC) (Figure 2B). Les vitesses de synthèse d’InsP3 sont donc légèrement différentes d’une cellule à l’autre [32,
33]. En conséquence, les pics d’InsP3, et donc de Ca2+, apparaissent séquentiellement le long des travées. La coordination de ces oscillations est quant à elle assurée par la diffusion de faibles quantités d’InsP3 à travers les jonctions communicantes [
34]. Cette quantité de messagers n’est cependant pas suffisante à elle seule pour déclencher des réponses en Ca2+ [34,
35]. Un modèle fondé sur ces observations nous a permis de formaliser ces hypothèses (Figure 2B) et de faire certaines prédictions qui ont pu être vérifiées expérimentalement [33]. Le modèle décrit simplement les évolutions temporelles du Ca2+, de l’InsP3 et de la fraction de récepteurs de l’InsP3 qui sont dans un état inactif (car inhibés par des taux élevés de Ca2+ cytosolique). Le passage d’InsP3 à travers les jonctions communicantes y est également décrit, la perméabilité de ces dernières apparaissant dès lors comme un paramètre-clé du modèle [33].
Un exemple d’implications physiologiques : signaux Ca2+ et fonction hépatique
L’ensemble de ces résultats nous a permis de proposer un modèle d’organisation spatiotemporelle du signal Ca
2+ dans le foie qui pourrait être important pour certaines des fonctions majeures de cet organe. Dès le début des années 1990, le groupe de Jungermann montrait que l’inhibition des jonctions communicantes inhibait la libération de glucose induite par une stimulation des nerfs sympathiques [
36]. Ces résultats ont été confirmés en utilisant des souris n’exprimant pas la connexine 32, majoritaire dans les hépatocytes [
18]. La communication intercellulaire assurée par les jonctions communicantes est aussi impliquée dans la sécrétion biliaire régulée par les agonistes dépendant du Ca
2+. Dans ce cas, l’importance de la vague unidirectionnelle de Ca
2+ a aussi pu être mise en évidence : la suppression du gradient de sensibilité à la vasopressine, qui entraîne l’abolition du caractère séquentiel des réponses calciques, inhibe le flux biliaire stimulé par cet agoniste [
32].
Un aspect fascinant du foie est sa capacité à se régénérer après une destruction partielle. Étant donné le rôle du Ca2+ dans la régulation de la transcription des gènes et du cycle cellulaire, il n’est pas étonnant que la signalisation calcique joue là aussi un rôle majeur. Les expériences d’hépatectomie partielle chez le rat indiquent que de nombreuses molécules capables de provoquer des augmentations de Ca2+ sont libérées (notamment l’ATP [
37]) et induisent ainsi la propagation de vagues calciques dans le foie. Il existe en outre une profonde réorganisation des signaux calciques intra- et intercellulaires au cours de la régénération hépatique [32]. Vingt-quatre heures après hépatectomie partielle, il y a une désensibilisation de la signalisation calcique dans les hépatocytes qui résulte notamment d’une modification de l’expression des récepteurs de l’InsP3 [
38,
39]. Avant l’intervention, les hépatocytes expriment les récepteurs de l’InsP3 de type 1 et 2 (environ 30 % et 70 % respectivement). Vingt-quatre heures après hépatectomie partielle, le nombre total de récepteurs de l’InsP3 diminue très fortement et la proportion relative des récepteurs de type 1 et 2 s’équilibre. Parallèlement on observe une modification de la forme des oscillations de Ca2+ induites par les agonistes dépendants de l’InsP3, notamment la vasopressine [39]. Récemment, en interférant directement avec la signalisation du Ca2+ intracellulaire, nous avons pu confirmer l’importance des variations de Ca2+ cytosolique pour le processus de régénération du foie. On observe ainsi, une heure après hépatectomie partielle, une diminution de l’induction du gène précoce c-fos et un défaut de phosphorylation d’ERK1/2 (extracellular signal-regulated kinase) lorsque le Ca2+ cytosolique est chélaté. L’ensemble des résultats obtenus montre que, dans les hépatocytes, le Ca2+ cytosolique joue un rôle positif dans les phases précoces du cycle cellulaire, notamment lors de la transition G0/G1 et de la progression vers la phase S [
40]. À ce stade, on peut à nouveau s’attendre à ce qu’une approche de modélisation, fondée sur une description couplée des oscillations de Ca2+ et du cycle cellulaire, favorise une compréhension globale et quantitative de ce phénomène fascinant.
Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.