| |
| Med Sci (Paris). 2011 February; 27(2): 199–203. Published online 2011 March 8. doi: 10.1051/medsci/2011272199.Imagerie et cognition (2) - Retrouver le contenu de la conscience dans le « bruit » de la neuro-imagerie Andreas Kleinschmidt1* 1Inserm U992, Unité de neuro-imagerie cognitive, NeuroSpin, I2BM, DSV, CEA, 91191 Gif-sur-Yvette Cedex, France |
On pourrait comparer l’approche classique de la neurophysiologie à celle de quelqu’un qui, pour comprendre la mer, lance une pierre dans l’eau. Dans le regard traditionnel, le paramètre ciblé est la réponse, le splash produit par la pierre tombant dans l’eau, dont on estime l’amplitude et détermine la localisation en fonction des pierres et de la façon choisie pour les lancer. En neuro-imagerie fonctionnelle du cerveau cette approche behavioriste se traduit par l’application du modèle linéaire général. Ce modèle repose sur l’idée que les observations empiriques sont déterminées par la somme d’un effet (le splash de la pierre dans l’eau) de la condition expérimentale (la pierre lancée) et d’une constante de bruit, qui dans notre métaphore serait liée au niveau de l’eau ainsi qu’aux imperfections de nos outils d’observation. En appliquant ce modèle on estime quelle taille d’effet expérimental peut le mieux expliquer les données recueillies [
1]. Parce que les données de neuro-imagerie ont un faible rapport contraste sur bruit, une manipulation expérimentale est en général répétée de nombreuses fois afin d’obtenir une réponse significative. Imaginons dans notre métaphore que l’on soit au bord de la mer et qu’à cause des vagues il soit difficile de voir avec un seul essai l’effet d’une pierre lancée. On pourrait donc relancer des pierres, idéalement identiques, et prendre une photo à chaque fois. En superposant ces images, on arriverait sans doute à identifier la magnitude de l’impact induit par les pierres lancées. En même temps, l’image de la mer deviendrait floue ou donnerait la fausse impression d’une surface lisse. On se retrouverait dans la situation d’avoir appris plus sur les pierres que sur la mer. Un problème voisin, plus spécifique à la neuro-imagerie, vient du fait que l’activité du cerveau entier peut être enregistrée et que les tranches d’images obtenues contiennent beaucoup d’éléments appelés voxels (pour volumetric pixels). L’analyse univariée décrite ci-dessus se fait voxel par voxel et se trouve ainsi noyée dans un problème de comparaisons multiples. Il existe plusieurs approches pour réduire ce problème et ces approches ont en commun qu’elles réduisent (par lissage) ou effacent (en moyennant les valeurs dans une région dite d’intérêt) la structure spatiale fine des réponses induites. Pour revenir à notre métaphore, une pierre lancée à l’eau induit non seulement un splash mais également une réponse spatiale d’ondulations qui est finement structurée, et perdue lorsqu’on ne préserve pas une résolution spatiale suffisante et ne regarde que l’amplitude maximale de l’effet. La caractéristique commune de ces deux pratiques - moyennage dans le temps et dans l’espace - est de négliger une variance dans les données qui est considérée comme du « bruit », c’est-à-dire non informative par rapport au paradigme expérimental étudié, et donc qui ne nécessite pas d′être expliquée. Il a été démontré, ces dernières années, que la variance spatiale et temporelle des modulations de l’activité neuronale observée lors de l’activité mentale contient des informations qui permettent de décoder et même de prédire le contenu de l’activité mentale plus finement qu′il n′est possible de le faire par les approches traditionnelles [
2,
3]. Les sources de la variance spatiale et de la variance temporelle sont fondamentalement différentes, et c’est pour cela qu’elles fournissent des informations différentes et complémentaires sur l’activité mentale. Il suffit de ne pas effacer ces deux types de variabilité pour accéder à ces informations. Autrement dit, on peut analyser la variabilité de la réponse des voxels individuels dans une région qui globalement se montre activée par le stimulus au lieu de lisser les images ou de moyenner les réponses à partir des voxels de cette région. La variance spatiale permet ainsi de décoder un aspect plutôt statique de l’activité mentale qui est l’organisation et le format des représentations cognitives. La variabilité entre essais peut également être analysée sans les moyenner et sans normaliser le niveau de la ligne de base. Cette dernière approche fournit l’historique de l’activité neuronale qui permet de considérer l’insertion des réponses évoquées dans un décours spontané de l’activité intrinsèque du cerveau. La variance temporelle nous ouvre donc une porte vers les caractéristiques dynamiques de la pensée et la conscience. |
Décoder l’information contenue dans la structure spatiale fine des réponses évoquées Considérons d’abord la variance spatiale. L’organisation fonctionnelle du cerveau exprime des structures spatiales à plusieurs échelles. Des critères anatomiques permettent de distinguer des aires corticales d’une superficie de plusieurs cm2 et nous pensons que leur fonction les différencie également. Il a été démontré, au moins pour plusieurs des aires macroscopiques du système visuel précoce, qu’une architecture fonctionnelle à l’échelle mésoscopique peut être retrouvée au sein de ces structures. Les simulations neurocomputationelles provenant du domaine de la neuro-anatomie théorique nous conduisent à soupçonner qu’une telle organisation mésoscopique pourrait être un principe général de l′organisation fonctionnelle cérébrale car elle permet de lier des avantages de la ségrégation à ceux de l’intégration en évitant les inconvénients de chacun de ces modes d′organisation [
4]. Or, jusqu’à il y a peu de temps, la visualisation d’une telle architecture fonctionnelle chez l’homme semblait hors de la portée de la neuro-imagerie non invasive fonctionnelle. Après quelques études pionnières qui montraient de façon plus ou moins convaincante des colonnes de dominance oculaire dans le cortex visuel primaire chez l’homme en imagerie par résonance magnétique fonctionnelle (IRMf), il y a eu une longue période de silence qui a heureusement débouché sur le développement des approches multivariées de l’analyse des données, et sur la démonstration de la sélectivité à l’orientation des stimulus visuels des sous-populations neuronales du cortex visuel primaire [
5–
7]. Depuis, ces approches ont fleuri mais il ne faut en aucun cas confondre le résultat d’un tel décodage avec une cartographie d’une architecture fonctionnelle. Il s’agit plutôt d’un premier pas exploratoire visant à déterminer si les réponses évoquées d’une région d’intérêt ou d’une aire corticale contiennent de l’information relative à des caractéristiques cibles d’un stimulus extérieur [
8]. Il n’est pas encore clair que la détection d’une telle information indique forcément la présence d’une architecture fonctionnelle, c’est-à-dire une organisation spatiale qui représente de façon systématique ces caractéristiques dans une topographie neuronale. De plus, la plupart des résultats - bien qu’ils soient souvent impressionnants sur le plan purement méthodologique - n’ont pas, pour l’instant, beaucoup fait avancer notre savoir neurobiologique sur le cerveau humain. En effet les études ont été limitées aux systèmes où une telle topographie est largement connue sur la base des expérimentations animales. Nous avons récemment tenté ce premier pas exploratoire sur le terrain peu connu de la représentation neuronale des nombres. |
À la recherche d’une « numérotopie » On peut considérer des nombres comme des exemplaires individuels appartenant à une catégorie sémantique abstraite finie [
9]. Des études chez le singe éveillé ont démontré l’existence de neurones dans plusieurs régions du cortex qui expriment par leur taux de décharges une préférence pour une quantité donnée. Mais ces enregistrements unitaires n’ont pas permis d’identifier une organisation spatiale en fonction des valeurs numériques. La neuro-imagerie chez l’homme a fourni beaucoup d’indices indirects qui suggèrent un codage de la quantité numérique par des populations neurales du cortex intra-pariétal. En général, l’approche indirecte repose sur un effet d’adaptation, c’est-à-dire une diminution progressive des réponses que l’on peut observer lorsqu’un même stimulus est répété successivement [
10]. La réponse évoquée à la suite de l’adaptation par un autre stimulus est proportionnelle à la différence entre le stimulus adapté et le stimulus test. Cette technique est devenue importante parce qu’elle permet de définir quelle propriété d’un stimulus donné est représentée dans la réponse neuronale. Nous avons par exemple pu démontrer que l’adaptation des réponses d’une aire corticale aux images d’un visage donné persiste si l’on présente une autre image, à condition que cette image montre le visage de la même personne. Cette observation a permis d’établir quelle partie du cerveau code l’identité des visages d’une façon qui ne dépend plus du stimulus précis portant l’information d’identité [
11]. De façon comparable, les réponses du cortex intrapariétal aux nombres répétés montrent une adaptation à la répétition, et la réponse évoquée par un autre nombre à la suite exprime la distance numérique du nombre « adapté », sans pour autant indiquer si elle est plus grande ou plus petite [
12]. Pour obtenir une réponse plus directement liée à la représentation d’un nombre, nous avons appliqué la neuro-imagerie fonctionnelle à haute résolution spatiale dans une expérience dans laquelle les sujets gardaient en mémoire de travail un nombre, par exemple le nombre de points dans un nuage qui leur était présenté, pour ensuite le comparer à un nombre de points cible (Figure 1) [
13]. Dans un premier temps nous pouvons appliquer l’analyse multivariée dans une petite sphère d’un diamètre de 6 voxels et la déplacer voxel par voxel à travers tout le volume enregistré (Figure 1). À chaque endroit, nous entraînons, à l’aide d’un ordinateur, un algorithme dit « classificateur » qui cherche à apprendre comment distinguer au mieux deux conditions grâce aux variations de signal observées à travers des voxels contenus dans la petite population recouverte par la sphère. L’efficacité de ce décodage peut être évaluée par la précision de l’algorithme appris lorsqu’on la teste avec un jeu de données qui n’a pas contribué à l’apprentissage. Ensuite, nous pouvons projeter ces variations de précision en fonction de la position de la sphère, et la carte ainsi obtenue indique la distribution spatiale de l’information à travers les conditions expérimentales [
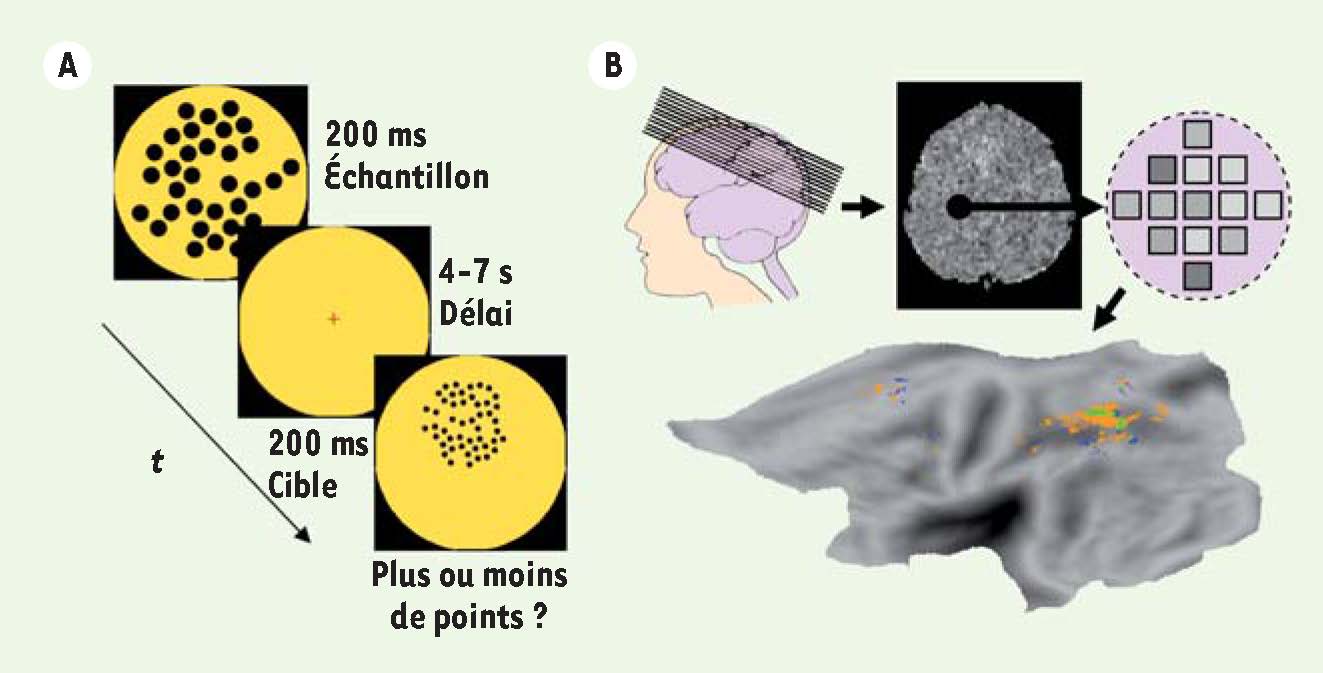
14]. Cette analyse a confirmé le rôle important du cortex intrapariétal dans le codage des nombres.  | Figure 1
Paradigme expérimental utilisé pour décoder les nombres. A. Les sujets voient brièvement un nuage de points. Après un délai variable de plusieurs secondes un deuxième nuage est montré et les sujets indiquent quelle image contenait un plus grand nombre de points. À la suite de la première image leur mémoire de travail contient donc un nombre donné. B. Schéma indiquant l’acquisition des images recouvrant une partie du cerveau. Pour l’analyse, les algorithmes de classification sont entraînés à décoder quelle condition expérimentale était présente lors de l’acquisition de ces images. Cette analyse peut se faire au sein d’une petite sphère qui est déplacée systématiquement pour recouvrir pas à pas le volume entier des images. À la suite, on peut indiquer par code couleur les régions qui ont permis un décodage des nombres (ici représenté sur une image aplatie de l’hémisphère gauche) (pour plus de détails, voir [ 13]). |
Nous avons ensuite conduit nos analyses sur une région du cortex intrapariétal. Les variations dans les réponses entre les voxels de cette région nous ont permis de décoder avec une bonne précision quel nombre un sujet avait en tête au moment où l’image était acquise. Cette distinction entre les deux nombres d’une paire pour laquelle un classificateur était entraîné devenait d′autant plus précise que la distance numérique entre les deux nombres comparés était grande. Nous avons pu montrer que cette approche restait possible avec des nombres symboliques, c’est-à-dire des chiffres arabes. Finalement, nous avons pu démontrer que si on entraîne un classificateur sur des échantillons de données acquises lors de la présentation des nombres symboliques, il peut à la suite distinguer les données acquises lors d’une présentation de nombres non symboliques, ou quantités (mais pas l’inverse). Ces résultats sont cohérents avec la littérature expérimentale mais aussi avec des modèles cognitifs qui impliquent un traitement et des représentations similaires mais non identiques des nombres symboliques (chiffres arabes ou mots) et non symboliques. La démonstration que les signaux de neuro-imagerie évoqués par des nombres contiennent à une échelle spatiale fine l’information sur le nombre précis devrait encourager de futures études à la recherche d’une « numérotopie » corticale. Il s’agirait de démontrer une représentation topographique et organisée de l’espace des nombres ou quantités, similaire aux représentations qui existent dans d’autres aires corticales comme rétinotopie pour le champ visuel et comme somatotopie pour la surface du corps et ses mouvements. Dans ce contexte, il sera particulièrement intéressant d’approfondir notre connaissance des liens neuronaux entre la représentation de l’espace et de la quantité [
15]. |
Démontrer le rôle-clé de l’activité spontanée dans la perception consciente Les analyses décrites ci-dessus sont novatrices dans la mesure où elles exploitent une variabilité spatiale qui jusque là était considérée comme du bruit. Mais elles restent classiques car elles ciblent une réponse évoquée par une stimulation sensorielle. Au travers de nombreuses répétitions d’un stimulus donné, la réponse évoquée varie énormément et d’une façon qui semble non systématique. Il est habituel de considérer un moyennage des essais pour fournir une image de la « vraie » réponse mais on pourrait tout aussi bien concevoir des liens entre la variabilité neuronale et la variabilité comportementale qui elle aussi varie d’un essai à l′autre. Étant donné les fluctuations de l’activité neuronale de fond, c’est-à-dire en absence d’une stimulation ou d’un contexte fonctionnel explicite, on pourrait imaginer que les différences de réponses évoquées traduisent les différences de cette activité de fond essai par essai. Des observations en faveur de cette hypothèse ont été faites chez l’animal anesthésié par enregistrement électrophysiologique et imagerie optique [
16]. L’activité au pic de la réponse évoquée par le stimulus est apparue étroitement liée à la somme du niveau d’activité juste avant la stimulation et de la réponse moyenne, quel que soit le niveau de l’activité de fond dans chaque essai. Ce comportement additif suggère un système linéaire mais ne clarifie pas la signification fonctionnelle des fluctuations de l’activité de fond et des réponses évoquées. Pour répondre à cette question, nous avons mené une série d’expérimentations en neuro-imagerie fonctionnelle chez l’homme éveillé. Comme dans l’expérience décrite ci-dessus, nous avons exposé nos sujets à la répétition d’un seul stimulus à des intervalles longs et irréguliers. Pour les besoins de la démonstration ce stimulus était ambigu, permettant deux perceptions. Dans une première expérience, nous avons utilisé la fameuse ambiguïté entre un vase et deux visages de profil [
17], dans une autre nous avons déterminé sujet par sujet le seuil de détection d’une cohérence de mouvement perçue dans un nuage de points qui pour la plupart se déplacent dans une direction aléatoire [
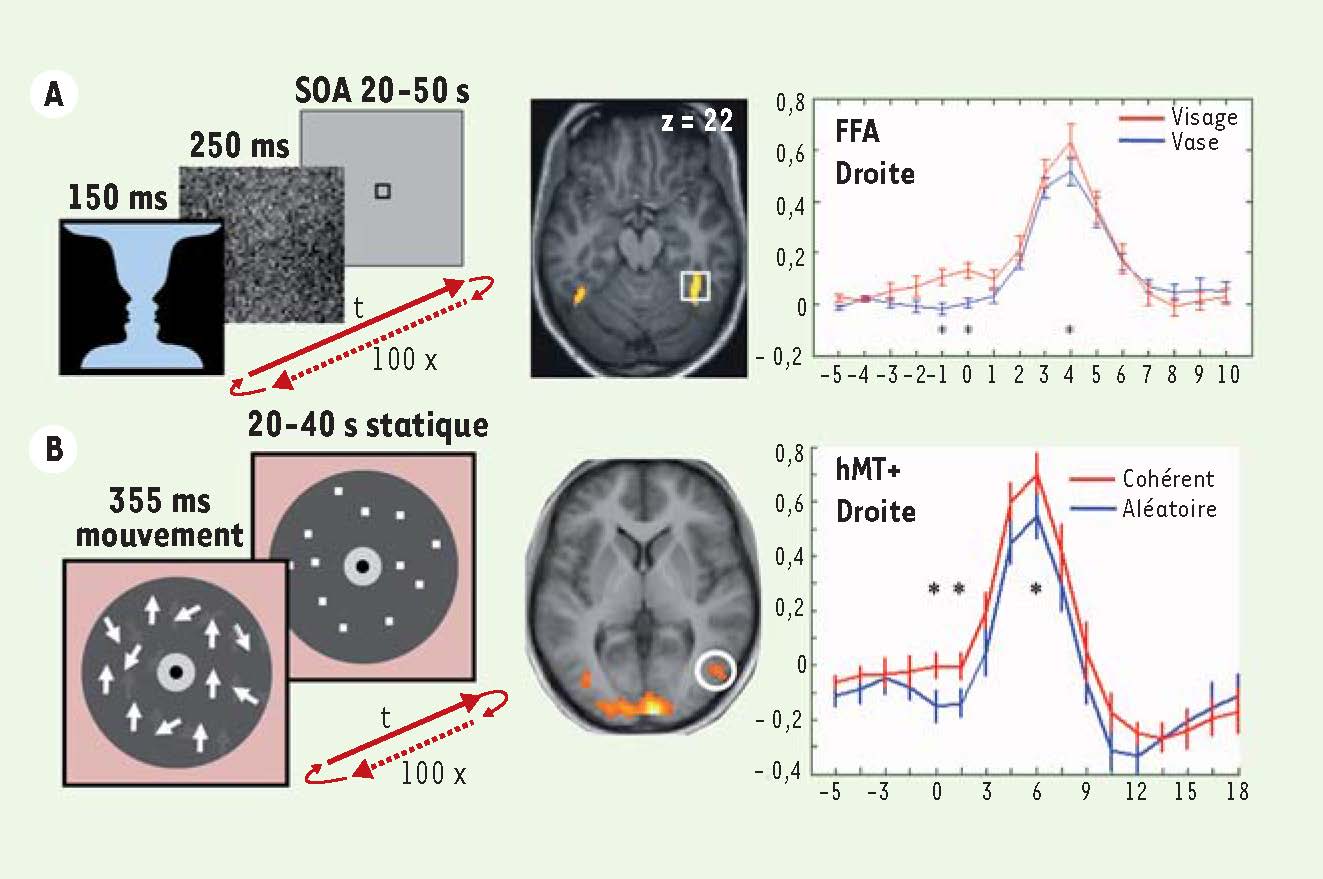
18]. Ainsi, nous avons pu obtenir des essais en nombre équivalent pour lesquels les sujets percevaient le vase ou les visages, ou dans l’autre expérience, un mouvement aléatoire des points ou une direction cohérente de mouvement. À la suite nous avons trié nos essais en fonction de la perception des sujets mais sans enlever, comme le font la plupart des études, les fluctuations de l’activité de fond (Figure 2).  | Figure 2
Deux expérimentations en neuroimagerie avec 100 répétitions d’un stimulus ambigu pour une courte durée à intervalles longs et irréguliers. Les sujets indiquent essai par essai s’ils ont perçu le vase ou les visages (A) ou un mouvement des points avec une prédominance d’une seule direction (cohérent) ou avec des directions aléatoires à travers des points individuels (SOA : stimulus onset asynchrony). (B) Les décours temporels des signaux de l’IRMf provenant des régions d’intérêt (images au centre) qui ont été définies indépendamment grâce à leur sensibilité aux visages ( A, carré blanc, dénommé FFA) ou au mouvement visuel cohérent ( B, cercle blanc, aire appelée hMT+) sont démontrés à droite en fonction de la perception : rouge pour les essais avec visage (A) ou mouvement cohérent (B) perçu, et bleu pour les essais avec vase (A) ou mouvement aléatoire (B) perçu. Le temps est indiqué en nombre d’images ( A, éq. 1,5 s) ou secondes (B). On note que la perception d’un même stimulus ambigu est prédite par une variation de l’activité de fond qui précède la réponse au stimulus (qui elle aussi dépend de la perception). Pour plus de détails voir les références [ 17, 18]. |
Le choix de ces paradigmes traduisait notre hypothèse que la perception pourrait corréler dans le premier cas avec la réponse d’une région spécialisée pour le traitement des visages dans le gyrus fusiforme, habituellement nommé l’aire fusiforme des visages (fusiform face area ou FFA), et dans le second cas avec la réponse d’une région spécialisée pour le mouvement visuel cohérent à la jonction occipito-temporale (hMT+). Nous avons à chaque fois confirmé que, pour le même stimulus, les essais donnant lieu à la perception d’un visage ou d’un mouvement cohérent s’accompagnent d’une réponse plus forte dans la région en question (FFA ou hMT+). Mais le but de nos expériences était d’étudier si la perception était influencée par l’activité de fond juste avant la réponse au stimulus. Nous avons constaté dans la première expérience que le signal était plus élevé dans la FFA droite avant les essais qui aboutissaient à la perception d’un visage par rapport à celle d’un vase. De façon équivalente, dans la deuxième expérience, le signal était plus élevé dans la région hMT+ droite avant la perception d’un mouvement cohérent par rapport à celle d’un mouvement aléatoire. Ces études montrent donc que le niveau d’activité spontanée dans une région spécialisée interfère avec le traitement d’un stimulus approprié dans cette même région. Nous avons ensuite déterminé si l’activité lors de la réponse peut être expliquée par le niveau d’activité de fond précédent, essai par essai. À l′inverse des résultats chez l’animal anesthésié décrits dans la première partie de ce chapitre, nous n’avons pas trouvé une telle corrélation. De plus, la force de la corrélation entre activité de fond et activité évoquée dépendait de la nature du percept, vase ou visage, ou bien mouvement cohérent ou aléatoire, suggérant un processus non linéaire. Nos résultats sont néanmoins compatibles avec des modèles actuels des processus neuronaux sous-tendant la prise de décision perceptive. Ces modèles postulent au moins deux sources de variabilité entre essais, une source liée à la pente d’une accumulation d’évidence sensorielle qui amène vers un seuil de décision en faveur d’une conclusion donnée (par exemple, perception de visages) et une autre liée aux fluctuations d’une valeur initiale dans le système avant même le commencement du traitement par le stimulus [
19]. Il est intéressant de constater que jusqu’ici la manipulation d’une prise de décision par application focalisée d’un courant électrique n’a jamais montré un effet précédant le traitement sensoriel dans une région donnée. Nous interprétons cette observation dans le sens que l’activité de fond représente bien plus qu’un niveau d’excitabilité et possède une structure plus fine et physiologique qui ne peut pas être facilement induite de l’extérieur. Nous émettons actuellement l’hypothèse qu’il s’agit ici d’une trace d’une comparaison que le cerveau effectue en continu, entre ses prédictions et l’information réelle reçue par ses interfaces avec le monde. Un tel modèle parti de la vision behavioriste du cerveau aboutit finalement à permettre de voir le cerveau comme un organe actif qui construit, par ses représentations cognitives et parce qu’il est revisité en permanence par ses prédictions, un modèle du monde qu’il habite pour mieux y agir et survivre [
20]. |
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Friston
KJ
. Models of brain function in neuroimaging . Annu Rev Psychol.
2005; ; 56 : :57.-87. 2.
Haynes
JD
,
Rees
G
. Decoding mental states from brain activity in humans . Nat Rev Neurosci.
2006; ; 7 : :523.-534. 3.
Fox
MD
,
Raichle
ME
. Spontaneous fluctuations in brain activity observed with functional magnetic resonance imaging . Nat Rev Neurosci.
2007; ; 8 : :700.-711. 4.
Tononi
G
,
Sporns
O
,
Edelman
GM
. A measure for brain complexity: relating functional segregation and integration in the nervous system . Proc Natl Acad Sci USA.
1994; ; 91 : :5033.-5037. 5.
Kamitani
Y
,
Tong
F
. Decoding the visual and subjective contents of the human brain . Nat Neurosci.
2005; ; 8 : :679.-685. 6.
Haynes
JD
,
Rees
G
. Predicting the orientation of invisible stimuli from activity in human primary visual cortex . Nat Neurosci.
2005; ; 8 : :686.-691. 7.
Rochefort
N
. Organisation dendritique et caractéristiques fonctionnelles des afférences visuelles sur les neurones corticaux . Med Sci (Paris).
2010; ; 26 : :1009.-1012. 8.
Kleinschmidt
A
. Different analysis solutions for different spatial resolutions? Moving towards a mesoscopic mapping of functional architecture in the human brain . Neuroimage.
2007; ; 38 : :663.-665. 9.
Nieder
A
,
Dehaene
S
. Representation of number in the brain . Annu Rev Neurosci.
2009; ; 32 : :185.-208. 10.
Grill-Spector
K
,
Henson
R
,
Martin
A
. Repetition and the brain: neural models of stimulus-specific effects . Trends Cogn Sci.
2006; ; 10 : :14.-23. 11.
Eger
E
,
Schyns
PG
,
Kleinschmidt
A
. Scale-invariant adaptation in fusiform face-responsive regions . Neuroimage.
2004; ; 22 : :232.-242. 12.
Piazza
M
,
Izard
V
,
Pinel
P
, et al.
Tuning curves for approximate numerosity in the human intraparietal sulcus . Neuron.
2004; ; 44 : :547.-555. 13.
Eger
E
,
Michel
V
,
Thirion
B
, et al.
Deciphering cortical number coding from human brain activity patterns . Curr Biol.
2009; ; 19 : :1608.-1615. 14.
Kriegeskorte
N
,
Goebel
R
,
Bandettini
P
. Information-based functional brain mapping . Proc Natl Acad Sci USA.
2006; ; 103 : :3863.-3868. 15.
Hubbard
EM
,
Piazza
M
,
Pinel
P
,
Dehaene
S
. Interactions between number and space in parietal cortex . Nat Rev Neurosci.
2005; ; 6 : :435.-448. 16.
Arieli
A
,
Sterkin
A
,
Grinvald
A
,
Aertsen
A
. Dynamics of ongoing activity: explanation of the large variability in evoked cortical responses . Science.
1996; ; 273 : :1868.-1871. 17.
Hesselmann
G
,
Kell
CA
,
Eger
E
,
Kleinschmidt
A
. Spontaneous local variations in ongoing neural activity bias perceptual decisions . Proc Natl Acad Sci USA.
2008; ; 105 : :10984.-10989. 18.
Hesselmann
G
,
Kell
CA
,
Kleinschmidt
A
. Ongoing activity fluctuations in hMT+ bias the perception of coherent visual motion . J Neurosci.
2008; ; 28 : :14481.-14485. 19.
Philiastides
MG
,
Ratcliff
R
,
Sajda
P
. Neural representation of task difficulty and decision making during perceptual categorization: a timing diagram . J Neurosci.
2006; ; 26 : :8965.-8975. 20.
Sadaghiani
S
,
Hesselmann
G
,
Friston
KJ
,
Kleinschmidt
A
. The relation of ongoing brain activity, evoked neural responses, and cognition . Front Syst Neurosci.
2010; ; 4 : :20.. |