| |
| Med Sci (Paris). 2011 March; 27(3): 261–267. Published online 2011 March 30. doi: 10.1051/medsci/2011273261.La biologie des cellules souchesmésenchymateuses d’origine humaine Pierre Charbord1* and Louis Casteilla2 1Inserm U972, bâtiment Gregory Pincus, hôpital de Bicêtre, 80, avenue du Général Leclerc, 94276 Le Kremlin Bicêtre Cedex, France; Université Paris 11 2UPS/CNRS 5241; Université de Toulouse, France |
Cellules souches mésenchymateuses, cellules souches dérivées du tissu adipeux, et autres : définition, obtention et commentaires Les CSM de la moelle osseuse Les cellules souches mésenchymateuses (CSM) de la moelle osseuse ont été identifiées par Alexandre Friedenstein qui décrivit, dans les années 1960, des cellules immatures de la moelle osseuse de souris capables de développer, après implantation sous la capsule rénale, du tissu fibreux, de l’os, et de l’os plus de la moelle osseuse [
1]. L’utilisation de souris chimériques lui permit de montrer que les cellules du tissu fibreux et de l’os provenaient du donneur, tandis que les cellules hématopoïétiques de la moelle provenaient du receveur, indiquant ainsi que certains des précurseurs mésenchymateux avaient une fonction stromale de soutien de l’hématopoïèse. D’autres investigateurs ont confirmé l’existence de précurseurs mésenchymateux capables de se différencier non seulement en ostéoblastes (O), mais également en chondrocytes (C) et en adipocytes (A). Il est convenu de les nommer cellules souches mésenchymateuses. Nous discuterons plus loin les critères qui justifient, ou non, cette qualification. Les CSM sont obtenues chez l’homme par un procédé très simple. Après ponction médullaire, les cellules sont mises en suspension et ensemencées dans des boîtes de culture dans un milieu liquide additionné de sérum (humain ou bovin), sélectionné pour obtenir la croissance optimale des cellules adhérentes, en présence ou non de 1-2 ng/mL de FGF2 (fibroblast growth factor 2). L’élimination de l’ensemble des cellules non adhérentes s’effectue vers le deuxième jour. Les cellules prolifèrent jusqu’à la confluence, observée vers J20 (Figure 1). Si l’ensemencement initial est fait à faible densité, des clones indépendants issus d’une seule cellule appelée CFU-F (colony-forming unit fibroblast) sont détectables. Les CFU-F représentent une très faible proportion (0,1 à 0,001 %) des cellules nucléées de la moelle osseuse [
2,
3].  | Figure 1
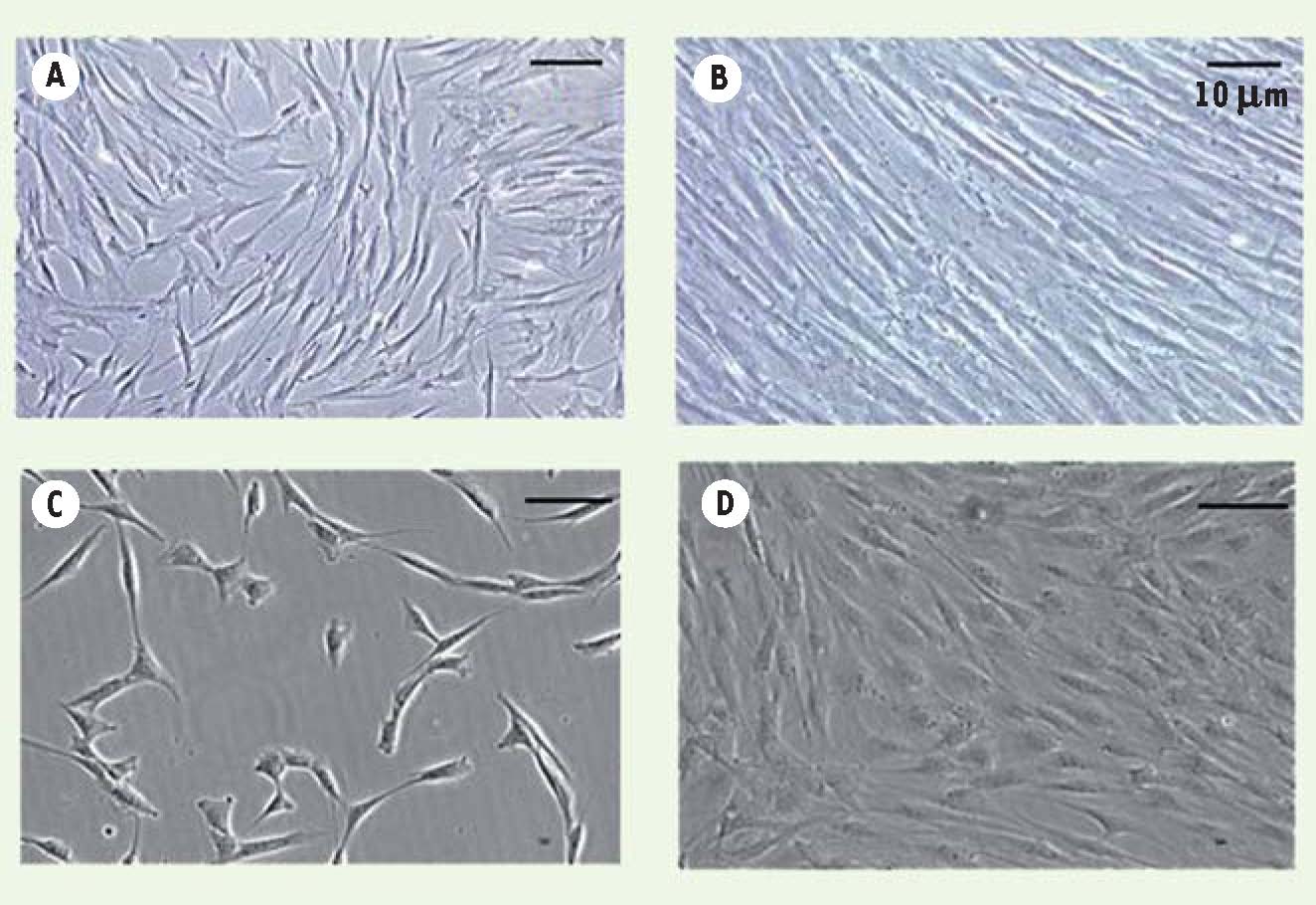
Morphologie des CSM et des ASC. A. CSM en phase non confluente. B. CSM en phase confluente. C. ASC en phase non confluente. D. ASC en phase confluente. CSM : cellules souches mésenchymateuses; ASC : adipose derived stem cells.
|
De nombreux travaux ont étudié le phénotype membranaire des cellules obtenues à confluence et au cours de passages suivants. Ces études ont clairement montré que les cellules adhérentes constituaient une population de cellules mésenchymateuses distincte des populations hématopoïétiques ou endothéliales. Plus de 50 protéines de membrane caractérisent les CSM cultivées dans les conditions standardisées établies par les équipes du projet européen Genostem [3,
4]. Il convient de souligner que, comme pour d’autres populations cellulaires, aucun de ces marqueurs ne peut être considéré individuellement comme spécifique des CSM et que l’ensemble des marqueurs n’est pas suffisant pour définir la population en l’absence des critères fonctionnels de différenciation en précurseurs adipocytaires, ostéogéniques et chondrogéniques. Les marqueurs CD73, CD90 (antigène Thy-1), CD105 (endogline), CD146 (melanoma cell adhesion molecule, MCAM ou glycoprotéine MUC18) et CD200 présents sur les CSM natives permettent leur enrichissement [3]. Cet enrichissement sera d’autant plus élevé en CFU-F (d’un facteur supérieur à 100 par rapport à la fraction de départ de cellules mononuclées) qu’on aura, dans une première étape, éliminé, par sélection négative, la plupart des cellules hématopoïétiques CD45+. L’identification des CSM doit comporter la démonstration au niveau clonal que ces cellules peuvent se différencier en précurseurs adipocytaires (A), ostéogéniques (O) et chondrogéniques (C). Les cellules sont cultivées en présence d’inducteurs appropriés. La différenciation est évaluée par des méthodes histochimiques (colorations spécifiques) et par l’expression de facteurs de transcription clés des différentes voies (Peroxisome proliferator-activated receptor gamma [PPARG] pour A, RUNX2 pour O et SOX9 pour C) et de certaines molécules des programmes de différenciation en aval des facteurs de transcription. Certains investigateurs recommandent de montrer aussi que les cellules sont capables, après implantation sous-cutanée dans des souris immunodéficientes, de développer des foyers osseux (contenant ou non des logettes hématopoïétiques) et de donner naissance in vivo à des adipocytes [
5]. On ne saurait assez insister sur l’obtention de l’ensemble de ces critères fonctionnels pour l’identification d’une population cellulaire en tant que CSM. Deux autres caractéristiques définissent de façon exhaustive les CSM : leur capacité d’immunosuppression et leur potentiel stromal. Bien que ces propriétés soient essentielles au plan clinique, leur mise en évidence n’est pas utilisée pour la qualification de ces cellules. Les propriétés immunosuppressives sont d’autant plus étudiées que, non seulement elles permettent de traiter des pathologies telles que la maladie du greffon contre l’hôte, mais aussi ouvrent la voie à l’utilisation allogénique des CSM [
6,
7,
38] (→). Ces effets immunomodulateurs complexes, validés in vitro et in vivo, s’expliqueraient non seulement par des interactions directes de type paracrine entre les CSM et les cellules immunitaires que sont les lymphocytes T, les cellules dendritiques et les cellules natural killer (NK), mais aussi par des effets indirects en modulant la capacité de réponse de certaines cellules immunitaires vis-à-vis d’autres cellules immunitaires (par exemple entre les cellules dendritiques et les lymphocytes T). Ces effets seraient dus à la sécrétion par les CSM de multiples molécules de nature très différente telles que les prostaglandines (notamment la PGE2), des enzymes (enzyme IDO pour indoleamine 2,3-dioxygénase ou HO pour hème oxygénase), la forme soluble d’HLA-G, des facteurs de croissance (transforming growth factor [TGF-β], hepatocyte growth factor [HGF] ou le nitric oxide [NO]).
(→) Voir l’article de C. Ménard et K. Tarte, page 269 de ce numéro
La façon la plus simple d’étudier la fonction stromale des CSM est de les cocultiver avec différentes populations de précurseurs hématopoïétiques (CD34+CD38− par exemple) et d’observer la formation d’îlots d’hématopoïèse. Des données récentes de l’équipe de Paolo Bianco ont également mis en évidence la fonction stromale in vivo [
8]. Pour ce faire, des cellules CD146+CD90+CD45− ont été implantées en sous-cutané dans des souris immunodéficientes, ce qui a permis de constater que les cellules CD146+ se logeaient sous l’endothélium (lui-même d’origine murine) des sinus en formation et que les premiers foyers d’hématopoïèse se développaient au contact de ces cellules stromales sous-endothéliales. Cellules souches de type mésenchymateux d’autres tissus Des cellules similaires aux CSM de moelle osseuse sont présentes dans beaucoup d’autres tissus [
9]. La première différence dans l’obtention de ces cellules, comparativement au procédé décrit ci-dessus pour obtenir des CSM de moelle osseuse, est la nécessité de digérer le tissu par des enzymes protéolytiques. Cette problématique de digestion est aussi validée pour tous les tissus solides à partir desquels de nombreux groupes ont isolé des cellules de type CSM. Parmi les nombreux tissus étudiés, de plus en plus de groupes se focalisent sur le tissu adipeux étant donné sa facilité de prélèvement en grande quantité par liposuccion. Le procédé d’isolement à partir de tissu adipeux de précurseurs capables de se différencier en adipocytes a été décrit dès les années 1960 [
10]. Ces cellules sont depuis appelées ASC pour adipose derived stroma/stem cells (Figure 1). L’étape de digestion est cruciale pour libérer les cellules de la matrice extracellulaire mais elle induit de grandes différences dans les populations obtenues en fonction du protocole et des enzymes protéolytiques utilisées. Il est d’autant plus nécessaire de garder à l’esprit que l’isolement de populations cellulaires distinctes dues à l’utilisation de protocoles différents peut expliquer des résultats expérimentaux variables, un point qui est souvent négligé (Figure 2). Après digestion, les adipocytes qui, remplis de lipides, flottent dans la suspension cellulaire sont éliminés de la fraction dite stromale-vasculaire du tissu. Cette fraction correspond à une population cellulaire hétérogène qui contient, entre autres, des cellules hématopoïétiques, des cellules endothéliales et des cellules immatures. La mise en culture de cette fraction et le milieu utilisé permettent aux cellules de type mésenchymateux d’adhérer et ainsi d’être sélectionnées par lavage comme pour les cultures établies à partir de la moelle osseuse. Cependant, un tel procédé ne correspond pas à une purification comme on peut l’attendre d’un tri par cytométrie de flux. Ces étapes sont pour la plupart effectuées à la main bien que l’on assiste actuellement à l’apparition de machines pour automatiser et surtout standardiser le procédé. 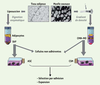 | Figure 2
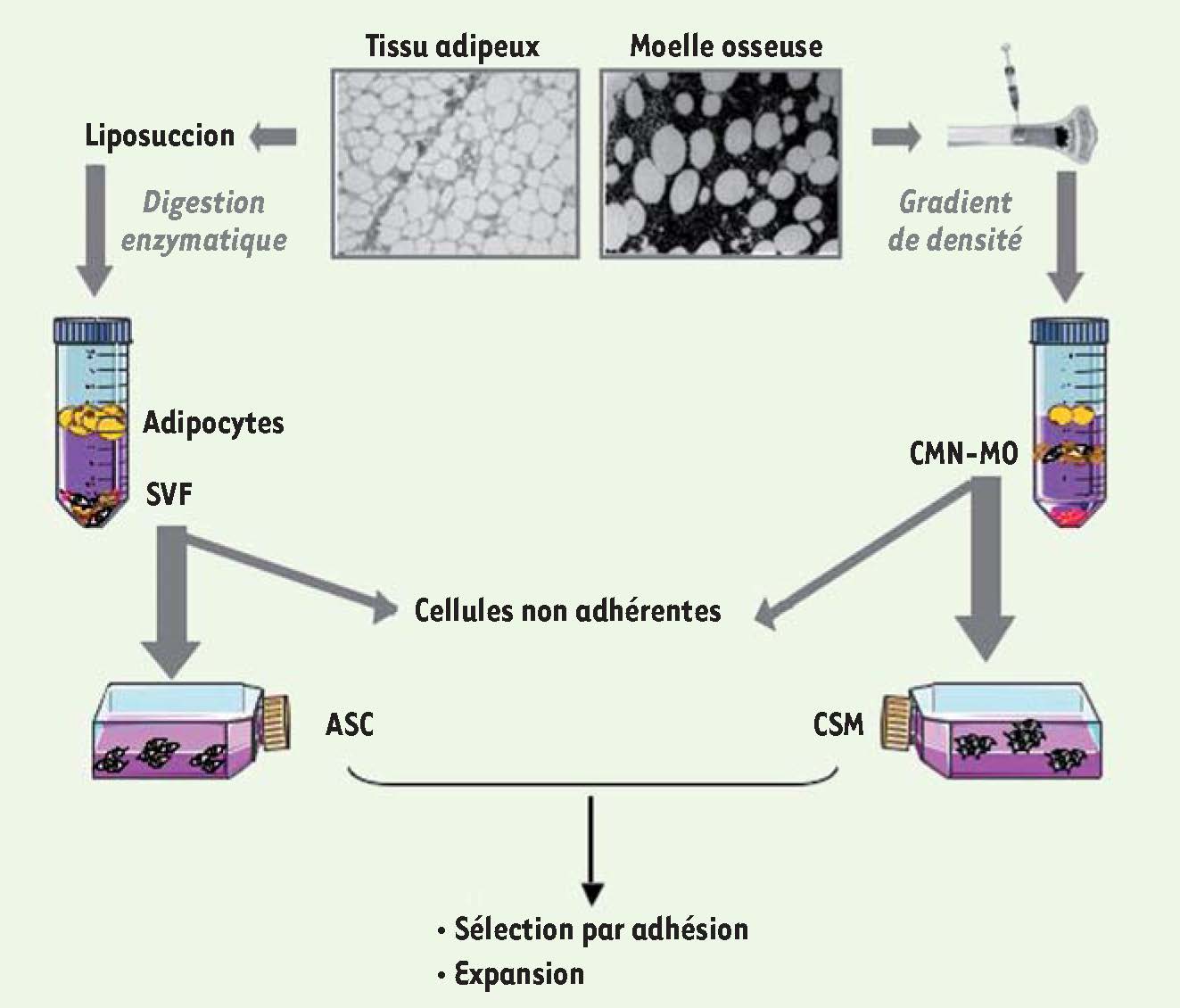
Méthodes d’obtention des CSM et des ASC. La partie gauche de la figure illustre l’obtention des ASC; noter l’importance de l’étape de digestion. La partie droite de la figure illustre l’obtention des CSM; noter que l’étape de séparation des cellules mononucléées n’est pas indispensable (voir texte). SVF : fraction stromale-vasculaire; CMN-MO : cellules mononucléées de la moelle osseuse. |
La fréquence des ASC dans le tissu adipeux est 100 à 500 fois supérieure à celle des CSM dans la moelle osseuse. Similaires sur de nombreux points, ces deux types de cellules présentent toutefois plusieurs différences. La première d’entre elles est que les ASC expriment la protéine CD34 au moins en début de culture, ce qui n’a pas été décrit pour les CSM de moelle osseuse humaine. Capables de se différencier en A, O, C et cellules vasculaires musculaires lisses (V), les ASC semblent avoir un potentiel angiogénique supérieur. Enfin, des analyses du transcriptome et du protéome effectuées dans des conditions de culture strictement comparables montrent bien que CSM et ASC, si elles présentent de nombreuses similitudes, ne sont pas identiques [
11]. Des résultats comparables ont été trouvés pour des cellules de type CSM d’autres tissus [
12]. |
Les CSM/ASC sont-elles d’authentiques cellules souches ? La définition habituellement admise pour qualifier une population de cellules adultes en tant que cellules souches repose sur trois critères essentiels [
13,
14] : il doit s’agir d’une population hétérogène de cellules : (1) immatures, (2) capables de régénérer leur tissu d’origine et donc à haut potentiel prolifératif et en général multipotentes, et (3) capables de s’autorenouveler [
39] (→). L’autorenouvellement est défini comme la capacité pour une cellule souche de donner après mitose au moins une cellule identique à elle-même, qui conserve son plein potentiel de différenciation et de prolifération. Il peut se concevoir au niveau unicellulaire, impliquant une division asymétrique de la cellule souche. Cependant, un modèle de divisions symétriques peut également rendre compte de la notion d’autorenouvellement, une cellule souche donnant naissance à deux autres cellules souches alors qu’une seconde cellule souche donne naissance à deux cellules déterminées (engagées dans une voie de différenciation).
(→) Voir l’article de D. Zipori, page 303 de ce numéro
Un quatrième critère est, maintenant, parfois associé aux trois précédents : celui de flexibilité [13–
15], puisque certaines des propriétés des cellules souches, notamment leur potentiel de prolifération et de différenciation, ne sont pas définitivement fixées. En effet, les cellules souches sont susceptibles de passer d’un état quiescent à un état prolifératif et vice-versa. Par ailleurs, de nombreuses publications suggèrent que la différenciation peut être un processus réversible, du moins jusqu’à un certain stade de différenciation [39] (→). Les variations de potentiel de prolifération ou différenciation pourraient dépendre des microenvironnements associés aux cellules souches et à leur descendance immédiate. Ces microenvironnements seraient susceptibles de figer des états métastables dus à la variation stochastique du niveau d’expression de certains gènes [
16,
17]. Ce phénomène de « bruit » génique serait particulièrement marqué au niveau des cellules souches et décroîtrait au fur et à mesure de la différenciation [
18].
(→) Voir l’article de D. Zipori, page 303 de ce numéro
Ces critères sont évalués ci-dessous dans le cas des cellules mésenchymateuses immatures adultes. Le lecteur trouvera une discussion plus détaillée dans une revue récente [
19]. La multipotence La multipotence est une propriété des CSM admise par tous puisque ces cellules sont, dans leur définition même, capables de se différencier en A, O et C. De plus, de nombreux articles indiquent que les CSM sont également capables de générer des cellules vasculaires musculaires lisses (V); la voie V est celle suivie par les cellules stromales en culture à long terme. Les CSM de moelle osseuse peuvent donc être considérées comme « quadripotentes » pour les lignages A, O, C et V. Il faut souligner ici que la multipotence doit être strictement démontrée au niveau clonal. En effet, l’observation qu’une population multiclonale donne plusieurs lignages peut s’expliquer par la coexistence de populations unipotentes, chacune pour un des quatre lignages. Il est ainsi attendu que les CSM puissent régénérer l’os et le cartilage lésés, ce qui a été largement démontré dans de nombreux modèles précliniques, dont celui de l’ostéogenèse imparfaite [
20], et par quelques essais cliniques [
40] (→). Il est aussi attendu que les CSM puissent participer à la reconstruction de la vasculature, ce qui a été démontré dans quelques études récentes in vitro et in vivo [
21,
41] (→→).
(→) Voir l’article de F. Deschaseaux, page 278 de ce numéro
(→→) Voir l’article de C. Vinatier et al., page 289 de ce numéro
Certains articles rapportent un potentiel de différenciation plus large, confinant dans quelques cas à celui des cellules souches embryonnaires : différenciation en cellules endothéliales, en cellules musculaires squelettiques et cardiaques, en cellules neurales, en hépatocytes et en cellules épithéliales. Ces observations de CSM à très large potentiel de différenciation posent trois types de question : celui d’une reprogrammation partielle éventuelle, celui de l’origine embryonnaire des CSM, et enfin celui de la sélection dans des conditions de culture spécifiques de cellules pluripotentes. Dans certaines études où la différenciation est observée in vivo, un processus de fusion avec des cellules différenciées présentes dans les sites de nichage des CSM paraît avoir eu lieu [
22]. Dans d’autres études, les CSM ont été partiellement reprogrammées par traitement in vitro [
23]. Cependant, le processus de reprogrammation ne peut expliquer l’ensemble des observations. Bien que dans des conditions de culture standardisées mises au point dans le cadre du programme européen Genostem nous n’ayions obtenu de différenciation que selon les voies A, O, C et V [4], il reste possible que des conditions de culture spécifiques sélectionnent des populations rares de cellules ayant un potentiel élargi. Ceci pourrait être le cas pour les cellules à différenciation neurale. En effet, un ensemble de données indique qu’une sous-population de CSM murines serait d’origine, non pas mésodermique comme habituellement supposé, mais neuroectodermique, et ce, non seulement au cours du développement, mais aussi dans la moelle osseuse adulte [
24]. Cette origine est cohérente avec l’origine neuroectodermique des tissus conjonctifs (incluant os et cartilage) de la partie supérieure du corps. Pour ce qui est des différenciations selon les voies endodermiques, on peut évoquer la sélection de cellules susceptibles de développer une transition épithélio-mésenchymateuse. De telles cellules ont été détectées dans le foie fœtal, mais n’ont pas été rapportées dans la moelle osseuse. Reste l’hypothèse de la sélection de cellules médullaires pluripotentes dans des conditions particulières de contrôle strict du degré de confluence, d’hypoxie, de sélection extensive d’un lot de sérum particulier, de conditions de stress telle une incubation prolongée dans une solution de trypsine [
25,
26]. De telles cellules pourraient être des vestiges de cellules souches embryonnaires ayant niché dans la moelle osseuse, ou pourraient résulter d’une reprogrammation plus ou moins complète selon un processus qui reproduirait in vivo l’induction in vitro des induced pluripotent cells. L’autorenouvellement Le point de démonstration le plus délicat concerne l’autorenouvellement. Une étude récente montre que les CFU-F CD146 +CD90 + sont capables de s’autorenouveler [ 8]. En effet, après implantation d’une colonie de ce type en sous-cutané dans une souris immuno-déficiente, et récupération de l’implant après quelques semaines, un tri cellulaire a permis d’isoler une population très minoritaire de cellules CD146 +CD90 + qui, après culture, a pu générer deux CFU-F à partir d’une seule. Reste à démontrer un autorenouvellement extensif, ce qui suppose l’utilisation de receveurs secondaires, voire tertiaires. Le faible taux de renouvellement du tissu mésenchymateux en condition stationnaire par rapport, par exemple, à l’hématopoïèse et la plasticité des CSM sont des limitations théoriques à la nécessité pour ces cellules de s’autorenouveler extensivement (voir plus loin). La plasticité Il est connu de longue date que les cellules mésenchymateuses peuvent transiter d’un état de différenciation dans un autre sous l’influence de facteurs extracellulaires. Les chondrocytes de la plaque intermédiaire s’hypertrophient avant de se transformer en ostéoblastes. Des clones de CSM différenciés en A, O, C ou V peuvent donner des cellules de lignage mésenchymateux alternatif après modification des conditions de culture [
27,
28]. Compte tenu de l’homogénéité de la population cellulaire avant toute modification des conditions de culture, il est peu probable que ces résultats s’expliquent par la prolifération de CSM résiduelles. Il est probable que les transitions passent par un état de dédifférenciation, des investigateurs ayant montré la capacité des cellules mésenchymateuses différenciées à se dédifférencier lorsqu’on passe d’un milieu de culture différenciant à un milieu de prolifération [
29]. La plasticité des CSM constitue un exemple extrême de flexibilité des propriétés des cellules souches [ 39] (→). Plasticité et autorenouvellement sont deux propriétés compétitives, mais non exclusives. En effet, la possibilité pour une cellule dans la descendance d’une cellule souche de récupérer de novo un potentiel complet de différenciation rend caduque la nécessité d’une grande capacité d’autorenouvellement pour maintenir le potentiel souche. Les modèles hiérarchiques de différenciation, où les cellules souches sont des entités prédéfinies donnant naissance à des populations discrètes de progéniteurs et de précurseurs (comme dans le système hématopoïétique), ne sont pas compatibles avec un processus de dédifférenciation [ 39] (→→).
(→) Voir l’article de D. Zipori, page 303 de ce numéro
(→→) Voir l’article de D. Zipori, page 303 de ce numéro
D’autres modèles peuvent s’appliquer, notamment ceux qui prennent en compte le phénomène de bruit dû aux variations stochastiques des niveaux d’expression de certains gènes ou réseaux de gènes [18]. Le phénomène de plasticité s’intègre bien au modèle de lineage priming des CSM [28]. Selon ce modèle, explicité en premier lieu pour les cellules souches hématopoïétiques (CSH), les cellules souches expriment, avant toute induction de différenciation vers leurs différents lignages, certains gènes caractéristiques de ces lignages, dont certains facteurs-clés de transcription. Ainsi, les CSM expriment, avant toute induction de différenciation, PPARG, RUNX2 et SOX9. La différenciation se traduit par l’augmentation du facteur correspondant à la voie induite et la diminution des facteurs des voies alternatives. Le modèle de lineage priming instruit sur le potentiel de différenciation, introduit l’hypothèse d’oscillations entre différents états intermédiaires et implique la réduction du nombre de gènes à induire pour compléter les programmes de différenciation. En outre, l’expression des facteurs-clés de transcription des lignages de différenciation montre que leurs gènes correspondants sont en conformation ouverte et donc accessibles aux molécules de remodelage de la chromatine ou aux coactivateurs transcriptionnels susceptibles de modifier l’équilibre qui prévaut entre eux. En conclusion, les CSM peuvent être considérées comme d’authentiques cellules souches si on considère l’ensemble des quatre critères énoncés plus haut. Dans la mesure où il existe une tension compétitive entre le critère autorenouvellement et le critère plasticité, CSH et CSM pourraient constituer deux extrêmes parmi les cellules souches tissulaires adultes : c’est l’autorenouvellement qui serait la propriété cardinale des CSH, alors que la plasticité serait l’attribut essentiel des CSM. À noter que les capacités immunosuppressive et stromale des CSM sont deux caractéristiques indépendantes du caractère souche, mais qui confèrent à ces cellules un intérêt clinique accru. En ce qui concerne les cellules mésenchymateuses d’autres tissus, dont les ASC, la caractérisation de critères correspondant au phénotype souche n’a jamais été faite de manière aussi complète que pour les CSM. Si leur multipotentialité a été démontré in vitro au niveau clonal, leur capacité d’autorenouvellement reste à établir de façon définitive [
30,
31]. |
Mécanismes d’action de la réparation tissulaire par les CSM/ASC Chez le mammifère adulte, un traumatisme sévère provoque la mise en place d’un processus de réparation spontanée qui, le plus souvent, ne permet pas le maintien de l’intégrité tissulaire. La transplantation in vivo de CSM dans ces situations a mis en évidence leurs propriétés de réparation. Ce potentiel thérapeutique va de la réparation des pertes cartilagineuses et osseuses au traitement des maladies cardiovasculaires, en passant par les lésions de la moelle épinière et la fibrose pulmonaire [40] (→).
(→) Voir l’article de C. Jorgensen, F. Deschaseaux, V. Planat-Benard et E. Gabison, page 275 de ce numéro
Elles peuvent aussi être utilisées lors des complications immunologiques des greffes de CSH. Ces indications potentielles extrêmement nombreuses ne feront qu’augmenter avec le vieillissement de la population. Cependant, malgré les promesses que représentent les CSM, un certain nombre de questions scientifiques et réglementaires restent à résoudre afin de pouvoir réaliser les essais cliniques. Pour comprendre le rôle des CSM, on peut faire une analogie avec le tissu médullaire. Par cette analogie, les tissus peuvent être considérés comme des systèmes à deux compartiments : un compartiment qu’on peut qualifier de fonctionnel en relation avec les fonctions spécifiques assurées par les tissus (par exemple le compartiment hématopoïétique dans la moelle osseuse) et un compartiment stromal-vasculaire qui sert de niche au compartiment précédent et participe à son microenvironnement. Cette dichotomie fonctionnelle n’est pas stricte au niveau cellulaire. En effet, certaines cellules qui appartiennent à un compartiment dans un tissu peuvent participer à l’autre compartiment dans un autre tissu. L’interaction entre les deux compartiments est obligatoire pour le maintien de l’intégrité tissulaire qui repose sur un turn-over permanent, plus ou moins prononcé suivant les tissus, de cellules différenciées issues des cellules souches caractéristiques de chacun des compartiments. Ces interactions sont aussi obligatoires dans le cadre de la régénération. Selon les tissus, les CSM peuvent appartenir au compartiment fonctionnel ou stromal-vasculaire décrit précédemment. Les mécanismes non exclusifs de réparation tissulaire par les CSM sont essentiellement de deux types : (1) la reconstitution du compartiment fonctionnel par repopulation après prolifération et différenciation subséquente de ces cellules et (2) les effets de type stromal à destination des cellules du compartiment fonctionnel (sécrétion de facteurs angiogéniques, antiapoptotiques, antifibrotiques, modulateurs de l’inflammation, etc.) [
32]. La
Figure 3
récapitule les différents mécanismes qui interviennent probablement dans la réparation des tissus.  | Figure 3
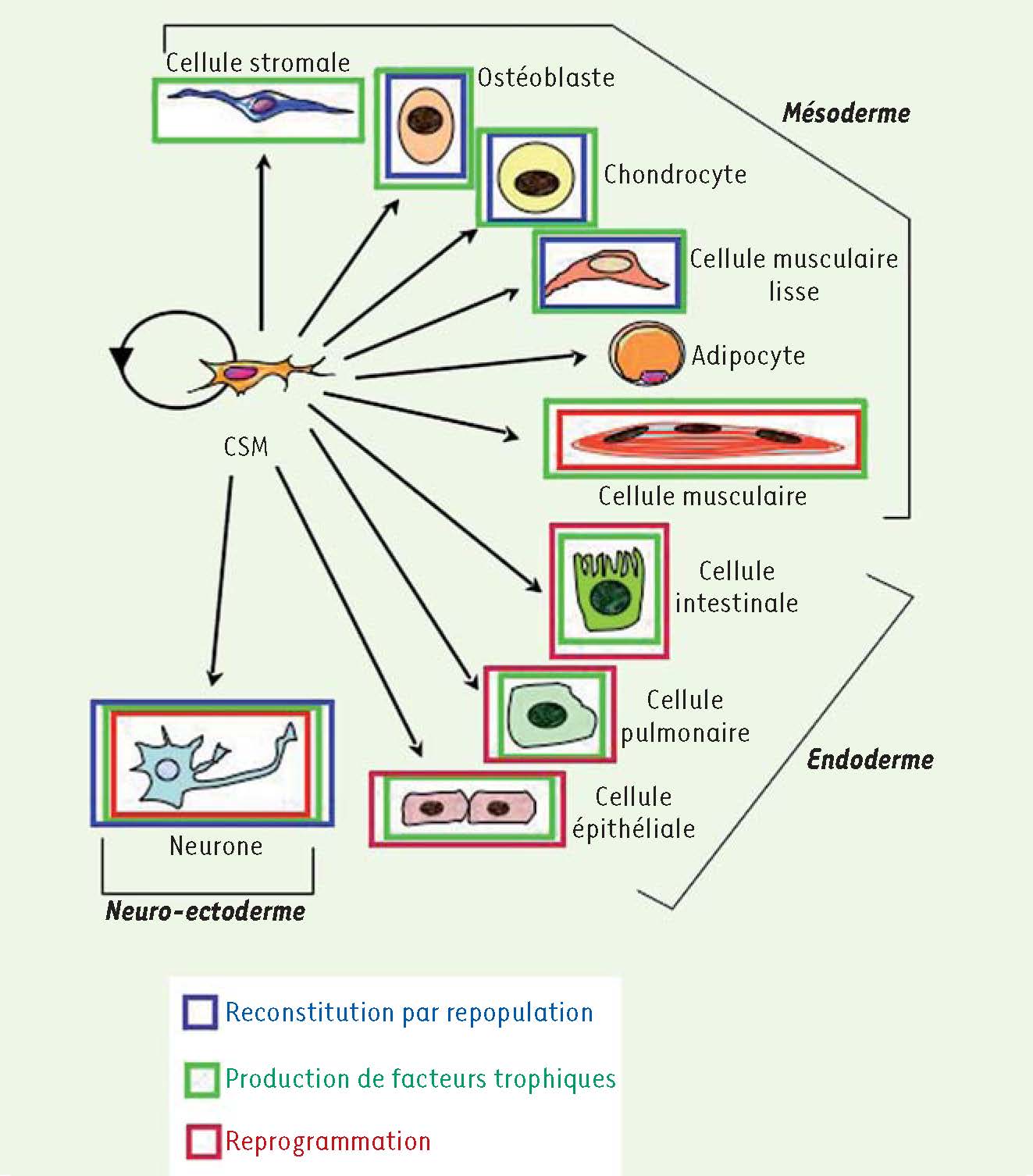
La multipotence des CSM/ASC et les mécanismes de réparation par ces cellules.
|
La reconstitution du compartiment fonctionnel peut se faire par différenciation en phénotypes mésenchymateux (ostéoblastes, chondrocytes, adipocytes) ou faire suite à des mécanismes de reprogrammation (en particulier après fusion). On peut aussi noter l’orientation préférentielle des CSM vers certaines voies de différenciation en fonction de leur tissu d’origine, ce qui pourrait expliquer des différences d’effets [12,
33]. Deux problèmes importants restent à résoudre. Premièrement, il apparaît de plus en plus que les effets thérapeutiques sont faiblement corrélés au nombre de cellules différenciées issues des CSM transplantées. Deuxièmement, il est extrêmement difficile de démontrer à long terme la présence des CSM transplantées alors même que les effets persistent. Concernant le premier point, il est nécessaire de garder à l’esprit que le bénéfice thérapeutique attendu peut être associé à une très faible colonisation par les CSM injectées, à condition que le phénotype de celles-ci présente un avantage sélectif par rapport aux populations endogènes; cela a été observé dans le traitement de l’ostéogenèse imparfaite [
34]. Par ailleurs, démontrer l’implication réelle et directe des processus de différenciation dans les mécanismes de réparation nécessite une dissection fine, à l’instar de ce qui a été fait par le groupe de Stéphanie Dimmeler avec les cellules mononucléées médullaires [
35]. Par génie génétique, ces auteurs ont spécifiquement détruit les cellules transplantées selon leur phénotype pour définir l’implication respective de chacune des populations. L’implication de l’activité paracrine des CSM est beaucoup plus facile à démontrer par interférence ARN, ce qui a permis d’identifier de nombreuses molécules telles que les facteurs angiogéniques ou antifibrotiques ou des molécules capables de moduler l’état immunitaire et inflammatoire [6,
36]. Il paraît hautement improbable qu’une seule de ces molécules soit responsable de l’ensemble de ces effets. Il semble plus raisonnable de proposer que les CSM sécrètent des molécules très différentes de manière coordonnée dans le temps et en interaction avec l’environnement changeant des tissus en réparation dans lesquels elles sont transplantées [32]. Cette vision dynamique confère à l’administration des CSM un avantage certain en comparaison de l’administration d’une molécule spécifique; en revanche, cette considération devient une difficulté quand il faut définir de manière stricte le médicament proposé aux différentes instances de régulation. De plus, les propriétés immunomodulatrices facilitent l’utilisation des CSM en situation allogénique, situation obligatoire lorsqu’il s’agit de traiter un grand nombre de patients. Il n’y a pour l’instant, à notre connaissance, aucune expérience qui explique clairement la rémanence des effets des CSM. D’un point de vue théorique, on pourrait proposer que ces cellules jouent le rôle d’orchestrateur des étapes initiales de rétablissement de l’homéostasie tissulaire. Cette proposition aurait pour corollaire qu’une dérégulation des CSM elles-mêmes pourrait contribuer aux événements pathologiques, ce qui serait en adéquation avec les anomalies des CSM observées dans certaines pathologies comme cela a été démontré pour le myélome multiple [
37]. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Friedenstein
AJ
,
Chailakhjan
RK
,
Lalykina
KS
. The development of fibroblast colonies in monolayer cultures of guinea-pig bone marrow and spleen cells . Cell Tissue Kinet.
1970; ; 3 : :393.-403. 2.
Pittenger
MF
,
Mackay
AM
,
Beck
SC
, et al.
Multilineage potential of adult human mesenchymal stem cells . Science.
1999; ; 284 : :143.-147. 3.
Delorme
B
,
Ringe
J
,
Gallay
N
, et al.
Specific plasma membrane protein phenotype of culture-amplified and native human bone marrow mesenchymal stem cells . Blood.
2008; ; 111 : :2631.-2635. 4.
Charbord
P
,
Livne
E
,
Gross
G
, et al.
Human bone marrow mesenchymal stem cells: a systematic reappraisal via the genostem experience . Stem Cell Rev.
2010 ; (online).. 5.
Bianco
P
,
Robey
PG
,
Simmons
PJ
. Mesenchymal stem cells: revisiting history, concepts, and assays . Cell Stem Cell.
2008; ; 2 : :313.-319. 6.
Uccelli
A
,
Moretta
L
,
Pistoia
V
. Mesenchymal stem cells in health and disease . Nat Rev Immunol.
2008; ; 8 : :726.-736. 7.
Le Blanc
K
,
Ringden
O
. Mesenchymal stem cells: properties and role in clinical bone marrow transplantation . Curr Opin Immunol.
2006; ; 18 : :586.-591. 8.
Sacchetti
B
,
Funari
A
,
Michienzi
S
, et al.
Self-renewing osteoprogenitors in bone marrow sinusoids can organize a hematopoietic microenvironment . Cell.
2007; ; 131 : :324.-336. 9.
Sensebe
L
,
Bourin
P
. Mesenchymal stem cells for therapeutic purposes . Transplantation.
2009; ; 87 : :S49.-S53. 10.
Gimble
JM
,
Katz
AJ
,
Bunnell
BA
. Adipose-derived stem cells for regenerative medicine . Circ Res.
2007; ; 100 : :1249.-1260. 11.
Noel
D
,
Caton
D
,
Roche
S
, et al.
Cell specific differences between human adipose-derived and mesenchymal-stromal cells despite similar differentiation potentials . Exp Cell Res.
2008; ; 314 : :1575.-1584. 12.
Jansen
BJ
,
Gilissen
C
,
Roelofs
H
, et al.
Functional differences between mesenchymal stem cell populations are reflected by their transcriptome . Stem Cells Dev.
2010; ; 19 : :481.-490. 13.
Loeffler
M
,
Potten
C
. Stem cells and cellular pedigrees- a conceptual introduction . In :
Potten
C
, ed.
Stem cells . San Diego: : Academic Press; , 1997 : :1.-28. 14.
Loeffler
M
,
Roeder
I
. Tissue stem cells: definition, plasticity, heterogeneity, self-organization and models–a conceptual approach . Cells Tissues Organs.
2002; ; 171 : :8.-26. 15.
Loeffler
M
,
Roeder
I
. Conceptual models to understand tissue stem cell organization . Curr Opin Hematol.
2004; ; 11 : :81.-87. 16.
Huang
S
. Reprogramming cell fates: reconciling rarity with robustness . Bioessays.
2009; ; 31 : :546.-560. 17.
Kaern
M
,
Elston
TC
,
Blake
WJ
,
Collins
JJ
. Stochasticity in gene expression: from theories to phenotypes . Nat Rev Genet.
2005; ; 6 : :451.-464. 18.
Krinner
A
,
Hoffmann
M
,
Loeffler
M
, et al.
Individual fates of mesenchymal stem cells in vitro . BMC Syst Biol.
2010; ; 4 : :73.. 19.
Charbord
P
. Bone marrow mesenchymal stem cells: historical overview and concepts . Hum Gene Ther.
2010; ; 21 : :1045.-1056. 20.
Horwitz
EM
,
Gordon
PL
,
Koo
WK
, et al.
Isolated allogeneic bone marrow-derived mesenchymal cells engraft and stimulate growth in children with osteogenesis imperfecta: Implications for cell therapy of bone . Proc Natl Acad Sci USA.
2002; ; 99 : :8932.-8937. 21.
Au
P
,
Tam
J
,
Fukumura
D
,
Jain
RK
. Bone marrow-derived mesenchymal stem cells facilitate engineering of long-lasting functional vasculature . Blood.
2008; ; 111 : :4551.-4558. 22.
Alvarez-Dolado
M
,
Pardal
R
,
Garcia-Verdugo
JM
, et al.
Fusion of bone-marrow-derived cells with Purkinje neurons, cardiomyocytes and hepatocytes . Nature.
2003; ; 425 : :968.-973. 23.
Barzilay
R
,
Melamed
E
,
Offen
D
. Introducing transcription factors to multipotent mesenchymal stem cells: making transdifferentiation possible . Stem Cells.
2009; ; 27 : :2509.-2515. 24.
Takashima
Y
,
Era
T
,
Nakao
K
, et al.
Neuroepithelial cells supply an initial transient wave of MSC differentiation . Cell.
2007; ; 129 : :1377.-1388. 25.
Kuroda
Y
,
Kitada
M
,
Wakao
S
, et al.
Unique multipotent cells in adult human mesenchymal cell populations . Proc Natl Acad Sci USA.
2010; ; 107 : :8639.-8643. 26.
Jiang
Y
,
Jahagirdar
BN
,
Reinhardt
RL
, et al.
Pluripotency of mesenchymal stem cells derived from adult marrow . Nature.
2002; ; 418 : :41.-49. 27.
Song
L
,
Tuan
RS
. Transdifferentiation potential of human mesenchymal stem cells derived from bone marrow . Faseb J.
2004; ; 18 : :980.-982. 28.
Delorme
B
,
Ringe
J
,
Pontikoglou
C
, et al.
Specific lineage-priming of bone marrow mesenchymal stem cells provides the molecular framework for their plasticity . Stem Cells.
2009; ; 27 : :1142.-1151. 29.
Song
L
,
Webb
NE
,
Song
Y
,
Tuan
RS
. Identification and functional analysis of candidate genes regulating mesenchymal stem cell self-renewal and multipotency . Stem Cells.
2006; ; 24 : :1707.-1718. 30.
Zuk
PA
,
Zhu
M
,
Ashjian
P
, et al.
Human adipose tissue is a source of multipotent stem cells . Mol Biol Cell.
2002; ; 13 : :4279.-4295. 31.
Rodriguez
AM
,
Pisani
D
,
Dechesne
CA
, et al.
Transplantation of a multipotent cell population from human adipose tissue induces dystrophin expression in the immunocompetent mdx mouse . Exp Med.
2005; ; 201 : :1397.-1405. 32.
Horwitz
EM
,
Dominici
M
. How do mesenchymal stromal cells exert their therapeutic benefit? . Cytotherapy.
2008; ; 10 : :771.-774. 33.
Kim
Y
,
Kim
H
,
Cho
H
, et al.
Direct comparison of human mesenchymal stem cells derived from adipose tissues and bone marrow in mediating neovascularization in response to vascular ischemia . Cell Physiol Biochem.
2007; ; 20 : :867.-876. 34.
Horwitz
EM
,
Prockop
DJ
,
Fitzpatrick
LA
, et al.
Transplantability and therapeutic effects of bone marrow-derived mesenchymal cells in children with osteogenesis imperfecta . Nat Med.
1999; ; 5 : :309.-313. 35.
Yoon
CH
,
Koyanagi
M
,
Iekushi
K
, et al.
Mechanism of improved cardiac function after bone marrow mononuclear cell therapy: role of cardiovascular lineage commitment . Circulation.
2010; ; 121 : :2001.-2011. 36.
Maggini
J
,
Mirkin
G
,
Bognanni
I
, et al.
Mouse bone marrow-derived mesenchymal stromal cells turn activated macrophages into a regulatory-like profile . PLoS One.
2010; ; 5 : :e9252.. 37.
Corre
J
,
Mahtouk
K
,
Attal
M
, et al.
Bone marrow mesenchymal stem cells are abnormal in multiple myeloma . Leukemia.
2007; ; 21 : :1079.-1088. 38.
Ménard
C
,
Tarte
K
. Immunosuppression et cellules souches mésenchymateuses : mieux comprendre une propriété thérapeutique majeure . Med Sci (Paris).
2011; ; 27 : :269.-274. 39.
Zipori
D
. À la recherche d’une définition moléculaire plus que descriptive pour les cellules souches . Med Sci (Paris).
2011; ; 27 : :303.-307. 40.
Jorgensen
C
,
Deschaseaux
F
,
Planat-Benard
V
,
Gabison
E
. Les cellules souches mésenchymateuses : actualités thérapeutiques . Med Sci (Paris).
2011; ; 27 : :275.-284. 41.
Vinatier
C
,
Bordenave
L
,
Guicheux
J
,
Amédée
J
. Les cellules souches en ingénierie des tissus ostéoarticulaires et vasculaires . Med Sci (Paris).
2011; ; 27 : :289.-296. |