| |
| Med Sci (Paris). 2011 March; 27(3): 303–301. Published online 2011 March 30. doi: 10.1051/medsci/2011273303.À la recherche d’une définition moléculaire plus que descriptive pour les cellules souches Dov Zipori1* 1Department of Molecular Cell Biology, Weizmann Institute of Science, Rehovot, Israël |
Comment définir une cellule souche ? Le concept de cellule souche (CS) repose sur l’observation d’un renouvellement des différents compartiments cellulaires composant les organismes multicellulaires complexes pour remplacer les cellules qui meurent continuellement. La nécessité d’un flux continu de nouvelles cellules issues de la différenciation de cellules plus immatures, les cellules souches, est donc posée. Les cellules souches assurent la pérennité de leur stock par des divisions dites d’autorenouvellement. Certaines d’entre elles cependant s’engagent dans un processus de différenciation (« détermination » que désigne le terme commitment des Anglo-Saxons) tout en poursuivant leur prolifération, ce qui donne naissance à une grande diversité de cellules matures ; ce faisant, elles quittent le compartiment souche. C’est par ce jeu d’événements d’autorenouvellement et de détermination/commitment que l’intégrité tissulaire est préservée.  | Figure 1
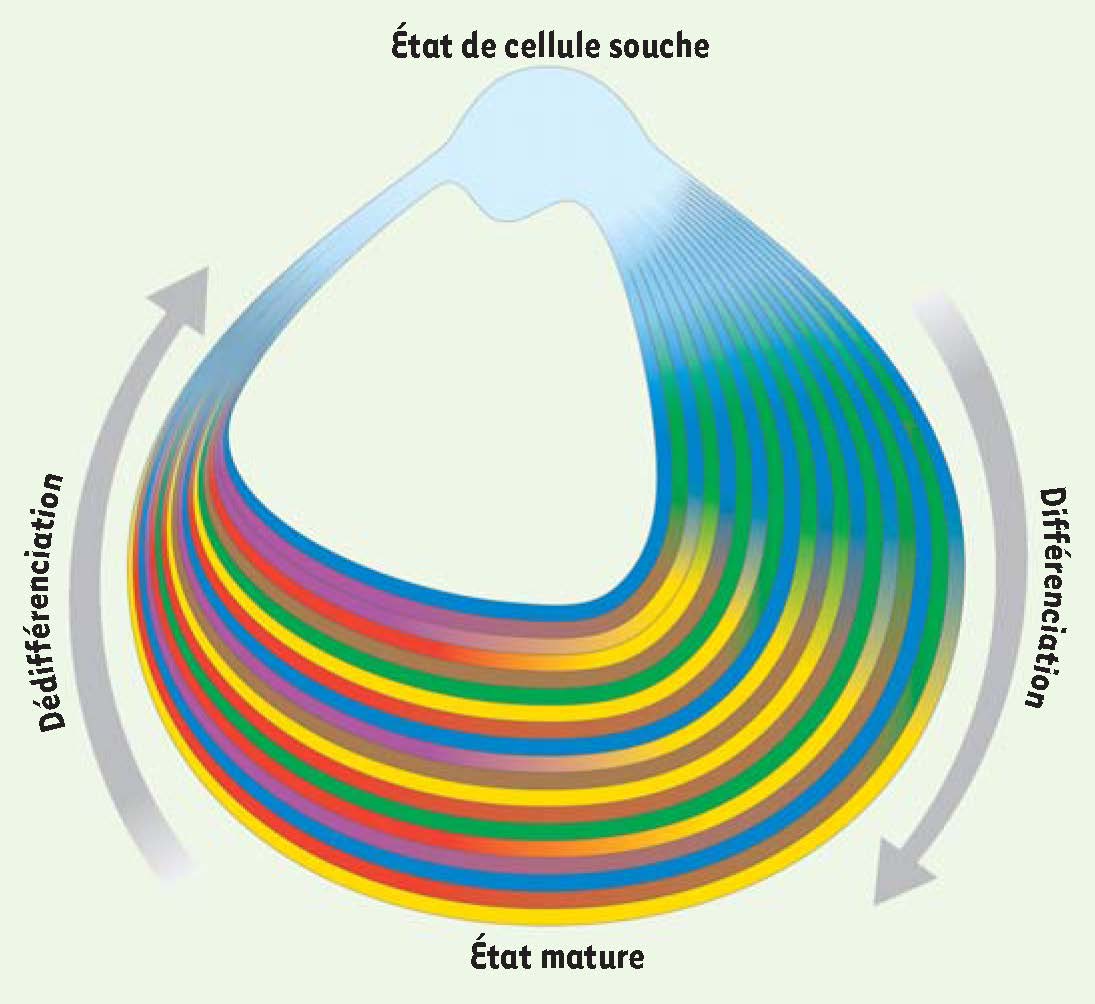
Le cycle de la vie d’une cellule. La vie d’une cellule est illustrée sous la forme d’un cercle inégal dans lequel les cellules passent d’un état de cellule souche à un état mature via le processus de différenciation, mais peuvent réacquérir l’état indifférencié initial (dédifférenciation). Les différentes couleurs illustrent la spécification progressive dans les différentes lignées qui toutes sont issues d’une cellule pluripotente. La partie étroite du cercle qui retourne vers cet état souche reflète la rareté de cet événement de dédifférenciation/reprogrammation dans les conditions physiologiques. |
Des dizaines d’années de recherche se sont écoulées depuis la démonstration expérimentale qu’existaient dans l’organisme des cellules répondant à ces critères de cellule souche - les cellules souches hématopoïétiques (CSH) -, et beaucoup de cellules ont depuis été qualifiées de souches. Pourtant, ces populations de cellules souches sont très hétéroclites et regroupent des cellules qui n’ont pas grand chose en commun. C’est en partie le résultat du flou qui entoure la définition d’une cellule souche. Chaque catégorie de cellules différenciées est parfaitement caractérisée sur le plan moléculaire : ainsi, tous les globules rouges produisent de l’hémoglobine et tous les lymphocytes B, et eux seuls, expriment un récepteur spécifique, le B cell receptor. Mais aucune molécule ne peut s’enorgueillir d’être exprimée par toutes les cellules souches. Au contraire, de multiples combinaisons de molécules identifient des populations particulières de CS : ainsi, les CS embryonnaires (CSE) expriment le facteur de transcription Oct-4 qui est absent des CSH, ces dernières exprimant d’autres marqueurs qui leur sont spécifiques et ne sont pas partagés par les CSE. Cette absence de définition moléculaire commune à toutes les CS explique qu’on se contente d’une définition descriptive : une cellule qui est en amont d’une autre dans la hiérarchie de différenciation est en quelque sorte « sa » cellule souche. Les CSE sont en amont des hépatocytes, et de toute autre cellule à laquelle elles donnent naissance ; les cellules souches hématopoïétiques précèdent dans la hiérarchie hématopoïétique toutes les cellules sanguines myéloïdes et lymphoïdes. Or toutes deux, CSE et CSH, sont désignées comme cellules souches. Un tel raisonnement peut mener loin : on pourrait dire par exemple qu’une CS hématopoïétique capable de reconstituer à long terme l’ensemble des lignées hématopoïétiques in vivo est « la » CS d’une CFU-S (colony-forming unit spleeen) qui se développe dans la rate des souris receveuses au jour 8 post-transplantation mais n’a pas un aussi large potentiel de reconstitution à long terme et se situe immédiatement en aval de la précédente dans la hiérarchie. Celle-ci, à son tour, est « la » CS des GM-CFC, granulocyte macrophage colony-forming cell, et ainsi de suite. Chaque cellule est ainsi toujours « la » CS d’une autre plus en aval. On pourrait presque, par provocation, considérer les GM-CFC comme les CS des macrophages activés, cellules matures à la fin de la chaîne de différenciation, et, pourquoi pas, proposer que presque toutes les cellules de la hiérarchie hématopoïétique se revendiquent « cellules souches ». C’est évidemment absurde. Mais en pratique, beaucoup de cellules qualifiées de souches sont en fait des « progéniteurs » déjà engagés dans le processus de différenciation. Certes, ces derniers conservent certains attributs des cellules souches, mais en diffèrent par leur prolifération active et parce qu’ils expriment déjà des marqueurs caractéristiques de la voie de différenciation dans laquelle ils sont engagés, avant de sortir du cycle cellulaire et d’achever leur maturation terminale. La plupart des cellules qualifiées de « souches » dans les systèmes in vitro sont en fait des progéniteurs et non pas des cellules souches au sens strict du terme. Pour ajouter à la confusion, on inclut maintenant dans cette catégorie une fraction de cellules tumorales baptisées « cellules souches cancéreuses » parce qu’elles ont la capacité de donner naissance à des cellules tumorales, ce dont sont incapables les autres cellules composant la tumeur. Sur ce seul critère, et par analogie avec le raisonnement exposé ci-dessus, la majorité des cellules tumorales représenteraient un compartiment de cellules différenciées, descendance de cellules souches situées en amont. Mais perdre la capacité de former une tumeur n’est pas en soi un critère de « différenciation », et, qui plus est, dans certaines tumeurs la majorité des cellules, parfois chacune d’entre elles, peut former une tumeur après greffe in vivo. Outre ce critère « hiérarchique », les cellules tumorales prolifèrent de façon indéfinie, ce qui est considéré comme un signe d’autorenouvellement. On peut contester cette affirmation, car l’autorenouvellement est un processus qui dépend de l’environnement, de la « niche » dans laquelle évolue la cellule. Par exemple, les CSH ne possèdent pas de capacité d’autorenouvellement intrinsèque, mais cette capacité leur est conférée par les cellules stromales qui composent leur niche dans la moelle osseuse. Au contraire, la prolifération tumorale est autonome. Induite par des modifications génétiques et épigénétiques caractéristiques des cellules cancéreuses, elle ne dépend pas des signaux de l’environnement. L’autorenouvellement de CS normales et la prolifération de cellules tumorales ne peuvent donc pas être tenus pour des processus similaires. Il ne viendrait pas à l’idée de considérer comme identiques l’apoptose, la nécrose, l’autophagie, et la lyse cellulaire, au prétexte que tous ces processus aboutissent à la mort de la cellule. Chacun fait intervenir un mécanisme spécifique : l’apoptose, qui accompagne par exemple la sélection négative des lymphocytes T, fait intervenir une voie de signalisation mitochondriale. Au contraire, la lyse cellulaire qu’induit la fixation d’un anticorps fixant le complément résulte d’une lésion de la membrane cellulaire. De même, prolifération cellulaire et autorenouvellement mettent en jeu des mécanismes distincts et qui ne sont pas interchangeables. J’ai discuté ces points dans des revues récentes et ne les détaillerai pas plus avant ici [
1,
2]. En revanche, je voudrais discuter ici une nouvelle définition de la « souchitude » - c’est-à-dire de l’état de cellule souche -, qui peut résoudre les controverses et incertitudes qui ont surgi dans le domaine de la biologie des cellules souches et aboutir à une définition moléculaire de l’état « souche ». |
Expression à bas bruit de multiples gènes dans les CSM 1
Les cellules stromales mésenchymateuses, aussi nommées cellules souches mésenchymateuses (l’acronyme est le même, CSM), expriment les transcrits codant pour le T cell receptor et le B cell receptor. C’est un exemple parmi d’autres car les transcrits de très nombreuses familles de gènes sont détectés dans les MSC comme dans d’autres types de progéniteurs [
3]. Une analyse transcriptomique à large échelle a effectivement confirmé que les cellules souches embryonnaires transcrivaient à bas bruit l’essentiel des gènes2 [
4]. Un peu comme si les CS et certains progéniteurs étaient dans un état de « attente/stand-by » et pouvaient à tout moment s’engager dans n’importe quelle voie de différenciation. Cette expression à bas bruit généralisée dans les CS explique que l’on ne trouve pas de gènes spécifique de cellules souches. Il faut donc se résoudre à rechercher d’autres caractéristiques de cellules souches qu’un profil transcriptionnel spécifique, au premier plan desquelles des modifications épigénétiques dont on connaît l’importance dans beaucoup de processus biologiques [
5,
6]. |
Dédifférenciation, transdifférenciation et reprogrammation définissent une organisation non hiérarchique des cellules souches et de leur descendance Les CSM ne sont pas organisées en une hiérarchie précise Par analogie avec le système hématopoïétique, on a voulu organiser les CSM selon un arbre généalogique partant d’un progéniteur ancestral qui se différencie en de multiples progéniteurs aux caractéristiques variées. Ces derniers sont des dérivés mésodermiques comprenant les ostéoblastes, les adipocytes, les chondrocytes et les cellules stromales formant l’environnement propice à la survie et à la différenciation des progéniteurs hématopoïétiques. On pourrait considérer ces cellules mésodermiques comme les alter ego des cellules matures, granuleux et macrophages, issues de la différenciation des CSH. Toutefois certaines propriétés des CSM ne résultent pas d’un processus de différenciation au sens strict du terme : c’est le cas du rôle de support de l’hématopoïèse qu’exercent certaines cellules stromales mésenchymateuses. De fait, les CSM indifférenciées, mais aussi les précurseurs adipocytaires, possèdent aussi cette propriété [
7]. Si cette capacité de soutien est perdue lorsque ces précurseurs se différencient en adipocytes matures accumulant des lipides, tel n’est pas le cas lors de la différenciation des CSM en précurseurs ostéogéniques puis en ostéocytes sécrétant une matrice osseuse [ 7]. Cette organisation hiérarchique de cellules qui perdent progressivement leur potentiel au fur et à mesure qu’elles s’éloignent du progéniteur ancestral ne semble donc pas s’appliquer au processus de différenciation des CSM. Ce n’est qu’un parmi d’autres aspects qui remettent en cause la notion classique de « cellule souche » appliquée aux tissus mésenchymateux. Dédifférenciation La réversibilité du processus de différenciation, ou dédifférenciation, est bien connue chez les plantes, la drosophile et lors de la régénération chez les amphibiens [
8–
10] mais jusqu’à très récemment, on pensait qu’il était sans équivalent chez les mammifères. Or, une étude récente montre que dans le testicule de souris, les progéniteurs ( transit amplifying cells), issus des cellules souches spermatogoniales, sont capables d’acquérir à nouveau un phénotype et un statut biologique de cellules souches en réponse à un stress [
11]. Des myotubes multinucléés issus de la différenciation de cellules musculaires peuvent, sous l’effet de la reversine, un analogue purinique [
12], ou d’extraits de tissus d’amphibiens en phase de régénération [
13], se dédifférencier en cellules souches mononucléées. De multiples autres exemples ont été décrits [
14–
17]. Ce processus de dédifférenciation existe donc chez les mammifères, même si son incidence est très faible [ 3,
18]. Transdifférenciation On appelle transdifférenciation le processus au cours duquel une cellule mature d’un lignage tissulaire donné (par exemple hématopoïétique) acquiert les caractéristiques d’une cellule mature d’un autre lignage tissulaire (par exemple cerveau). On a longtemps considéré les CSH comme incapables de se différencier en d’autres cellules qu’hématopoïétiques. Certains travaux pourtant ont suggéré que la moelle osseuse était la source de cellules de type musculaire [
19,
20], neural [
21] ou hépatique [
22], mais il était difficile de conclure que ces cellules avaient pour origine les CSH elles-mêmes. En effet, la moelle osseuse contient aussi des CSM, et on connaît la capacité de ces progéniteurs à s’engager dans des voies de différenciation inattendues, y compris épithéliales [
23], photorécepteurs [
24], rénales [
25], hépatocytaire [
26]. Certaines sous-populations de CSM (par exemple les MAPC ou multipotent adult progenitor cells) seraient capables de se différencier en types cellulaires caractéristiques des 3 feuillets embryonnaires, y compris en CSH capables de reconstitution à long terme [
27]. Quant à la réalité d’une transdifférenciation des CSH, elle avait été contestée à l’époque et on avait attribué les observations à l’existence d’un processus de fusion cellulaire (entre par exemple monocytes et hépatocytes) suivi d’une reprogrammation des cellules. Pourtant, l’analyse de cellules individuelles semblerait confirmer la transdifférenciation de CSH en fibroblastes et myofibroblastes [
28] et leur production de cellules hépatiques [
29] et de l’endothélium lymphatique [
30]. Un processus de transdifférenciation de cellules issues d’autres tissus que la moelle osseuse a aussi été décrit, et dans certains cas, l’environnement - par exemple celui de la glande mammaire - aurait une action inductive sur ce processus [
31]. Reprogrammation Une fusion cellulaire pouvait expliquer certaines observations étiquetées transdifférenciation : par exemple, des CSE fusionnées avec des cellules différenciées les reprogramment en cellules pluripotentes [
32] et l’analyse d’animaux chimériques a confirmé la reprogrammation de cellules dérivées de la moelle osseuse qui avaient fusionné avec d’autres cellules tissulaires [
33–
35]. La reprogrammation la plus impressionnante est celle qui se produit lors du transfert d’un noyau somatique dans un ovocyte [
36] ou après le transfert de gènes pluripotents dans une cellule reprogrammée en cellule souche pluripotente dite iPS (induced pluripotent stem cells) [
37]. IPS et CSE partagent les mêmes propriétés. Une reprogrammation moins artificielle et aggressive s’observe lors de la reprogrammation des cellules germinales des ébauches gonadiques embryonnaires [
38] ou des progéniteurs des cellules germinales du testicule de souris [
39] en cellules pluripotentes proches des CSE. C’est aussi vrai chez l’homme où des cellules souches spermatogoniales peuvent, sous l’influence des conditions de culture, acquérir également des propriétés de pluripotence proches de celles des CSE [
40]. |
Réversibilité du processus de différenciation et état « souche » La possibilité pour une cellule souche de s’écarter de son chemin traditionnel - celui d’une progression unidirectionnelle irréversible vers un statut de cellules différenciées - et de pouvoir rebrousser chemin, sauter des étapes en aval, voire même faire des pas de côté, suggère qu’elle est dans un état instable, ce qui remet en question notre vision d’une organisation hiérarchique rigide de la différenciation. L’environnement, au même titre que d’autres facteurs intrinsèques, nucléaires ou cytoplasmiques, assure le maintien de la cellule à une place donnée de la cascade de différenciation. Une modification de cet environnement, en cas de stress cellulaire important par exemple, peut faciliter ou déclencher cette « plasticité » qui conduit aux processus de dédifférenciation, transdifférenciation ou reprogrammation. Toutefois, on peut s’étonner que des cellules différenciées puissent acquérir - sous l’effet de molécules très diverses - toute une séquence d’évènements parfaitement ordonnés convergeant vers l’acquisition par un précurseur, voire une cellule complètement mature, d’un état de cellule souche pluripotente complet. Peut-on envisager que toute cellule soit équipée d’un module « de retour à l’état souche » (RtSS pour return to the stem state), sous la forme d’une cassette moléculaire toute équipée pour assurer une reprogrammation vers un état de pluripotence [1] ? Dans des conditions physiologiques, RtSS serait réprimée et donc silencieuse lors de la différenciation, et il est probable que le seuil nécessaire d’évènements stochastiques permettant l’activation de la cassette RtSS serait acquis trop lentement pour qu’un retour spontané vers un état de pluripotence se produise ; les cellules seraient arrêtées à des étapes diverses, aboutissant à des phénotypes de mono- ou bi- ou tri-potentialité. En revanche, si des lésions surviennent, aiguës ou chroniques, la présence de cette cassette constituerait une protection contre leurs conséquences, en permettant l’organisation de stratégies de réparation des dommages causés via la transition de cellules matures vers des cellules souches capables de réparation. L’expression de multiples gènes de différents lignages (promiscuous gene expresssion) serait inhérente à cette propriété de plasticité qui définit l’état de cellule souche : elle lui permet de prendre des décisions très diverses quant à son destin selon les signaux qu’elle reçoit, dont en particulier ceux de l’environnement. Au contraire de ce que nous discutions plus haut sur la qualification de toute cellule comme « la souche de celle qu’elle engendre », on pourrait dire que toute cellule est issue d’une cellule souche pluripotente, et, à ce titre, est déjà différenciée et devrait donc être plutôt qualifiée de progéniteur. Il en est ainsi des CSH et de la majorité des cellules souches adultes. À l’échelon moléculaire, une expression génique à bas bruit, la modulation de l’état épigénétique, les processus de dédifférenciation, transdifférenciation et reprogrammation contribuent tous à cette « plasticité » et à l’acquisition de l’état « souche ». Ce dernier n’est qu’un état transitoire dans la vie d’une cellule, que définit un potentiel parfois très vaste, mais aucune spécialisation. Cela repose une question toujours non résolue : comment peut on identifier les cellules souches in vivo ? La seule définition est rétrospective : lorsque nous évaluons le potentiel d’une population cellulaire, nous concluons à la présence de cellules souches une fois que nous les avons amplifiées et que nous avons caractérisé, au sein de leur descendance, des cellules matures issues des trois feuillets embryonnaires. Mais cette population initiale n’est jamais composée uniquement de cellules pluripotentes et certaines - souvent la majorité - expriment déjà quelques attributs de cellules différenciées. C’est le cas des lignées de cellules souches embryonnaires, pourtant toutes issues de la masse interne de blastocystes, mais qui ne sont pas toutes pluripotentes, et probablement de la majorité des cellules souches avec lesquelles travaillent les chercheurs, plus proche de progéniteurs que de cellules souches au sens strict du terme. Aucun marqueur moléculaire à l’heure actuelle ne permet de définir avec certitude un état pluripotent, espérons que l’analyse « épigénétique » sera en mesure de nous proposer cette définition moléculaire qui nous fait tant défaut aujourd’hui. ‡ |
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1.
Zipori
D
. Biology of stem cells and the molecular basis of the stem state.
New York: : Humana Press (Springer); , 2009 : :278 p.. 2.
Zipori
D
. The hemopoietic stem cell niche versus the microenvironment of the multiple myeloma-tumor initiating cell . Cancer Microenviron.
2010; ; 3 : :15.-28. 3.
Zipori
D
. The nature of stem cells: state rather than entity . Nat Rev Genet.
2004; ; 5 : :873.-878. 4.
Efroni
S
,
Duttagupta
R
,
Cheng
J
, et al.
Global transcription in pluripotent embryonic stem cells . Cell Stem Cell.
2008; ; 2 : :437.-447. 5.
Feinberg
AP
. Phenotypic plasticity and the epigenetics of human disease . Nature.
2007; ; 447 : :433.-440. 6.
Sparmann
A
,
van Lohuizen
M
. Polycomb silencers control cell fate, development and cancer . Nat Rev Cancer.
2006; ; 6 : :846.-856. 7.
Morad
V
,
Pevsner-Fischer
M
,
Barnees
S
, et al.
The myelopoietic supportive capacity of mesenchymal stromal cells is uncoupled from multipotency and is influenced by lineage determination and interference with glycosylation . Stem Cells.
2008; ; 26 : :2275.-2286. 8.
Birnbaum
KD
,
Sanchez Alvarado
A
. Slicing across kingdoms: regeneration in plants and animals . Cell.
2008; ; 132 : :697.-710. 9.
Brockes
JP
,
Kumar
A
. Plasticity and reprogramming of differentiated cells in amphibian regeneration . Nat Rev Mol Cell Biol.
2002; ; 3 : :566.-574. 10.
Tanaka
EM
. Regeneration: if they can do it, why can’t we?
Cell.
2003; ; 113 : :559.-562. 11.
Nakagawa
T
,
Nabeshima
Y
,
Yoshida
S
. Functional identification of the actual and potential stem cell compartments in mouse spermatogenesis . Dev Cell.
2007; ; 12 : :195.-206. 12.
Chen
X
,
Mao
Z
,
Liu
S
, et al.
Dedifferentiation of adult human myoblasts induced by CNTF in vitro
. Mol Biol Cell.
2005; ; 16 : :3140.-3151. 13.
McGann
CJ
,
Odelberg
SJ
,
Keating
MT
. Mammalian myotube dedifferentiation induced by newt regeneration extract . Proc Natl Acad Sci USA.
2001; ; 98 : :13699.-13704. 14.
Kondo
T
,
Raff
M
. Chromatin remodeling and histone modification in the conversion of oligodendrocyte precursors to neural stem cells . Genes Dev.
2004; ; 18 : :2963.-2972. 15.
Matsumoto
T
,
Kano
K
,
Kondo
D
, et al.
Mature adipocyte-derived dedifferentiated fat cells exhibit multilineage potential . Cell Physiol.
2008; ; 215 : :210.-222. 16.
Zipori
D
,
Friedman
A
,
Tamir
M
, et al.
Cultured mouse marrow cell lines: interactions between fibroblastoid cells and monocytes . Cell Physiol.
1984; ; 118 : :143.-152. 17.
Gershengorn
MC
,
Hardikar
AA
,
Wei
C
, et al.
Epithelial-to-mesenchymal transition generates proliferative human islet precursor cells . Science.
2004; ; 406 : :2261.-2264. 18.
Zipori
D
. The stem state: plasticity is essential, whereas self-renewal and hierarchy are optional . Stem Cells.
2005; ; 23 : :719.-726. 19.
Ferrari
G
,
Cusella-De Angelis
G
,
Coletta
M
, et al.
Muscle regeneration by bone marrow-derived myogenic progenitors . Science.
1998; ; 279 : :1528.-1530. 20.
Shimizu
K
,
Sugiyama
S
,
Aikawa
M
, et al.
Host bone-marrow cells are a source of donor intimal smooth- muscle-like cells in murine aortic transplant arteriopathy . Nat Med.
2001; ; 7 : :738.-741. 21.
Chen
SK
,
Tvrdik
P
,
Peden
E
, et al.
Hematopoietic origin of pathological grooming in Hoxb8 mutant mice . Cell.
2010; ; 141 : :775.-785. 22.
Petersen
BE
,
Bowen
WC
,
Patrene
KD
, et al.
Bone marrow as a potential source of hepatic oval cells . Science.
1999; ; 284 : :1168.-1170. 23.
Spees
JL
,
Olson
SD
,
Ylostalo
J
, et al.
Differentiation, cell fusion, and nuclear fusion during ex vivo repair of epithelium by human adult stem cells from bone marrow stroma . Proc Natl Acad Sci USA.
2003; ; 100 : :2397.-2402. 24.
Kicic
A
,
Shen
WY
,
Wilson
AS
, et al.
Differentiation of marrow stromal cells into photoreceptors in the rat eye . Neurosci.
2003; ; 23 : :7742.-7749. 25.
Yokoo
T
,
Ohashi
T
,
Shen
JS
, et al.
Human mesenchymal stem cells in rodent whole-embryo culture are reprogrammed to contribute to kidney tissues . Proc Natl Acad Sci USA.
2005; ; 102 : :3296.-3300. 26.
Sato
Y
,
Araki
H
,
Kato
J
, et al.
Human mesenchymal stem cells xenografted directly to rat liver are differentiated into human hepatocytes without fusion . Blood.
2005; ; 106 : :756.-763. 27.
Serafini
M
,
Dylla
SJ
,
Oki
M
, et al.
Hematopoietic reconstitution by multipotent adult progenitor cells: precursors to long-term hematopoietic stem cells . Exp Med.
2007; ; 204 : :129.-139. 28.
Ogawa
M
,
LaRue
AC
,
Drake
CJ
. Hematopoietic origin of fibroblasts/myofibroblasts: its pathophysiologic implications . Blood.
2006; ; 108 : :2893.-2896. 29.
Jang
YY
,
Collector
MI
,
Baylin
SB
, et al.
Hematopoietic stem cells convert into liver cells within days without fusion . Nat Cell Biol.
2004; ; 6 : :532.-539. 30.
Jiang
S
,
Bailey
AS
,
Goldman
DC
, et al.
Hematopoietic stem cells contribute to lymphatic endothelium . PLoS One. , 2008; ; 3 : :e3812.. 31.
Booth
BW
,
Mack
DL
,
Androutsellis-Theotokis
A
, et al.
The mammary microenvironment alters the differentiation repertoire of neural stem cells . Proc Natl Acad Sci USA.
2008; ; 105 : :14891.-14896. 32.
Cowan
CA
,
Atienza
J
,
Melton
DA
,
Eggan
K
. Nuclear reprogramming of somatic cells after fusion with human embryonic stem cells . Science.
2005; ; 309 : :1369.-1373. 33.
Alvarez-Dolado
M
,
Pardal
R
,
Garcia-Verdugo
JM
, et al.
Fusion of bone-marrow-derived cells with Purkinje neurons, cardiomyocytes and hepatocytes . Nature.
2003; ; 425 : :968.-973. 34.
Vassilopoulos
G
,
Wang
PR
,
Russell
DW
. Transplanted bone marrow regenerates liver by cell fusion . Nature.
2003; ; 422 : :901.-904. 35.
Wang
X
,
Willenbring
H
,
Akkari
Y
, et al.
Cell fusion is the principal source of bone-marrow-derived hepatocytes . Nature.
2003; ; 422 : :897.-901. 36.
Inoue
K
,
Wakao
H
,
Ogonuki
N
, et al.
Generation of cloned mice by direct nuclear transfer from natural killer T cells . Curr Biol.
2005; ; 15 : :1114.-1118. 37.
Takahashi
K
,
Yamanaka
S
. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors . Cell.
2006; ; 126 : :663.-676. 38.
Shamblott
MJ
,
Axelman
J
,
Wang
S
, et al.
Derivation of pluripotent stem cells from cultured human primordial germ cells . Proc Natl Acad Sci USA.
1998; ; 95 : :13726.-13731. 39.
Guan
K
,
Nayernia
K
,
Maier
LS
, et al.
Pluripotency of spermatogonial stem cells from adult mouse testis . Nature.
2006; ; 440 : :1199.-1203. 40.
Kossack
N
,
Meneses
J
,
Shefi
S
, et al.
Isolation and characterization of pluripotent human spermatogonial stem cell-derived cells . Stem Cells.
2009; ; 27 : :138.-149. |