| |
| Med Sci (Paris). 2011 April; 27(4): 365–368. Published online 2011 April 28. doi: 10.1051/medsci/2011274011.Récepteur β2-adrénergique et β-arrestines Les instruments du méningocoque pour le « casse » des méninges Mathieu Coureuil1 and Stefano Marullo2* 1Université Paris Descartes, faculté de médecine, Inserm U1002, Paris, France 2Université Paris Descartes, faculté de médecine, CNRS UMR 8104, Inserm U1016, Institut Cochin, 27, rue du Faubourg Saint-Jacques, 75014, Paris, France |
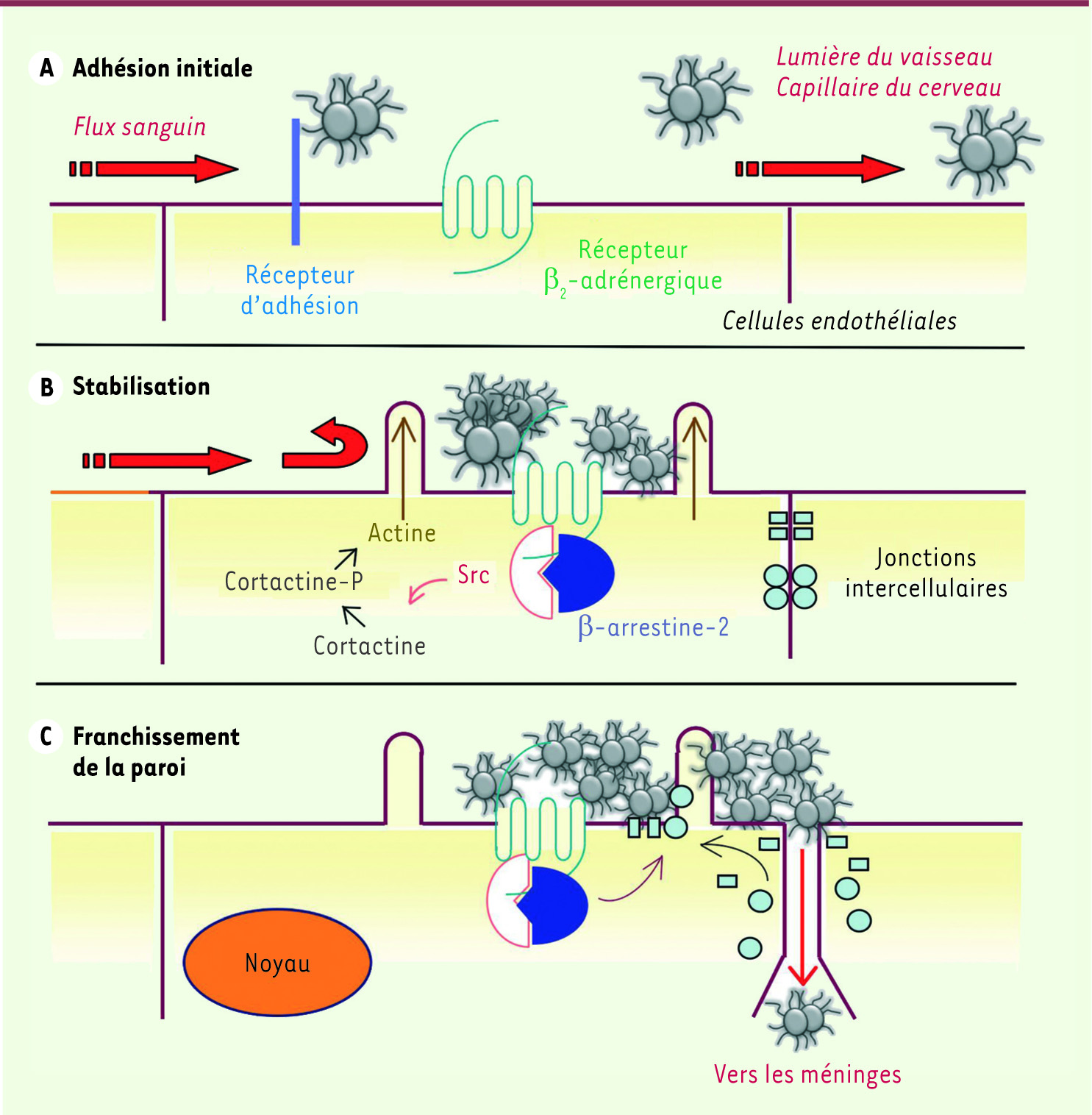
Fixation des méningocoques aux récepteurs β 2-adrénergiques des capillaires du cerveau Les mécanismes cellulaires et moléculaires qui permettent au méningocoque de franchir l’endothélium des capillaires cérébraux sont complexes. Après une première interaction avec un récepteur d’adhésion, la bactérie déclenche de multiples signaux dans la cellule endothéliale hôte en activant des récepteurs à la surface. En réponse à l’activation de ces voies de signalisation, la cellule hôte forme de fines protrusions digitiformes de la membrane plasmique contenant de l’actine polymérisée, qui stabilisent les colonies bactériennes à la surface des cellules endothéliales et leur permettent de résister au flux sanguin [
1,
2]. Les signaux déclenchés par le méningocoque aboutissent également à l’accumulation de protéines cellulaires au niveau de la membrane plasmique se trouvant juste en dessous de la colonie bactérienne en train de grossir. Parmi celles-ci figurent des protéines qui assurent l’étanchéité de l’endothélium au niveau des jonctions intercellulaires, comme la VE-cadhérine ou la p120 caténine. La délocalisation de ces protéines d’adhésion aboutit progressivement au relâchement des jonctions intercellulaires juste en dessous de la colonie bactérienne, puis à leur ouverture, permettant à quelques bactéries de passer et d’infecter les méninges [
3,
4]. Une étape importante dans la compréhension de ces phénomènes manquait : le ou les récepteurs cellulaires détournés par le méningocoque et les premiers signaux biochimiques d’enclenchement du processus infectieux étaient toujours inconnus. Une étude récente [
5] de notre laboratoire a démontré l’existence de deux récepteurs distincts pour le méningocoque. Après fixation sur un premier récepteur d’adhésion, qui reste encore inconnu, la bactérie active un second récepteur, présent à la surface des cellules endothéliales des capillaires du cerveau, le récepteur β2-adrénergique (Figure 1). Ce récepteur, qui est physiologiquement activé par l’adrénaline, fait partie de la superfamille des récepteurs à sept domaines transmembranaires, également connus sous le nom de récepteurs couplés aux protéines G ou RCPG. Le récepteur β2-adrénergique activé propage des signaux intracellulaires via la protéine hétérotrimérique Gs qui stimule la production d’AMPc par les adénylates cyclases. Il recrute aussi les β-arrestines, des protéines qui limitent son activité dans le temps et servent de pont moléculaire avec la machinerie d’endocytose cellulaire, ce qui aboutit à l’internalisation du récepteur β2-adrénergique via les puits recouverts de clathrine [
6,
7]. Les β-arrestines sont également des protéines d’échafaudage capables d’assembler des complexes multimoléculaires et de déclencher des voies de signalisation, comme l’activation des MAP kinases ou celle de la tyrosine kinase Src [
8]. C’est justement Src qui constitue un maillon essentiel de la chaîne d’événements déclenchée par la bactérie. L’activation de Src par les β-arrestines induit la phosphorylation de la cortactine, une protéine régulant la polymérisation de l’actine, et la formation des protrusions de la membrane qui protègent la colonie de l’effet dispersant du flux sanguin. Ce sont toujours les β-arrestines qui vont attirer sous la colonie, par interaction directe, les protéines des jonctions intercellulaires déterminant ainsi l’ouverture des espaces intercellulaires sous la colonie.
 | Figure 1
Les trois étapes du franchissement de la barrière endothéliale par le méningocoque. A. Les bactéries interagissent initialement avec un récepteur d’adhésion non encore identifié présent à la surface des cellules endothéliales. B. L’interaction qui suit avec le récepteur β2-adrénergique déclenche une voie de signalisation biaisée vers le recrutement des β-arrestines. Ces dernières fixent et activent la tyrosine kinase Src qui phosphoryle la cortactine qui est alors activée. La cortactine phosphorylée favorise localement la polymérisation de l’actine et donc la formation de bourgeonnements de la membrane plasmique de la cellule hôte qui enchâssent les bactéries de la colonie en expansion et les protègent du flux sanguin. C. Les récepteurs et les β-arrestines ne pouvant se dissocier des bactéries, s’accumulent sous la colonie et recrutent localement d’autres protéines de la cellule hôte. L’état d’équilibre biochimique est rompu et progressivement toutes ces protéines s’accumulent aussi sous la colonie, finissant par provoquer la déplétion d’autres compartiments cellulaires. Ainsi, les protéines d’adhésion intercellulaire comme la VE-cadhérine ou la p120 caténine disparaissent des jonctions cellulaires qui deviennent lâches et perméables, pour laisser finalement passer quelques bactéries vers les méninges. |
|
L’activation « biaisée » du récepteur β 2-adrénergique par les pili des méningocoques Une analyse moléculaire fine a permis de comprendre le mécanisme d’activa- tion du récepteur β2-adrénergique par le méningocoque. Cette bactérie possède de longs appendices filamenteux, les pili e type 4, qui lui permettent d’interagir avec son environnement et sont indispensables à la pathogénicité [
9]. Ces pili sont constitués de protéines appelées pilines qui se polymérisent et s’assemblent en faisceaux. Au moins deux pilines, PilE et PilV peuvent interagir avec le récepteur β2-adrénergique et sont capables à elles seules d’induire in vitro le recrutement des β-arrestines. Côté récepteur, c’est sa région extracellulaire amino-terminale qui est nécessaire et suffisante à l’interaction avec la bactérie. Le transfert de cette région par génie génétique sur un autre RCPG qui n’est pas utilisable par le méningocoque pour déclencher un signal dans la cellule hôte, rend le récepteur chimère activable par la bactérie. L’activation du récepteur β2-adrénergique par le méningocoque est de type allostérique. Elle n’implique pas du tout le site de liaison des ligands naturels du récepteur (le site orthostérique) - qui peut même être occupé par un bloqueur - et provoque vraisemblablement un changement de conformation différent de celui des ligands habituels, mais qui rend tout de même le récepteur capable de recruter les β-arrestines. Il s’agit d’un exemple d’activation biaisée. On entend par ce terme un type d’activation du récepteur qui ne va pas déclencher la totalité de la palette des effets cellulaires possibles, telle qu’observable avec les ligands naturels, mais seulement une fraction de ces effets. Ainsi le méningocoque n’a aucun effet sur la voie de signalisation passant par la protéine Gs et n’affecte pas le taux d’AMPc intracellulaire. De façon intéressante, le prétraitement des cellules endothéliales par des agents pharmacologiques capables d’induire l’internalisation du récepteur β2-adrénergique inhibe quasi-complètement la formation des protrusions cellulaires stabilisant les colonies de méningocoque et l’ouverture des espaces intercellulaires. Ce phénomène est dû à l’internalisation du récepteur et donc à la diminution du nombre de sites récepteurs disponibles pour la bactérie à la surface des cellules hôtes. Ainsi, à côté de l’antibiothérapie anti-bactérienne traditionnelle, l’utilisation de composés ciblant le récepteur β2-adrénergique et induisant son endocytose pourrait se démontrer utile dans le traitement des formes les plus graves de méningite qui s’accompagnent de choc septique. Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Eugene
E
,
Hoffmann
I
,
Pujol
C
, et al.
Microvilli-like structures are associated with the internalization of virulent capsulated Neisseria meningitidis into vascular endothelial cells . J Cell Sci.
2002; ; 115 : :1231.-1241. 2.
Mikaty
G
,
Soyer
M
,
Mairey
E
, et al.Extracellular bacterial pathogen induces host cell surface reorganization to resist shear stress . PLoS Pathog.
2009; ; 5 : :e1000314.. 3.
Coureuil
M
,
Mikaty
G
,
Miller
F
, et al.
Meningococcal type IV pili recruit the polarity complex to cross the brain endothelium . Science.
2009; ; 325 : :83.-87. 4.
Coureuil
M
,
Nassif
X
. La ruse du méningocoque . Med Sci (Paris).
2010; ; 26 : :15.-17. 5.
Coureuil
M
,
Lécuyer
H
,
Scott
MGH
, et al.
Meningococcus hijack a β2-adrenoceptor- β-arrestin pathway to cross brain microvasculature endothelium . Cell.
2010; ; 143 : :1149.-1160. 6.
Scott
MG
,
Benmerah
A
,
Muntaner
O
, et al.
Recruitment of activated G protein-coupled receptors to preexisting clathrin-coated pits in living cells . J Biol Chem.
2002; ; 277 : :3552.-3559. 7.
Scott
MG
,
Benmerah
A
,
Marullo
S
. Endocytose des récepteurs couplés aux protéines G . Med Sci (Paris).
2004; ; 20 : :78.-83. 8.
Luttrell
LM
,
Gesty-Palmer
D
. Beyond desensitization: physiological relevance of arrestin-dependent signaling . Pharmacol Rev.
2010; ; 62 : :305.-330. 9.
Craig
L
,
Pique
ME
,
Tainer
JE
. Type IV pilus structure and bacterial pathogenicity . Nat Rev Microbiol.
2004; ; 2 : :363.-378. |