| |
| Med Sci (Paris). 2011 June; 27(6-7): 590–592. Published online 2011 July 1. doi: 10.1051/medsci/2011276010.L’arrondissement des cellules en mitose Matthieu Piel1* and Jean-François Joanny2** 1Département compartimentation et dynamique cellulaire, Institut Curie/CNRS UMR 144, Institut Curie26, rue d’Ulm75248Paris Cedex 05, France 2Physicochimie Curie - Institut Curie/CNRS UMR 168/UPMC26, rue d’Ulm75248Paris Cedex 05, France |
La physique de l’arrondissement des cellules en mitose Les expériences sont effectuées avec un microscope à force atomique sans pointe, que l’on pourrait donc schématiser comme un petit levier plat qui appuie sur la cellule. Le principe de l’expérience est d’étudier des cellules étalées sur une surface en positionnant le levier parallèle à la surface à une distance fixe de celle-ci (8 micromètres) et en mesurant la force exercée à distance constante par la cellule sur le levier. Quand la cellule est étalée, elle ne touche pas le levier et aucune force n’est transmise. Quand la cellule s’arrondit, elle atteint le levier et exerce une force qui est mesurée par la déflexion du levier. La technique de microscopie à force atomique permet de mesurer des déflexions du levier extrêmement faibles ; dans ces expériences, elles sont de l’ordre du nanoNewton (10−9N). Le positionnement très précis du levier permet aussi une mesure de la hauteur de la cellule avec une précision nanométrique. En parallèle, les auteurs mesurent la taille de la cellule par microscopie optique et obtiennent donc une valeur précise du volume de la cellule.  | Figure 1
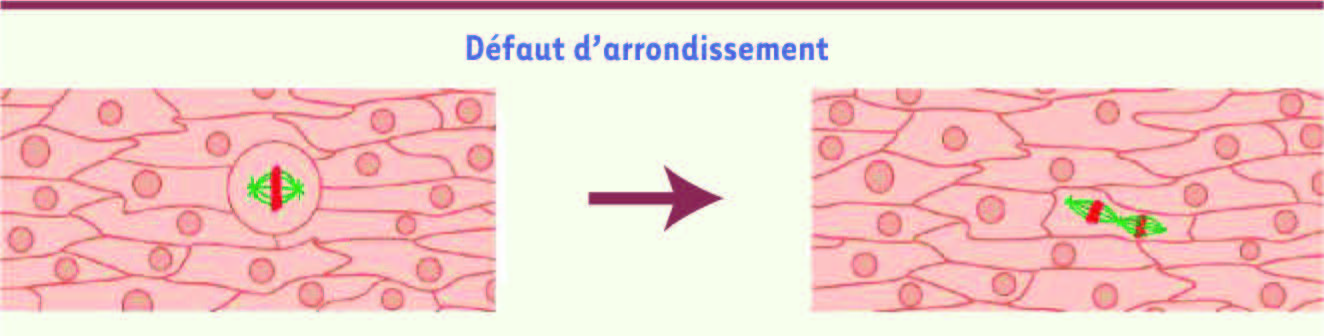
Arrondissement en mitose et assemblage du fuseau mitotique. Une cellule qui se divise dans un tissu est contrainte par ses voisines. Lorsqu’elle se divise, son arrondissement, lié à l’augmentation de la force qu’elle applique, lui permet d’assurer un espace suffisant pour assembler le fuseau mitotique (dessin de gauche, microtubules en vert et plaque métaphasique en rouge). Une cellule qui ne pourrait pas s’arrondir correctement risque de présenter des défauts d’assemblage du fuseau mitotique (dessin de droite) (schémas réalisés par Maël Le Berre). |
Dans une expérience typique effectuée sur des cellules Hela, la force exercée par la cellule est nulle avant l’entrée en mitose et augmente quand la cellule s’arrondit. Elle atteint un maximum de l’ordre de 80 nanoNewtons (nN) en métaphase puis décroît. Les cellules sont pratiquement sphériques lors de la mitose avec un rapport d’aspect (hauteur/rayon) égal à 0,84 en métaphase. En divisant la force maximale par l’aire de contact entre la cellule et le levier, les auteurs calculent une pression d’arrondissement qui est de l’ordre de 0,2 nN∕mm2, soit 200 Pa. Les auteurs ont aussi effectué l’expérience en détachant une cellule en interphase avec de la trypsine. La cellule s’arrondit alors et exerce une force faible sur le levier (inférieure à 20 nanoNewtons) avant son entrée en mitose. Une fois en mitose, elle exerce aussi une force maximale de l’ordre de 80 nanoNewtons. |
Tension corticale et loi de Laplace Deux phénomènes jouent un rôle important pour produire ces forces : la pression osmotique et la tension du cortex de la cellule qui est en grande partie déterminée par la couche corticale d’actine et de myosine. L’effet de la couche corticale peut être compris par analogie avec une petite goutte d’huile. La surface d’une goutte d’huile est sous tension et la pression est plus grande à l’intérieur de la goutte que la pression extérieure, comme la pression dans un ballon est plus grande que la pression extérieure à cause de la tension de la membrane élastique du ballon. La différence de pression ΔP est donnée par la loi de Laplace ΔP = 2g/R où g est la tension de surface et R le rayon de la goutte. La tension de surface s’oppose aux déformations de la goutte et tend à minimiser l’aire de la goutte, ce qui lui donne une forme sphérique. Une hypothèse assez généralement admise est que la tension de surface de la cellule est dominée par les contraintes contractiles dues aux myosines dans la couche d’actine corticale. Cette hypothèse est amplement vérifiée dans l’article où les propriétés de la couche corticale sont modulées par des inhibiteurs de l’actine ou de la myosine. Notons cependant que la tension n’est pas entièrement due à la couche corticale mais que la membrane a une contribution, faible, à la tension de la cellule. En utilisant la loi de Laplace et en utilisant comme ordre de grandeur de la différence de pression la pression d’arrondissement des cellules on obtient une tension de la cellule de l’ordre de 1mN∕m. |
Le deuxième paramètre physique discuté dans l’article est la pression osmotique. La pression osmotique s’équilibre entre les deux côtés d’une membrane par perméation de l’eau à travers la membrane. Lorsque l’équilibre est atteint, la différence de pression osmotique Δp impose une différence de pression entre l’intérieur et l’extérieur de la cellule qui est précisément égale à la différence de pression osmotique. Imposer une différence de pression osmotique revient donc à imposer une différence de pression. La pression osmotique dans la cellule est dominée par les petits ions et ne dépend que de la concentration en ions. Quand le volume de la cellule augmente, l’eau rentre dans la cellule et la concentration en ions diminue, la pression osmotique diminue. Les expériences de l’article visent à montrer le rôle de la pression osmotique en rendant le milieu externe hypotonique (avec une pression osmotique plus faible) ou hypertonique, ou en diminuant la pression osmotique interne de la cellule en perturbant le comportement des canaux ioniques. Toutes les expériences présentées dans l’article sont cohérentes avec la loi de Laplace et l’effet de dilution ou de concentration des ions quand le volume de la cellule change. À tension corticale constante, le rayon de la cellule diminue si la pression osmotique externe à la cellule augmente, car l’eau sort de la cellule pour équilibrer les pressions s. Cette diminution du rayon est associée à une diminution de la force mesurée sur le levier. En gardant la pression osmotique externe constante, les auteurs ont aussi fait varier la tension corticale de cellule. La tension est diminuée en ajoutant des drogues qui soit dépolymérisent l’actine, soit diminuent l’activité des myosines. La diminution de la tension est associée à une augmentation du rayon de la cellule qui s’explique en prenant en compte le changement de la pression osmotique interne de la cellule. En conclusion, grâce à la très grande précision à la fois des mesures de force et des mesures de volume de la cellule, l’article de M.P. Stewart et al. montre sans ambiguïté l’effet de la pression osmotique et de la couche corticale d’actine myosine sur l’arrondissement des cellules en mitose. Tous ces effets sont en accord avec la loi classique de Laplace en supposant qu’il y a équilibre osmotique et que la tension de la cellule est due à la contractilité des myosines dans la couche d’actine corticale. Une vérification quantitative de la loi de Laplace nécessiterait une mesure directe de cette tension. |
Fonction de l’arrondissement mitotique Cet article démontre donc clairement que la cellule ne s’arrondit pas simplement par détachement du substrat, mais par changement d’organisation de son cortex et augmentation de sa pression osmotique. Cela permet à la cellule d’exercer une force importante sur son environnement. Pourquoi la cellule a-t-elle besoin d’exercer cette force lorsqu’elle se divise ? Ce point n’est que brièvement abordé dans l’article, mais la littérature sur le sujet, bien que peu abondante, nous permet d’avancer les hypothèses qui suivent. |
Faire de la place au fuseau mitotique Les cellules dans un tissu sont contraintes par leurs voisines et par la matrice extracellulaire. Or la mitose est un moment crucial du cycle de division cellulaire pendant lequel le matériel génétique doit être séparé de manière précise entre les deux cellules filles. Cette séparation est assurée par une structure complexe, le fuseau mitotique, qui pourrait avoir besoin d’un espace libre de contraintes extérieures le temps de s’assembler et de séparer les chromosomes. L’arrondissement de la cellule mitotique pourrait donc avoir pour fonction de générer un espace protégé au sein du tissu. Pourquoi la cellule utilise-t-elle ce mécanisme original, impliquant une augmentation de la pression osmotique ? Le cytosquelette permet à la cellule d’exercer des forces sur son environnement, mais ces forces sont le plus souvent des forces contractiles (générées par le couple actine/myosine). Cependant, lors de l’arrondissement de la cellule en mitose, celle-ci a le plus souvent besoin de pousser ses voisines pour se faire de la place. La pression osmotique semble alors la meilleure option. Les forces produites par augmentation de la pression osmotique peuvent en effet atteindre des valeurs très élevées, comme celles qu’exercent les racines des plantes ou les champignons, capables d’envahir des terrains très durs. Ces forces ne sont limitées que par la capacité de la cellule à les contenir. Les plantes et les champignons ont pour ce faire des parois extrêmement rigides, ce qui n’est pas le cas de nos cellules. C’est pourquoi les cellules mitotiques, pour contenir l’accroissement de pression osmotique, renforcent leur coque intracellulaire (le cortex) constituée d’actine et de myosine mais aussi de protéines associées comme les protéines de la famille ezrine-radexine-moesine. L’importance de ces protéines dans la résistance des cellules mitotiques a déjà été démontrée [
2]. Ainsi, lorsque le cortex est perturbé, il se casse lors de l’entrée en mitose et la cellule forme des blebs, extensions membranaires dépourvues de cortex, ce qui entraîne une chute de la force exercée par la cellule et permet de la réguler. |
Conséquences d’une altération de l’arrondissement cellulaire Quelles sont les conséquences physiologiques d’une perturbation de ce mécanisme d’arrondissement mitotique ? Deux articles publiés en 2008 [2,
3] en donnent une idée : le fuseau mitotique perd sa position centrée dans la cellule, et son orientation et son assemblage sont affectés, conduisant à des divisions anormales. Un article plus récent [
4] étudie le phénomène dans un tissu (peau de souris) et démontre que lorsque l’arrondissement des cellules mitotiques est perturbé, le tissu est très fortement affecté à cause d’un problème d’orientation des divisions dans la couche proliférative de cellules. Ce défaut d’orientation est accompagné d’un accroissement de l’apoptose et des divisions cellulaires et de problèmes de différenciation des cellules souches. L’arrondissement des cellules en mitose semble donc bien un élément essentiel au bon déroulement de la division cellulaire. Il est possible que les cellules cancéreuses, qui ont souvent plus de chromosomes que les cellules normales (et qui ont donc potentiellement besoin de plus d’espace pour assembler leur fuseau mitotique) et qui prolifèrent dans un environnement en général plus rigide (les tumeurs sont souvent plus dures que le tissu environnant), soient encore plus sensibles que les cellules normales à des défauts d’arrondissement mitotique. L’article de Stewart et al. [4] constitue une première étape dans l’identification des mécanismes moléculaires qui sont à l’origine de ce phénomène d’arrondissement mitotique, élément crucial du bon déroulement de la division cellulaire. Découvrir les protéines spécifiquement impliquées pourrait permettre d’identifier de nouvelles cibles pour des molécules antitumorales. Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Stewart
MP
,
Helenius
J
,
Toyoda
Y
, et al.
Hydrostatic pressure and the actomyosin cortex drive mitotic cell rounding . Nature.
2011; ; 469 : :226.-230. 2.
Kunda
P
,
Pelling
AE
,
Liu
T
,
Baum
B
. Moesin controls cortical rigidity, cell rounding, and spindle morphogenesis during mitosis . Curr Biol.
2008; ; 18 : :91.-101. 3.
Carreno
S
,
Kouranti
I
,
Glusman
ES
, et al.
Moesin and its activating kinase Slik are required for cortical stability and microtubule organization in mitotic cells . J Cell Biol.
2008; ; 180 : :739.-746. 4.
Luxenburg
C
,
Amalia Pasolli
H
,
Williams
SE
,
Fuchs
E
. Developmental roles for Srf, cortical cytoskeleton and cell shape in epidermal spindle orientation . Nat Cell Biol.
2011; ; 13 : :203.-214. |