| |
| Med Sci (Paris). 2011 October; 27(10): 875–881. Published online 2011 October 21. doi: 10.1051/medsci/20112710016.Origine endothéliale des cellules souches hématopoïétiques La preuve en image Jean-Charles Boisset1 and Catherine Robin 1* 1Erasmus Stem Cell Institute, Department of Cell Biology, Erasmus Medical Center, Rotterdam, Pays-Bas |
Un siècle après la découverte des cellules souches hématopoïétiques La notion de cellule souche date de plus d’un siècle. L’Allemand F.E.C. Neumann (1834-1918) a été le premier à postuler à la fin du xix
e siècle que la moelle osseuse était l’organe de formation du sang. Il a également proposé une théorie, controversée à l’époque, selon laquelle une cellule souche pourrait être à l’origine de toutes les lignées sanguines. Cette théorie fondatrice de l’existence de cellules souches hématopoïétiques (CSH) a depuis été validée. Les CSH ont la capacité de s’autorenouveler, ce qui permet de maintenir constant leur nombre durant toute la vie d’un individu. Elles ont également la capacité de donner naissance à toutes les cellules hématopoïétiques matures circulantes, via la production de progéniteurs qui se différencient à leur tour en cellules des lignées myéloïdes et lymphoïdes. Les progéniteurs, contrairement aux CSH, ne s’autorenouvellent pas. Les CSH sont donc à l’origine de la fabrication continue et régulée des cellules sanguines indispensables à la vie. Les CSH constituent l’élément-clé des greffons utilisés à des fins thérapeutiques : la moelle osseuse, le sang périphérique après mobilisation des cellules médullaires1 et le sang de cordon ombilical sont des sources de CSH utilisées pour les transplantations dans les déficits constitutionnels ou acquis du tissu hématopoïétique, les hémopathies (par exemple : leucémies) ou comme adjuvant dans le traitement des tumeurs solides. Les CSH sont toutefois en quantité très restreinte, ce qui limite considérablement leur étude et leur utilisation. Malgré une connaissance de plus en plus précise de la régulation des CSH, notamment chez l’adulte, il est toujours très difficile de reproduire in vitro les conditions appropriées à leur survie et leur expansion sans induire leur différenciation ou leur transformation maligne. Il est également impossible de générer efficacement des CSH in vitro, y compris à partir de cellules souches embryonnaires (CSE) ou de cellules souches pluripotentes reprogrammées (iPS, induced pluripotent stem). Une connaissance plus approfondie de l’origine des CSH adultes, ainsi que des mécanismes régulateurs contrôlant leurs production, survie et expansion, reste donc toujours d’actualité et d’une grande importance tant d’un point de vue fondamental que clinique. |
Les cellules souches hématopoïétiques adultes sont produites au cours du développement embryonnaire Bien que localisées dans la moelle osseuse chez l’adulte, les CSH ne sont pas originaires de ce tissu. D’origine mésodermique, elles émergent durant la vie embryonnaire, période pendant laquelle elles transitent par plusieurs sites hématopoïétiques avant de finalement coloniser la moelle osseuse avant la naissance [
1,
2]. Étudier la mise en place du système hématopoïétique au cours du développement est essentiel, car contrairement au microenvironnement médullaire adulte, l’embryon pourvoit un microenvironnement singulier permettant non seulement la production, mais également l’expansion massive des CSH. Les premières cellules hématopoïétiques commencent à apparaître dans le sac vitellin (SV), tissu extraembryonnaire, à partir du jour embryonnaire (E) 7-7,5 du développement de la souris [
3]. De petits agrégats de cellules initialement homogènes forment progressivement des structures, appelées îlots sanguins, qui sont constituées de larges érythrocytes nucléés entourés d’une couche de cellules endothéliales. Les deux types de cellules, hématopoïétiques et endothéliales, ont ainsi dans le SV un précurseur commun appelé hémangioblaste [
4]. Des cellules matures (macrophages, mégacaryocytes) et des progéniteurs ayant un potentiel de différenciation lympho-myéloïde varié sont également produits in situ [3,
5]. Dans les années 1970, le dogme suivant lequel les CSH étaient probablement aussi originaires du SV était donc logique et assez consensuel. Toutefois, l’analyse de l’émergence de l’hématopoïèse dans des modèles non-mammifères a remis ce dogme en question. En effet, les travaux pionniers effectués sur l’embryon d’oiseau, et notamment la création de chimères dans lesquelles un embryon de caille était greffé sur un SV de poulet après excision de l’embryon de poulet, ont clairement démontré que les CSH avaient une origine intraembryonnaire, et plus précisément restreinte à la région de l’aorte [
6]. Ces résultats ont été confirmés chez l’embryon d’amphibien en utilisant une approche similaire [
7]. Il est ainsi apparu que la production hématopoïétique dans le SV, initialement indispensable à la survie et au bon développement de l’embryon, n’est que transitoire et ne participe pas à l’hématopoïèse adulte. Des greffes similaires sont techniquement irréalisables chez les embryons de mammifères en raison de leur développement intra-utérin. L’identification des CSH de mammifères nécessite un test in vivo consistant à injecter par voie veineuse les cellules à tester dans des souris hôtes adultes irradiées. La présence de CSH dans le greffon est responsable d’une reconstitution hématopoïétique multilignée (lignées lymphoïdes et myéloïdes) à long terme (ce terme définit un délai au-delà de 4 mois) originaire du donneur. Des transplantations secondaires (utilisant comme greffon la moelle du receveur primaire) sont également effectuées pour tester la capacité d’autorenouvellement des cellules à tester. Plus de vingt ans après les travaux réalisés chez l’oiseau, la présence de CSH a été testée dans différents tissus murins d’origine intra- ou extraembryonnaire. Il a ainsi été suggéré que les CSH avaient également une origine intraembryonnaire chez les mammifères. Les premières CSH sont ainsi détectées dans l’aorte dorsale de l’embryon de souris (région aorte-gonade-mésonéphros ou AGM) à partir de E10,5 [
8–
10]. Les CSH sont également présentes dans les artères vitellines et ombilicales et, un jour plus tard, dans le sac vitellin, le placenta et le foie fœtal (> E11-11,5) [10–
12]. C’est dans ces deux derniers sites que les CSH vont proliférer pour constituer un stock suffisant de cellules souches qui coloniseront la moelle osseuse en fin de gestation. L’analyse histologique d’embryons au stade où les premières cellules hématopoïétiques commencent à être détectées a révélé la présence d’amas de cellules attachés à l’endothélium ventral de l’aorte et des artères vitellines et ombilicales, ainsi que dans le labyrinthe vasculaire du placenta [
13]. Ces amas cellulaires ou clusters sont détectés dans de très nombreuses espèces [
14]. Les cellules des clusters coexpriment des marqueurs hématopoïétiques (par exemple c-kit [récepteur du stem cell factor], CD41 [glycoprotéine IIb-IIIa plaquettaire]) et endothéliaux (par exemple CD31 [ou PECAM, platelet endothelial cell adhesion molecule], Tie-2 [récepteur de l’angiopoïétine]) [
15]. De plus, ces clusters sont totalement absents dans les embryons présentant un défaut hématopoïétique (par exemple les mutants dépourvus du facteur de transcription Runx1 [
16]). Ces observations ont conduit à la conclusion que les CSH résidaient probablement dans ces clusters intra-artériels. Des clusters extravasculaires formés de cellules hématopoïétiques entourées de cellules endothéliales (similaires aux îlots sanguins du sac vitellin) ont également été observés lors du remodelage de l’artère vitelline en milieu de gestation [
17]. Toutefois, le rôle et la composition hématopoïétique exacte de ces clusters restent incertains. |
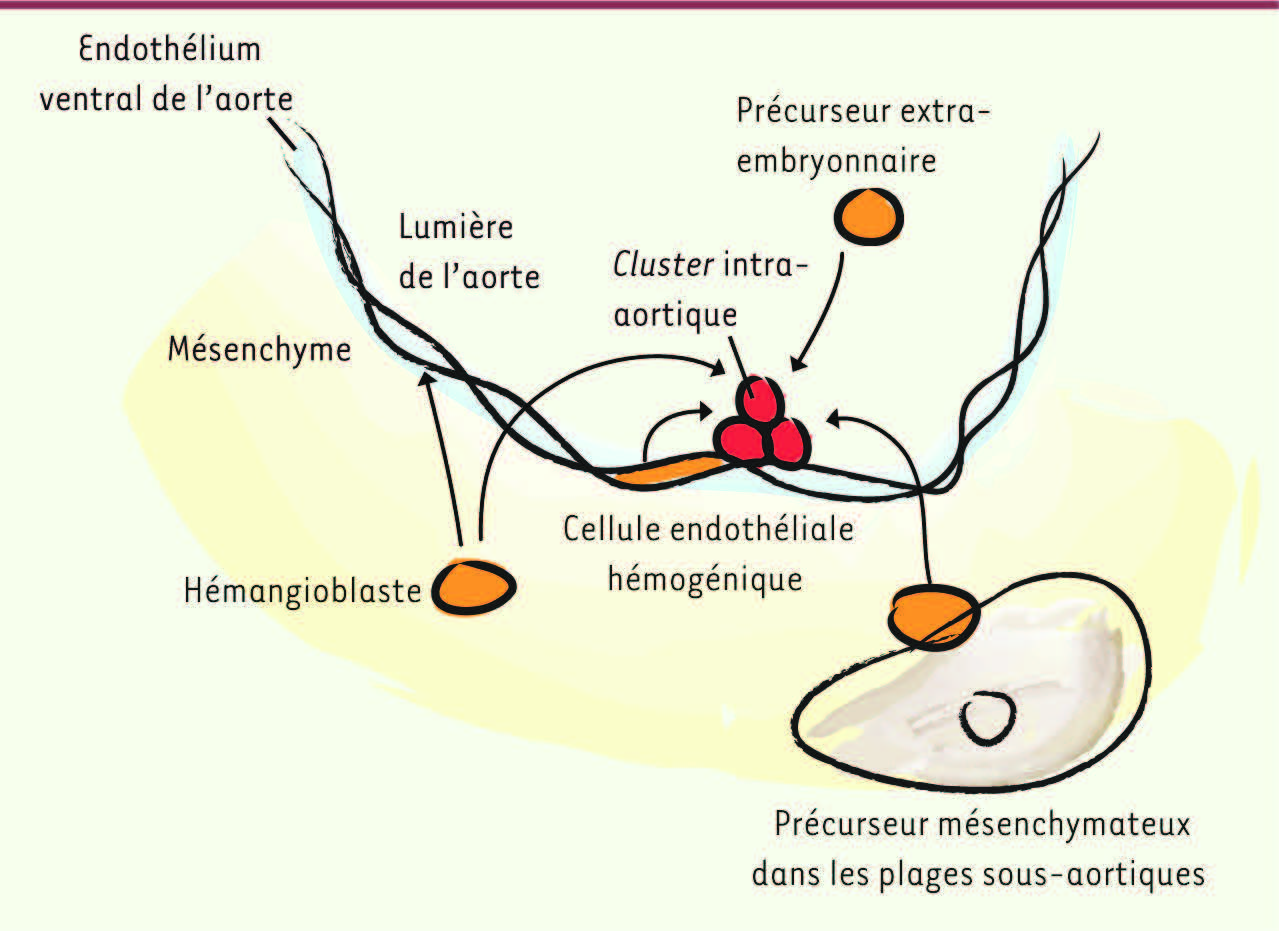
D’où viennent les cellules souches hématopoïétiques ? Une histoire à rebondissements Précurseur des CSH : les différents candidats L’origine anatomique et la nature exacte des précurseurs (ou ancêtres) directs des CSH chez l’embryon sont restées longtemps incertaines bien que cette question ait été au cœur de la recherche pendant plusieurs décennies. Plusieurs candidats ont été suggérés, l’origine de ces précurseurs pouvant être extraou intraembryonnaire
(Figure 1)
[
18]. Parmi ces précurseurs potentiels, on trouve : (1) l’hémangioblaste, capable de se différencier à la fois en cellules hématopoïétiques et endothéliales [
19] ; (2) un précurseur mésenchymateux localisé sous l’endothélium aortique dans le mésenchyme ventral, au sein de structures compactes appelées plages sous-aortiques. Ces cellules migreraient à travers l’endothélium pour former les clusters hématopoïétiques [
20]. Finalement, le candidat le plus probant serait (3) une cellule endothéliale hémogénique, ayant toutes les caractéristiques morphologiques et phénotypiques des cellules endothéliales, mais capable de produire des cellules hématopoïétiques. Il existe en effet une relation très étroite au cours du développement embryonnaire entre la lignée hématopoïétique et la lignée endothéliale. C’est le cas dans les îlots sanguins du sac vitellin comme au niveau des clusters hématopoïétiques intra-artériels. Les cellules hématopoïétiques sont d’ailleurs toujours détectées dans des tissus très vascularisés.
 | Figure 1.
Origine des cellules souches hématopoïétiques. La nature et la localisation précise des ancêtres directs des cellules souches hématopoïétiques (CSH) sont incertaines [ 1, 2]. Différents candidats ont été proposés, ceux-ci pouvant être soit d’origine extraembryonnaire (provenant par exemple du sac vitellin ou du placenta), soit d’origine intraembryonnaire (région de l’aorte dorsale). Dans ce dernier cas, les précurseurs seraient localisés soit dans le mésenchyme sous l’endothélium ventral de l’aorte (hémangioblastes ou précurseurs mésenchymateux), soit directement dans l’endothélium aortique ventral (cellules endothéliales hémogéniques). Les précurseurs mésenchymateux, qui sont localisés dans des plages sous-aortiques, migreraient à travers l’endothélium pour former les clusters hématopoïétiques. |
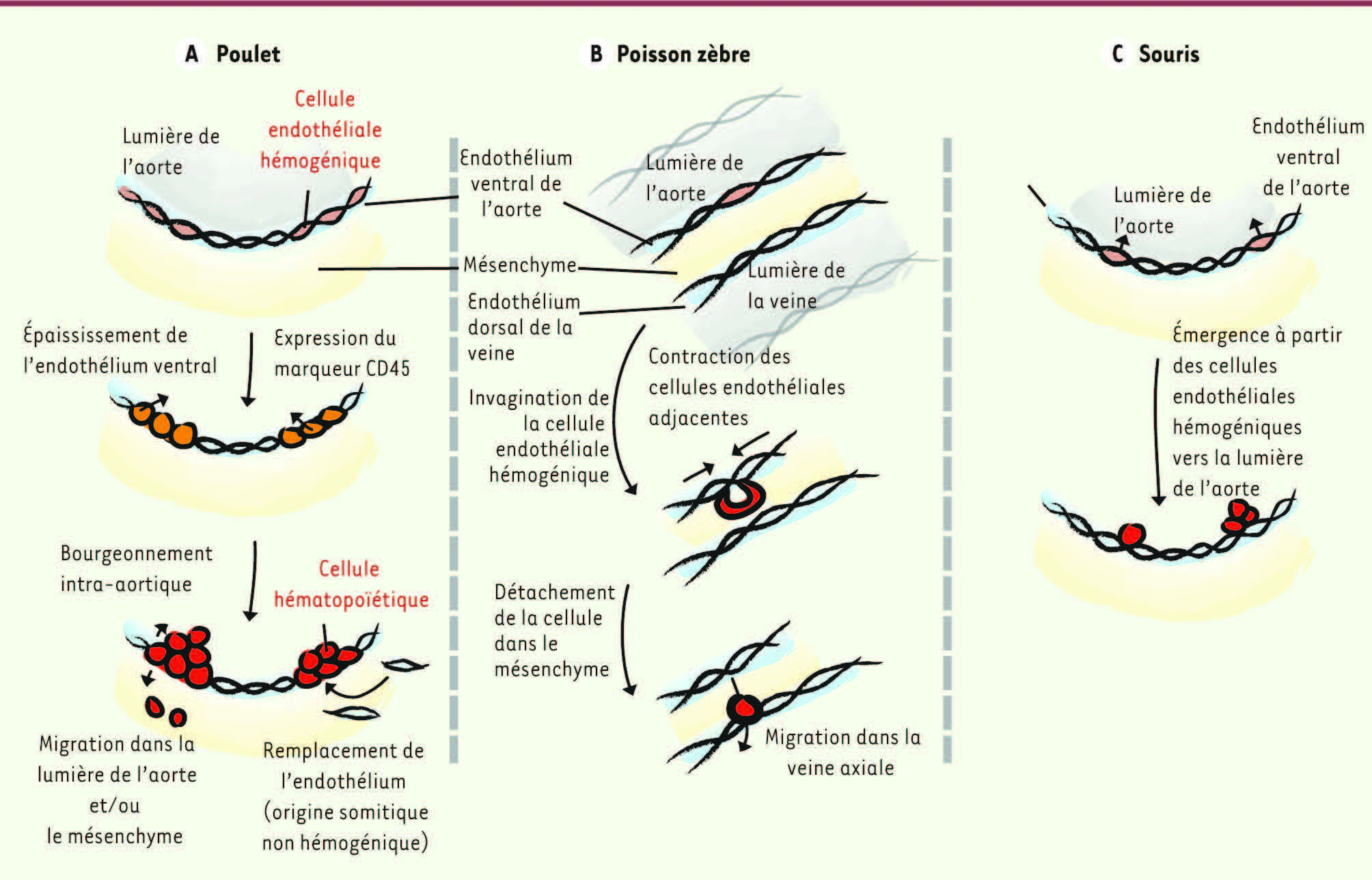
Cellules endothéliales hémogéniques : la preuve chez l’oiseau L’existence d’un endothélium hémogénique a tout d’abord été démontrée dans le modèle aviaire, prouvant par la même une filiation directe entre cellules endothéliales et cellules hématopoïétiques de l’aorte [
21]. En effet, chez l’embryon d’oiseau, tout l’endothélium aortique ventral va progressivement s’épaissir et exprimer le marqueur hématopoïétique CD45. Les cellules vont ensuite s’organiser en clusters orientés vers la lumière de l’aorte avant de migrer dans le mésenchyme sous-aortique pour former les foyers para-aortiques et/ou de se détacher et migrer via la circulation pour coloniser les organes hématopoïétiques définitifs
(Figure 2A)
. La production hématopoïétique est transitoire et restreinte au plancher de l’aorte, car seul l’endothélium ventral possède un potentiel hémogénique du fait de son origine splanchnopleurale. Il sera progressivement remplacé par un endothélium d’origine somitique non hémogénique qui s’installe sous les clusters pour maintenir l’intégrité de l’aorte [
22]. Ce remodelage de l’endothélium aortique permet ainsi de contrôler la production hématopoïétique dans le temps et l’espace.
 | Figure 2.
Formation des cellules hématopoïétiques à partir des cellules endothéliales de l’aorte dans différents modèles d’animaux. Les cellules hématopoïétiques de l’aorte (et les clusters dans le cas des embryons de poulet et de souris) sont produites à partir des cellules endothéliales (dites hémogéniques) qui sont localisées dans la partie ventrale de l’aorte dorsale de l’embryon. Il est intéressant de remarquer que le mécanisme aboutissant à la formation des cellules hématopoïétiques est différent dans les trois espèces : poulet, poisson zèbre et souris. Les mécanismes d’émergence hématopoïétique sont très bien décrits chez l’embryon de poulet [ 21, 22] et de poisson zèbre [
31] mais restent encore mal connus chez l’embryon de souris. |
Endothélium hémogénique chez les mammifères Grâce à la mise au point de différentes approches techniques et de systèmes cellulaires, l’endothélium hémogénique est également apparu comme le candidat le plus convaincant au titre de précurseur direct des CSH de mammifères. Des animaux transgéniques (VE-cadhérine-CreERT2) porteurs d’une construction inductible composée du gène codant pour la recombinase Cre sous contrôle des séquences régulatrices du gène codant pour la VE ( vascular endothelial)-cadhérine [
23] ont été croisés avec des souris ROSA26R (exprimant de façon ubiquitaire le gène rapporteur LacZ ou YFP [ yellow fluorescent protein]). à ce stade, la VE-cadhérine est exclusivement exprimée par les cellules endothéliales. Les femelles gestantes ont été traitées avec du tamoxifène afin d’induire la Cre et le marquage spécifiquement et de façon permanente dans les cellules endothéliales et leur descendance. Dans ces conditions, des cellules hématopoïétiques marquées ont été détectées dans le foie fœtal et la moelle osseuse adulte, ce qui prouve ainsi le potentiel hématopoïétique multilignage et à long terme des cellules endothéliales [
24]. Une autre stratégie utilise l’inactivation de Runx1 (facteur de transcription crucial pour la production des CSH) dans les cellules exprimant la VE-cadhérine, ce qui bloque la production des CSH. Ces observations démontrent donc que les cellules hématopoïétiques de l’adulte dérivent de cellules qui, à un moment de leur vie embryonnaire, ont exprimé la VE-cadhérine [ 16]. Runx1 est en fait nécessaire au moment de la transition de l’endothélium hémogénique en CSH, mais n’est plus requis après l’engagement hématopoïétique [ 16]. Dans le modèle des CSE, l’utilisation combinée de l’imagerie en temps réel et de la culture in vitro a également montré que la différenciation hématopoïétique des colonies blastiques (produites par des hémangioblastes dérivés des CSE) requiert le passage par une étape endothéliale hémogénique [
25,
26]. |
L’origine endothéliale des cellules souches hématopoïétiques de l’aorte : la preuve directe en image Il est maintenant bien établi que les CSH adultes dérivent d’une population endothéliale hémogénique. Toutefois, l’origine anatomique des CSH reste incertaine du fait de la mise en place de la circulation entre les sites intra- et extraembryonnaires dès E8,5. Les cellules endothéliales hémogéniques sont indiscernables des cellules endothéliales non hémogéniques. De plus, il est impossible de cibler spécifiquement les cellules endothéliales d’un site hématopoïétique donné. Donc, si des cellules endothéliales hémogéniques sont présentes dans plusieurs sites hématopoïétiques, tous ces sites ont en théorie la capacité de produire des CSH. Il a été démontré que le sac vitellin et le placenta (allantoïde et chorion) disséqués avant la mise en place de la circulation sanguine (avant E8,5) ou issus d’embryons Ncx1-/-
(dont le cœur ne bat pas en raison de l’inactivation de l’échangeur Na/Ca et qui de ce fait meurent avant E10) étaient capables de donner naissance de novo à des progéniteurs hématopoïétiques [5, 13,
27,
28]. La preuve formelle n’est toujours pas établie en ce qui concerne les CSH, car les tissus ont été testés avant E10,5. Donc, la question d’une origine anatomique multiple des CSH reste toujours d’actualité. Visualisation de la transition endothéliale-hématopoïétique chez le poisson zèbre Une façon de contourner ces problèmes serait de visualiser directement et en temps réel la transition conduisant de l’endothélium hémogénique à la CSH et ce particulièrement dans l’aorte, le premier site de détection des CSH. L’utilisation de l’imagerie in vivo est tout à fait adaptée à ce type de question, particulièrement dans le modèle du poisson zèbre [
29]. Les embryons de poisson zèbre ont la particularité d’être transparents, ce qui permet une visualisation directe de l’aorte en microscopie. Ce modèle a récemment permis de visualiser la transition de l’endothélium hémogénique en cellules hématopoïétiques, incluant les CSH [
30–
32]. Pour cela, K. Kissa et P. Herbomel ont utilisé des embryons transgéniques exprimant des gènes codant pour des protéines fluorescentes placés sous le contrôle des séquences régulatrices de KDR (récepteur de type 2 du VEGF, vascular endothelial growth factor) ou Lmo2 ( LIM domain only 2) tous deux exprimés par les cellules endothéliales, c-myb, Runx1 ou CD41, exprimés par les CSH. Le mécanisme appelé « transition endothéliale-hématopoïétique » requiert un remodelage important des cellules endothéliales. Celles-ci se contractent (dès 30 h post-fertilisation) pour finalement s’invaginer dans l’espace sous-aortique tout en acquérant les caractéristiques des cellules hématopoïétiques [ 31]. Cette invagination crée un rapprochement forcé des cellules endothéliales adjacentes, ce qui permet de maintenir l’intégrité de l’aorte
(Figure 2B)
. Il est intéressant de remarquer que les cellules hématopoïétiques sont formées, non pas en direction de la lumière de l’aorte (comme c’est le cas chez les embryons de poulet ou de souris), mais vers l’espace situé entre l’aorte dorsale et la veine axiale (espace sous-aortique considéré comme l’homologue de l’AGM des mammifères). Les cellules entrent finalement dans la circulation par la veine, après qu’une partie des cellules se soient divisées de manière symétrique. Ce passage des cellules hématopoïétiques par la veine et non par l’artère pourrait s’expliquer par le fait que les jonctions entre les cellules endothéliales veineuses sont plus lâches qu’entre les cellules endothéliales artérielles, comme le visualise la microscopie électronique de la région [
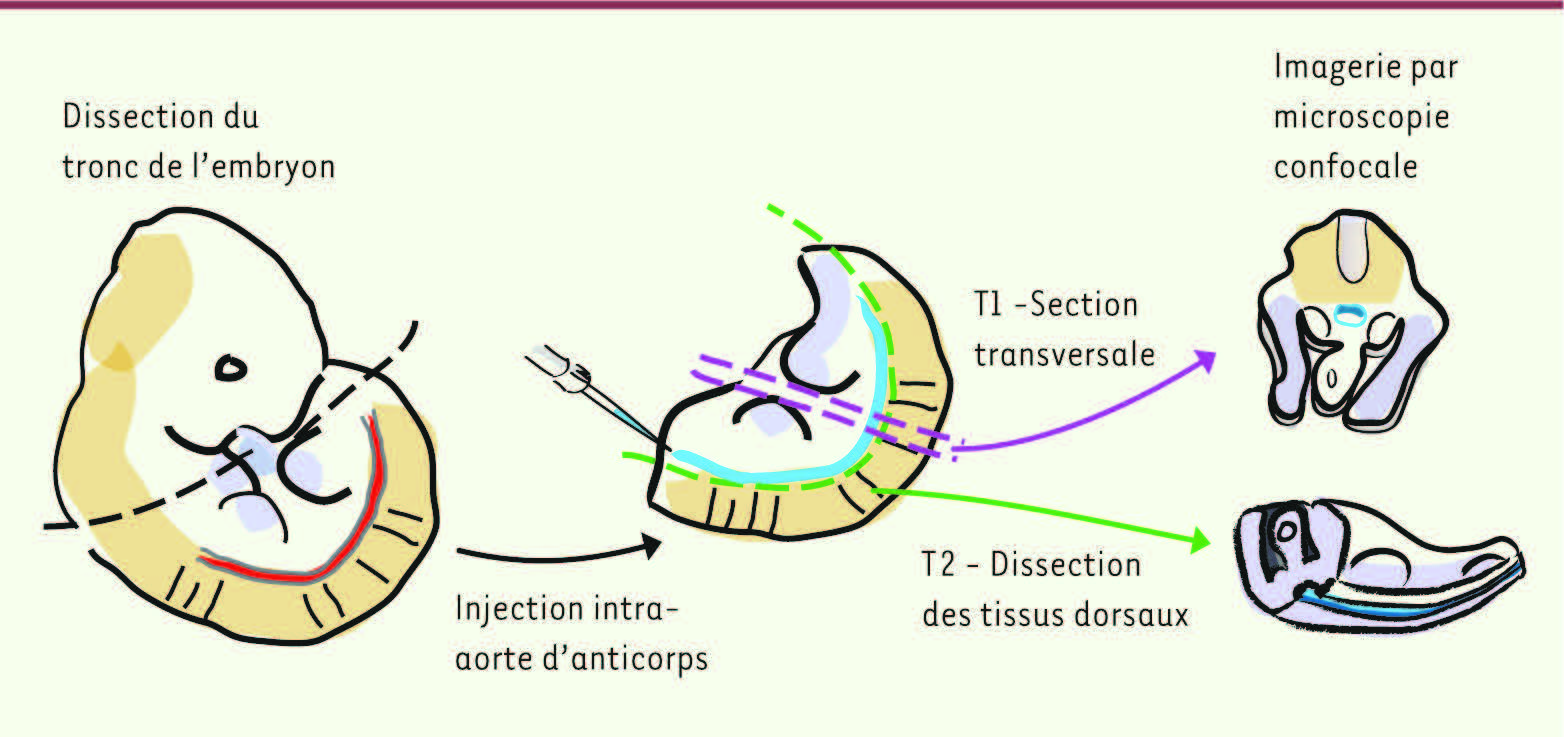
33]. L’utilisation de morpholinos bloquant l’expression de Runx1 a clairement montré qu’en l’absence de ce facteur, les tentatives d’émergence des cellules hématopoïétiques sont avortées, aboutissant à une apoptose massive des cellules en cours d’émergence [ 31]. Naissance en direct des cellules hématopoiétiques à partir des cellules endothéliales dans l’embryon de souris Appliquer la technique d’imagerie in vivo à l’embryon de souris est nettement plus ardu. En effet, un obstacle majeur est que les techniques de microscopie confocale actuelles ne permettent pas une pénétration suffisante pour visualiser l’aorte située profondément dans l’embryon de souris. De plus, l’embryon est opaque et se développe in utero. Nous avons récemment mis au point deux techniques de dissection d’embryons de souris afin d’accéder à l’aorte [ 15]
(Figure 3)
. Les embryons (E10,5) sont isolés puis disséqués afin de séparer le tronc de la tête et de la queue. Les troncs sont ensuite sectionnés transversalement en coupes épaisses de 200 µm
(Figure 3
, technique 1). Dans une deuxième approche, les tissus dorsaux comprenant les somites et le tube neural sont séparés du tronc afin de visualiser l’aorte située sous les somites
(Figure 3
, technique 2). Nous avons utilisé des embryons transgéniques Ly-6A(Sca-1)-GFP (les CSH de l’embryon et de l’adulte sont exclusivement contenues dans la fraction GFP + ; certaines cellules endothéliales sont également GFP + ) [
34] et des embryons knock-in CD41-YFP (CD41 étant considéré comme le premier marqueur d’engagement dans la lignée hématopoïétique) [
35–
37]. Afin de marquer l’endothélium (incluant les cellules endothéliales hémogéniques), nous avons injecté des anticorps anti-CD31 couplés à des fluorochromes directement dans l’aorte. Les embryons disséqués ou les coupes d’embryons ont ensuite été suivis par vidéomicroscopie confocale et photographiés à intervalles réguliers durant des périodes allant jusqu’à 15 h. Dans ces conditions, nous avons observé l’émergence, dans la lumière de l’aorte, de cellules hématopoïétiques coexprimant CD31 et Ly-6A-GFP, ou CD31 et CD41-YFP. Le fait qu’après leur émergence les cellules soient toujours marquées avec les anticorps anti-CD31, alors que le marquage avait été réalisé avant le début de l’imagerie, prouve sans ambiguïté leur origine endothéliale. Nous avons observé que le signal YFP (CD41) ne s’allume qu’au moment de l’émergence des cellules, ce qui prouve leur engagement dans la voie hématopoïétique. Nous avons marqué de nouveau les sections (après imagerie) avec des anticorps anti-c-kit (un marqueur classique des CSH) : toutes les cellules nouvellement formées expriment c-kit. La production de ces cellules est très faible, nous l’avons estimée à environ deux cellules par aorte. Par comparaison, la production hématopoïétique dans l’aorte de l’embryon de poisson zèbre est beaucoup plus élevée, estimée à trois cellules par aorte et par heure [ 31]. Si l’hématopoïèse adulte a clairement pour origine ces cellules dérivées de l’endothélium hémogénique, il est difficile de savoir si toutes les cellules qui émergent dans l’aorte de l’embryon de poisson sont des CSH. Au contraire, dans l’embryon de souris, le nombre de cellules que l’on voit émerger dans l’aorte, bien que très faible, correspond au nombre de CSH estimé par aorte à E10,5 (déterminé par le calcul statistique après des expériences de reconstitution hématopoiétique avec des concentrations décroissantes de cellules) [
38]. Aucune émergence de cellules hématopoiétiques n’a été observée à partir des cellules endothéliales dans les coupes d’embryons Runx1-/-
, ou dans des embryons normaux disséqués avant E10,5. De plus, la transition cellules endothéliales hémogéniques en cellules hématopoïétiques a toujours été observée dans le plancher de l’aorte, où l’activité CSH est circonscrite [
39]. Nous avons démontré par technique d’imagerie sur coupe d’embryons non fixés que des cellules endothéliales hémogéniques situées dans le plancher de l’aorte pouvaient donner naissance à des cellules hématopoïétiques à partir de E10,5 et de façon polarisée (vers la lumière de l’aorte) : il est vraisemblable qu’il s’agisse de CSH, bien qu’il soit actuellement techniquement impossible de transplanter ces cellules pour analyser leur fonctionnalité [
40]
(Figure 2C)
.
 | Figure 3.
Techniques permettant de visualiser l’aorte d’embryon de souris par microscopie confocale. Afin de visualiser l’aorte, qui est localisée profondément dans l’embryon de souris, deux protocoles de dissection ont été développés [ 15]. Le tronc de l’embryon non fixé est séparé de la tête et de la queue. L’endothélium et les clusters hématopoïétiques sont marqués grâce à l’injection à l’intérieur de l’aorte d’anticorps fluorescents spécifiques. Dans la technique 1 (T1), le tronc de l’embryon est coupé transversalement pour former des coupes d’une épaisseur de 200 μm. Dans la technique 2 (T2), les tissus dorsaux (les somites et le tube neural) sont séparés du reste du tronc afin de mettre à jour l’aorte qui est localisée juste derrière les somites [ 40]. |
|
En conclusion, un nombre important d’études, effectuées in vitro et in vivo dans des modèles animaux aussi différents que l’oiseau, le poisson et la souris, ont maintenant démontré l’origine endothéliale embryonnaire des CSH adultes. L’observation directe et en temps réel de l’émergence de ces cellules a fourni la preuve définitive par l’image que des CSH étaient produites dans l’aorte à partir d’une population de cellules endothéliales hémogéniques situées dans le plancher de l’aorte. Cette production aortique n’est pas incompatible avec la possibilité que des CSH soient aussi produites dans d’autres sites hématopoïétiques comme le placenta et le sac vitellin. Bien que difficile techniquement, l’utilisation de l’imagerie confocale en temps réel sur ces tissus extra-embryonnaires permettrait de répondre directement à cette question. De manière surprenante, le mécanisme d’émergence des CSH dans l’aorte est très différent dans l’embryon de poulet et de poisson zèbre
(Figure 2AB)
, et est encore largement méconnu dans l’embryon de souris
(Figure 2C)
. Ces différences ne permettent pas de présumer du mécanisme d’émergence des CSH dans l’embryon humain. Enfin, un point crucial à élucider serait de déterminer comment les CSH nouvellement produites à partir d’un endothélium apparemment mature acquièrent leurs propriétés de cellules souches ; c’est une condition sine qua non à l’établissement de conditions de culture compatibles avec la production in vitro de CSH. Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Catherine Robin et Jean-Charles Boisset reçoivent le soutien de NWO (Vidi Dutch young investigator grant [917-76-345]).
|
Footnotes |
1.
Cumano
A
,
Godin
I.
Ontogeny of the hematopoietic system . Annu Rev Immunol.
2007; ; 25 : :745.–785. 2.
Dzierzak
E
,
Speck
NA.
Of lineage and legacy: the development of mammalian hematopoietic stem cells . Nat Immunol.
2008; ; 9 : :129.–136. 3.
Palis
J
,
Robertson
S
,
Kennedy
M
, et al.
Development of erythroid and myeloid progenitors in the yolk sac and embryo proper of the mouse . Development.
1999; ; 126 : :5073.–5084. 4.
Huber
TL
,
Kouskoff
V
,
Fehling
HJ
, et al.
Haemangioblast commitment is initiated in the primitive streak of the mouse embryo . Nature.
2004; ; 432 : :625.–630. 5.
Lux
CT
,
Yoshimoto
M
,
McGrath
K
, et al.
All primitive and definitive hematopoietic progenitor cells emerging before E10 in the mouse embryo are products of the yolk sac . Blood.
2008; ; 111 : :3435.–3438. 6.
Dieterlen-Lievre
F.
On the origin of haemopoietic stem cells in the avian embryo: an experimental approach . J Embryol Exp Morphol.
1975; ; 33 : :607.–619. 7.
Turpen
JB
,
Knudson
CM
,
Hoefen
PS.
The early ontogeny of hematopoietic cells studied by grafting cytogenetically labeled tissue anlagen: localization of a prospective stem cell compartment . Dev Biol.
1981; ; 85 : :99.–112. 8.
Cumano
A
,
Dieterlen-Lievre
F
,
Godin
I.
Lymphoid potential, probed before circulation in mouse, is restricted to caudal intraembryonic splanchnopleura . Cell.
1996; ; 86 : :907.–916. 9.
Medvinsky
A
,
Dzierzak
E.
Definitive hematopoiesis is autonomously initiated by the AGM region . Cell.
1996; ; 86 : :897.–906. 10.
Muller
AM
,
Medvinsky
A
,
Strouboulis
J
, et al.
Development of hematopoietic stem cell activity in the mouse embryo . Immunity.
1994; ; 1 : :291.–301. 11.
Gekas
C
,
Dieterlen-Lievre
F
,
Orkin
SH
,
Mikkola
HK.
The placenta is a niche for hematopoietic stem cells . Dev Cell.
2005; ; 8 : :365.–375. 12.
Ottersbach
K
,
Dzierzak
E.
The murine placenta contains hematopoietic stem cells within the vascular labyrinth region . Dev Cell.
2005; ; 8 : :377.–387. 13.
Rhodes
KE
,
Gekas
C
,
Wang
Y
, et al.
The emergence of hematopoietic stem cells is initiated in the placental vasculature in the absence of circulation . Cell Stem Cell.
2008; ; 2 : :252.–263. 14.
Dieterlen-Lievre
F
,
Pouget
C
,
Bollerot
K
,
Jaffredo
T.
Are intra-aortic hemopoietic cells derived from endothelial cells during ontogeny?
Trends Cardiovasc Med.
2006; ; 16 : :128.–139. 15.
Boisset
JC
,
van Cappellen
W
,
Andrieu-Soler
C
, et al.
In vivo imaging of haematopoietic cells emerging from the mouse aortic endothelium . Nature.
2010; ; 464 : :116.–120. 16.
Chen
MJ
,
Yokomizo
T
,
Zeigler
BM
, et al.
Runx1 is required for the endothelial to haematopoietic cell transition but not thereafter . Nature.
2009; ; 457 : :887.–891. 17.
Zovein
AC
,
Turlo
KA
,
Ponec
RM
, et al.
Vascular remodeling of the vitelline artery initiates extravascular emergence of hematopoietic clusters . Blood.
2010; ; 116 : :3435.–3444. 18.
Samokhvalov
IM
,
Samokhvalova
NI
,
Nishikawa
S.
Cell tracing shows the contribution of the yolk sac to adult haematopoiesis . Nature.
2007; ; 446 : :1056.–1061. 19.
Pardanaud
L
,
Luton
D
,
Prigent
M
, et al.
Two distinct endothelial lineages in ontogeny, one of them related to hemopoiesis . Development.
1996; ; 122 : :1363.–1371. 20.
Bertrand
JY
,
Giroux
S
,
Golub
R
, et al.
Characterization of purified intraembryonic hematopoietic stem cells as a tool to define their site of origin . Proc Natl Acad Sci USA.
2005; ; 102 : :134.–139. 21.
Jaffredo
T
,
Gautier
R
,
Eichmann
A
,
Dieterlen-Lievre
F.
Intraaortic hemopoietic cells are derived from endothelial cells during ontogeny . Development.
1998; ; 125 : :4575.–4583. 22.
Pouget
C
,
Gautier
R
,
Teillet
MA
,
Jaffredo
T.
Somite-derived cells replace ventral aortic hemangioblasts and provide aortic smooth muscle cells of the trunk . Development.
2006; ; 133 : :1013.–1022. 23.
Drake
CJ
,
Fleming
PA.
Vasculogenesis in the day 6.5 to 9.5 mouse embryo . Blood.
2000; ; 95 : :1671.–9. 24.
Zovein
AC
,
Hofmann
JJ
,
Lynch
M
, et al.
Fate tracing reveals the endothelial origin of hematopoietic stem cells . Cell Stem Cell.
2008; ; 3 : :625.–636. 25.
Eilken
HM
,
Nishikawa
S
,
Schroeder
T.
Continuous single-cell imaging of blood generation from haemogenic endothelium . Nature.
2009; ; 457 : :896.–900. 26.
Lancrin
C
,
Sroczynska
P
,
Stephenson
C
, et al.
The haemangioblast generates haematopoietic cells through a haemogenic endothelium stage . Nature.
2009; ; 457 : :892.–895. 27.
Corbel
C
,
Salaun
J
,
Belo-Diabangouaya
P
,
Dieterlen-Lièvre
F.
Hematopoietic potential of the pre-fusion allantois . Dev Biol.
2007; ; 301 : :478.–488. 28.
Zeigler
BM
,
Sugiyama
D
,
Chen
M
,
Guo
Y
, et al.
The allantois and chorion, when isolated before circulation or chorio-allantoic fusion, have hematopoietic potential . Development.
2006; ; 133 : :4183.–4192. 29.
Kissa
K
,
Murayama
E
,
Herbomel
P.
Le danio zèbre révèle l’odyssée des précurseurs hématopoiétiques au cours du developpement des embryons de vertèbres . Med Sci (Paris).
2007; ; 23 : :698.–700. 30.
Bertrand
JY
,
Chi
NC
,
Santoso
B
, et al.
Haematopoietic stem cells derive directly from aortic endothelium during development . Nature.
2010; ; 464 : :108.–111. 31.
Kissa
K
,
Herbomel
P.
Blood stem cells emerge from aortic endothelium by a novel type of cell transition . Nature.
2010; ; 464 : :112.–115. 32.
Lam
EY
,
Hall
CJ
,
Crosier
PS
, et al.
Live imaging of Runx1 expression in the dorsal aorta tracks the emergence of blood progenitors from endothelial cells . Blood.
2010; ; 116 : :909.–914. 33.
Kissa
K
,
Murayama
E
,
Zapata
A
, et al.
Live imaging of emerging hematopoietic stem cells and early thymus colonization . Blood.
2008; ; 111 : :1147.–1156. 34.
De Bruijn
MF
,
Ma
X
,
Robin
C
, et al.
Hematopoietic stem cells localize to the endothelial cell layer in the midgestation mouse aorta . Immunity.
2002; ; 16 : :673.–683. 35.
Mikkola
HK
,
Fujiwara
Y
,
Schlaeger
TM
, et al.
Expression of CD41 marks the initiation of definitive hematopoiesis in the mouse embryo . Blood.
2003; ; 101 : :508.–516. 36.
Ferkowicz
MJ
,
Starr
M
,
Xie
X
, et al.
CD41 expression defines the onset of primitive and definitive hematopoiesis in the murine embryo . Development.
2003; ; 130 : :4393.–4403. 37.
Robin
C
,
Ottersbach
K
,
Boisset
JC
, et al.
CD41 is developmentally regulated and differentially expressed on mouse hematopoietic stem cells . Blood.
2011; ; 117 : :5088.–5091. 38.
Kumaravelu
P
,
Hook
L
,
Morrison
AM
, et al.
Quantitative developmental anatomy of definitive haematopoietic stem cells/long-term repopulating units (HSC/RUs): role of the aorta-gonad-mesonephros (AGM) region and the yolk sac in colonisation of the mouse embryonic liver . Development.
2002; ; 129 : :4891.–4899. 39.
Taoudi
S
,
Medvinsky
A.
Functional identification of the hematopoietic stem cell niche in the ventral domain of the embryonic dorsal aorta . Proc Natl Acad Sci USA.
2007; ; 104 : :9399.–9403. 40.
Boisset
JC
,
Robin
C.
Imaging the founder of adult hematopoiesis in the mouse embryo aorta . Cell Cycle.
2010; ; 9 : :2487.–2488. |