| |
| Med Sci (Paris). 2011 October; 27(10): 905–909. Published online 2011 October 21. doi: 10.1051/medsci/20112710023.Fonction inattendue de p63 dans le développement cardiaque Un phénotype peut en cacher un autre Matthieu Rouleau,1 Michel Pucéat,2 and Daniel Aberdam1* 1Inserm U898, Université de Nice-Sophia Antipolis, 28, avenue de Valombrose, 06107Nice, France 2Inserm U633, Université Paris Descartes, Évry, France MeSH keywords: Animaux, Protéine morphogénétique osseuse de type 4, physiologie, Différenciation cellulaire, Ectoderme, cytologie, Dysplasie ectodermique, embryologie, génétique, Développement embryonnaire, Épiderme, Membres, Coeur foetal, croissance et développement, anatomopathologie, Gènes dominants, Cardiopathies congénitales, Humains, Kératinocytes, Souris, Morphogenèse, Myocytes cardiaques, métabolisme, Phénotype, Phosphoprotéines, déficit, Isoformes de protéines, Transactivateurs, Facteurs de transcription, Protéines suppresseurs de tumeurs |
Le gène P63 code pour un facteur de transcription de la famille de p53. Deux isoformes majeures, TAp63 et ΔNp63, aux fonctions antagonistes, sont produites par l’utilisation de promoteurs alternatifs. L’épissage alternatif du gène en 3’ aboutit à la formation de multiples isoformes de TA et ΔNp63 aux fonctions encore inconnues. La complexité de cette famille vient de ce que les isoformes p63 peuvent former des oligomères avec les membres p53 et p73 et reconnaissent des gènes cibles communs responsables de régulations agonistes et antagonistes [
1]. De plus, les gènes de cette famille sont des gènes cibles les uns pour les autres, ce qui engendre des boucles de régulation complexes de l’expression et des fonctions de chaque isoforme. Alors que ΔNp63 est impliquée dans de nombreuses fonctions épithéliales telles que la prolifération et l’adhésion cellulaires [
2], TAp63 régule l’apoptose et la sénescence cellulaires ainsi que la stabilité génomique [2–
4]. L’expression balancée des deux isoformes régule l’homéostasie tissulaire, soit en contrôlant la prolifération cellulaire, soit en limitant la survie cellulaire, selon le tissu et l’état de différenciation de la cellule. Cette dualité fonctionnelle des deux principales isoformes de p63 est aussi observée dans le développement tumoral [1, 2,
5,
6]. ΔNp63, qui stimule la prolifération, est surexprimée dans de nombreux tissus tumoraux et considérée comme oncogénique. À l’inverse, l’activité apoptotique de TAp63 explique qu’on la considère comme un suppresseur de tumeur, bien qu’aucune mutation de son gène n’ait été identifiée
dans des tumeurs. |
Rôle de p63 au cours du développement L’importance de p63 dans le développement embryonnaire a été démontrée en 1999 par l’identification de mutations germinales du gène TP63 humain chez des patients atteints de dysplasies ectodermales sévères [
7]. Ces syndromes, de transmission autosomique dominante, sont caractérisés par plusieurs anomalies touchant le développement des membres (ectrodactylie), les dérivés de l’ectoderme (poils, peau, dents, ongles, glandes sudoripares et mammaires) et la face (fente labiopalatine). Ce phénotype, lié à des défauts de l’ectoderme embryonnaire, a été confirmé la même année par deux équipes qui ont produit des souris dont le gène p63 avait été invalidé [
8,
9]
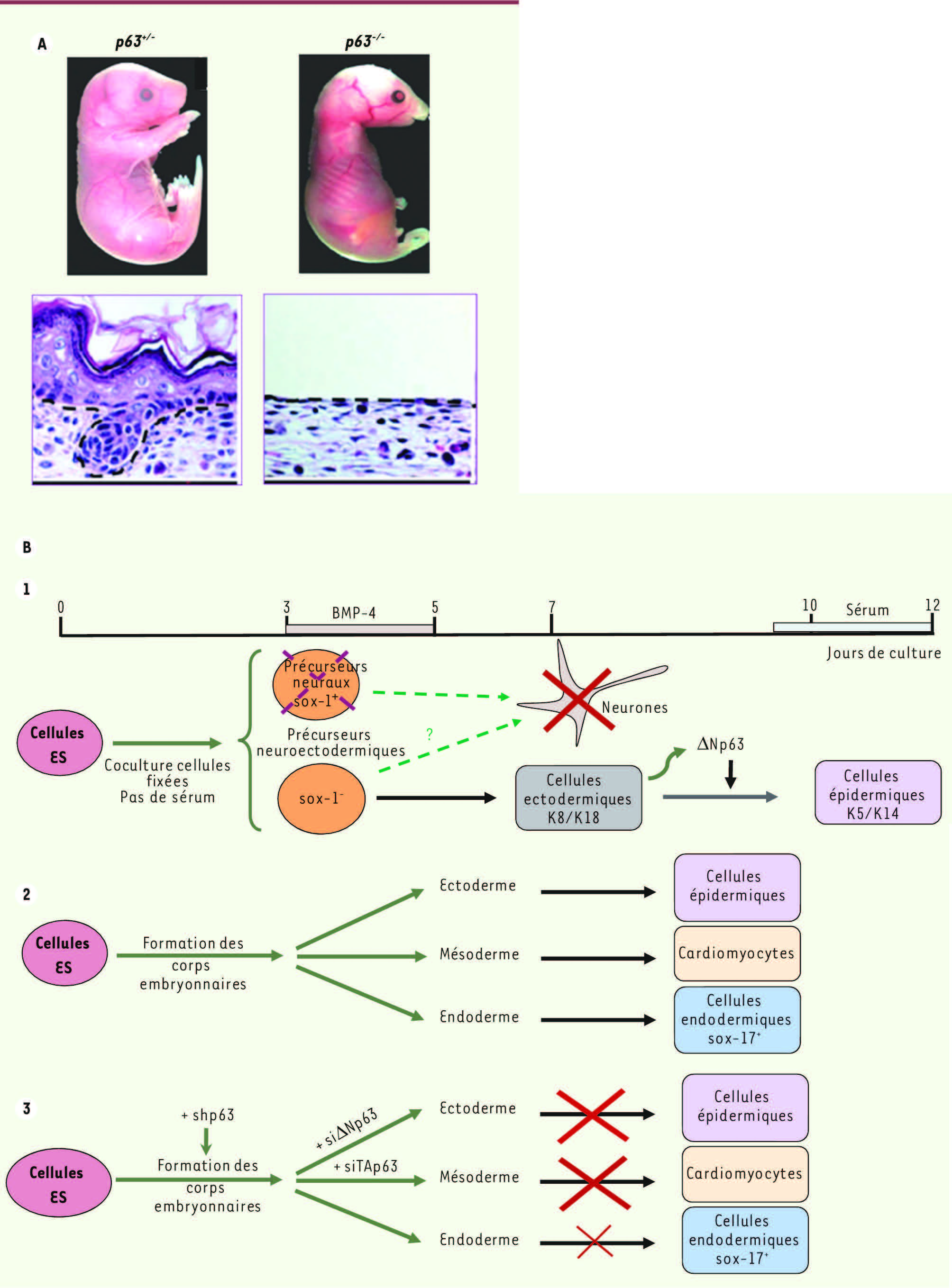
(Figure 1A)
. Ces souris naissent sans épithélium cutané et se caractérisent aussi par l’absence de membres, d’épithéliums malpighiens et d’appendices épithéliaux dérivés de l’ectoderme (glandes mammaires, prostatiques, salivaires, etc.). L’absence de barrière cutanée semble être responsable de la mort des nouveau-nés par déshydratation [8, 9]. Même si le phénotype décrit par les deux groupes était similaire, les différences morphologiques entre les lignées de souris p63
-/-
ont entretenu une polémique conceptuelle qui dure depuis une décennie. Le groupe de D. Roop suggère que p63 est nécessaire à l’initiation de la stratification de l’épiderme embryonnaire [
10] alors que l’équipe de F. McKeon considère que la fonction de p63 n’est pas de permettre la différenciation de l’ectoderme embryonnaire en épiderme, mais d’assurer l’autorenouvellement des cellules souches épidermiques [1, 8]. Pour clarifier ce point, notre laboratoire a mis au point un modèle cellulaire, à partir de cellules souches embryonnaires (CSE), qui permet de mimer in vitro le développement épidermique [
11,
12]. Les cellules sont d’abord engagées dans la voie neuronale puis détournées vers une spécification épidermique par l’ajout de BMP-4 (bone morphogenetic protein), un morphogène dont nous avons montré qu’il induisait l’apoptose des progéniteurs neuronaux tout en stimulant la différenciation épidermique [
13]
(Figure 1B)
. Ce modèle a permis de démontrer que l’isoforme ΔNp63, produite en réponse au morphogène BMP-4, est essentielle à l’engagement des progéniteurs ectodermiques vers la voie épidermique [
14,
15], et que l’introduction dans les cellules de mutations de p63 identiques à celles qui sont observées chez les patients perturbe la cascade moléculaire nécessaire à cette différenciation [
16]. Des souris invalidées ou mutées spécifiquement pour ΔNp63 sont en cours de production et semblent confirmer ces résultats (communications personnelles). En revanche, les souris chez lesquelles TAp63 a été spécifiquement inactivée dans la peau ne souffrent d’aucun phénotype cutané, ce qui confirme que, contrairement à ΔNp63, TAp63 n’est pas essentielle à l’engagement et à la stratification cutanés [4].
 | Figure 1.
Modèles d’étude du rôle de p63. A. Phénotype d’embryons déficients en p63. Au 14 e jour de gestation, on observe une absence de membres, de revêtement cutané ainsi qu’un défaut facio-crânien chez les embryons p63
-/-
. L’absence d’épithélium pluristratifié est visible au niveau histologique. B. Représentation schématique de l’engagement des cellules souches embryonnaires (CSE). (1) Les CSE cultivées sur une couche de cellules nourricières fixées et en l’absence de sérum se différencient en précurseurs neuronaux sox-1 +. En présence de BMP-4, ces précurseurs sox-1 + entrent en apoptose [ 13] et permettent à la population sox1 - de s’engager dans la différenciation ectodermique et épidermique [ 14]. (2) La différenciation des CSE en corps embryoïdes permet l’engagement des cellules pluripotentes vers les trois feuillets embryonnaires: l’ectoderme, le mésoderme et l’endoderme. (3) Nos études montrent que l’inhibition de p63 dans les CSE bloque les engagements épidermique et cardiaque. Ces effets sont reproduits par l’inactivation de ΔNp63 pour l’engagement épidermique et de TAp63 pour la différenciation cardiaque, via son expression par les cellules endodermiques sox-17 + (adapté de [ 8, 9]). |
|
p63 est essentiel au développement cardiaque p63 et la différenciation cardiomyocytaire des CSE Au cours de notre étude, une observation nous a intrigués [ 17] : si nous remplaçions le BMP-4 par une expression exogène de p63 au cours de l’engagement neuroectodermique, la production de kératinocytes était remplacée par celle de corps battants, signant la formation de cardiomyocytes (d’origine mésodermique) à partir des CSE
(Figure 1B)
. Ce résultat imprévu, et a priori difficilement explicable compte tenu de notre connaissance des fonctions épithéliales de p63, nous a permis d’identifier une fonction totalement ignorée de TAp63 dans le développement cardiaque et de décrire un phénotype méconnu des souris p63
-/-
produites il y a plus d’une décennie. L’utilisation de CSE murines dans lesquelles chaque isoforme de p63 a été inactivée par l’utilisation de siARN nous a permis de confirmer que l’absence de TAp63 bloque la production de cardiomyocytes (corps battants)
(Figure 2A)
et l’activation des gènes cardiaques précoces ( Tbx5, Nkx2.5, islet1) et tardifs ( troponine-T, α -actinine, Mlc2v), mais aussi de gènes endodermiques ( sox-17, gata4/6, activine-A). En revanche, les gènes du mésoderme précoce ( brachyury) ou mésocardiaques ( Mesp1) ne semblent pas dépendre de TAp63. Ainsi, p63 et sox-17 sont exprimés simultanément au cours de la différenciation précoce des CSE et les transcrits p63 sont détectés dans l’endoderme d’embryons à E7,5. Ces données démontrent in vitro et in vivo la production de TAp63 par des cellules endodermiques et suggèrent que ce facteur agit de manière paracrine sur l’engagement cardiaque. C’est effectivement le cas puisque des cardiomyocytes fluorescents peuvent être dérivés de CSE p63
-/-
exprimant l’eGFP dès lors que ces CSE sont cultivées en présence de CSE sauvages non marquées dont on induit la différenciation en cardiomyocytes. Des expériences de Chip-PCR et d’analyses de promoteurs confirment le contrôle par p63 des facteurs cardiogéniques de l’endoderme. Cependant, nous ne pouvons pas exclure que certaines cellules mésodermiques cardiaques ( Mesp1
+
, Tbx5
+
) puissent exprimer de manière transitoire TAp63, qui exercerait alors une fonction intrinsèque.
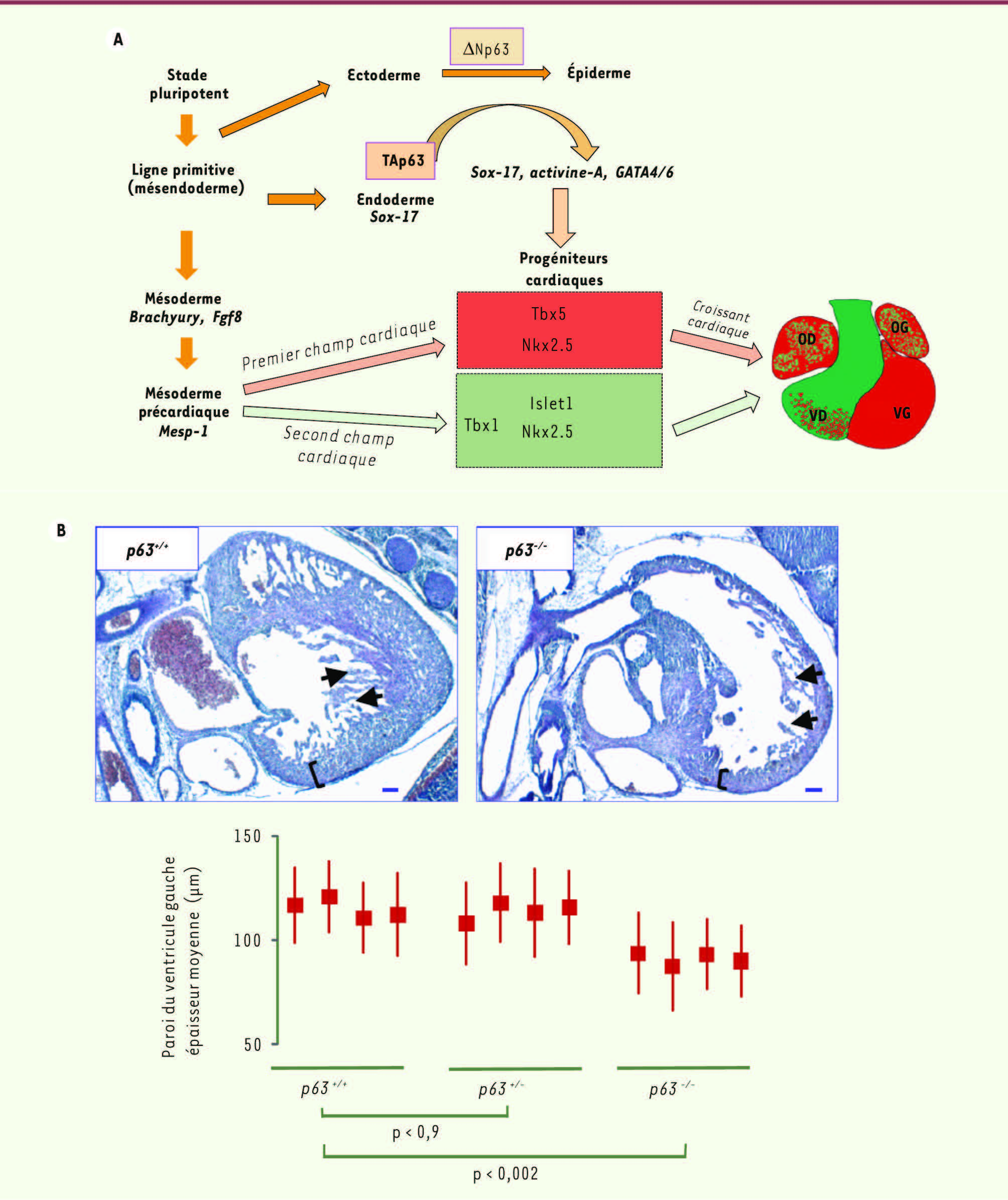
 | Figure 2.
Rôle respectif des deux isoformes p63 dans le développement embryonnaire. A. Représentation schématique de la régulation des isoformes p63 au cours du développement embryonnaire. L’isoforme ΔNp63 est exprimée par les précurseurs ectodermiques et induit leur différenciation en cellules épidermiques. En parallèle, l’isoforme TAp63 est produite par des précurseurs endodermiques sox-17+, contrôle l’expression de facteurs cardiogéniques dont l’activine-A, GATA4/6 pour la régulation de gènes cardiaques des premier et second champs cardiaques. B. La morphologie des cœurs embryonnaires confirme l’implication de TAp63 dans l’engagement des deux champs cardiaques. On retrouve une cardiopathie dilatée avec un défaut de réticulation des deux ventricules avec une paroi très fine. |
Une cardiopathie sévère et méconnue chez les souris p63
-/-
Les souris knock-out pour p63 ont été produites en 1999 et étudiées par de nombreux laboratoires, sans qu’aucune pathologie cardiaque n’ait été décrite. Or, notre analyse de ces souris a révélé, en total accord avec nos études in vitro sur les CSE, que les embryons p63
-/-
souffrent d’une cardiopathie sévère qui implique les ventricules et les oreillettes, et se caractérise par un déficit en trabéculation et une paroi ventriculaire fine
(Figure 2B)
, et fonctionnellement par une déficience sévère de contractilité enregistrée par la mesure des transitoires calciques [
17]. L’analyse en microscopie électronique des cardiomyocytes de ces souris à la naissance montre des myofibrilles et mitochondries totalement désorganisées. Ces données suggèrent fortement que l’isoforme TAp63 est bien exprimée au niveau de l’endoderme embryonnaire, lieu d’induction cardiogénique lors de la formation du lignage primaire cardiaque au stade embryonnaire E7,0-7,5. Elle agirait sur la spécification et/ou la prolifération des progéniteurs cardiaques avant même leur migration au sein de la ligne primitive et la formation du croissant cardiaque. Le nombre très diminué de progéniteurs cardiaques Islet-1 + dans les cœurs des embryons p63
-/-
plus tardifs (stade E10,5) est en accord avec cette hypothèse. Le coeur embryonnaire dérive de deux lignages cardiaques qui ségrègent à partir d’un précurseur commun. Chacune de ces deux populations mésodermiques se caractérise par l’expression spécifique de marqueurs, en particulier les facteurs de transcription Nkx2.5 pour le premier territoire et Isl1 pour le second. Les défauts morphologiques cardiaques observés chez les embryons précoces - qui concernent aussi bien les ventricules que les oreillettes gauche et droite-, et l’absence d’expression de Nkx2.5 et Islet-1 suggèrent que l’absence de p63 perturbe les deux lignages cardiaques. Nous avons fait ces observations dans la lignée de souris brdm2 129 Sv/B57BL/6 produite par A. Bradley (disponible au JAX 1,) [ 8]. Or, nous n’avons pas observé de phénotype cardiaque flagrant chez les souris produites par l’équipe de F. McKeon (lignée B57BL/6/BALB/c) [ 9]. S’il existe plus de cellules apoptotiques dans le cœur de ces souris, en revanche aucun défaut morphologique n’y est associé. Nous pensons que, comme cela arrive souvent, le fond génétique de ces souris permet une compensation meilleure que pour la lignée brdm2 129 Sv/B57BL/6. L’importance du fond génétique des animaux est confirmée par l’équipe de E. Flores, qui a produit des souris déficientes en TAp63 : plus d’un tiers des embryons meurent très tôt au cours du développement, mais cette mortalité peut disparaître si l’on modifie le fond génétique de ces souris [ 4]. Morale de l’histoire Ces résultats suscitent de nombreuses questions auxquelles nous allons tenter de répondre : (1) à quel moment précis TAp63 est-elle exprimée dans les stades précoces du développement cardiaque, et quelle en est la source cellulaire ? (2) Quels gènes et voies de signalisation contrôlent TAp63 lors de la cardiogenèse ? (3) D’autres tissus ou populations cellulaires sont-ils affectés par le déficit en facteurs endodermiques dû à l’absence de TAp63 ? (4) Des mutations des exons/introns de TAp63 sont-elles responsables de cardiopathies congénitales parmi celles pour lesquelles aucun gène responsable n’a encore été désigné ? En effet, toutes les mutations identifiées chez les patients atteints de dysplasies ectodermiques sont localisées sur les domaines spécifiques de ΔNp63 ou régions communes. Aucune n’a été identifiée sur les exons spécifiques de TAp63. On ne peut donc exclure que de telles mutations soient létales chez l’homme. La sévérité du phénotype des souris p63
-/-
au niveau de la peau et des membres est si importante qu’elle explique parfaitement la mortalité des embryons juste avant ou à la naissance. Or, nos résultats démontrent qu’un phénotype (sévère) peut en cacher un autre et qu’il faut parfois des hasards heureux pour le découvrir. Cela renforce notre conviction que les cellules pluripotentes (ES ou iPS, induced pluripotent stem cells) sont un formidable outil, non seulement comme modèle de pathologie [
18], mais également pour découvrir de nouvelles fonctions pour des gènes dont l’étude in vivo n’est pas toujours accessible. Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Ce travail a été soutenu par l’union européenne (VI
th
Program, réseau Epistem), l’Agence nationale pour la recherche (ANR blanc 06) et l’Institut national de la santé et de la recherche médicale (Inserm).
Nous voulons dédier cette derniѐre heure à ketty schwartz qui a suivi ce nouveau concept et soutenu notre curiosité et nos projets. sa mémoire reste toujours en nous.
|
Footnotes |
1.
Melino
G.
p63 is a suppressor of tumorigenesis and metastasis interacting with mutant p53 . Cell Death Differ.
2011; ; 18 : :1487.–1499. 2.
Crum
CP
,
McKeon
FD.
p63 in epithelial survival, germ cell surveillance, and neoplasia . Annu Rev Pathol.
2010; ; 5 : :349.–371. 3.
Guo
X
,
Keyes
WM
,
Papazoglu
C
, et al.
TAp63 induces senescence and suppresses tumorigenesis in vivo
.
Nat Cell Biol
.
2009; ; 11 : :1451.–1457. 4.
Su
X
,
Paris
M
,
Gi
YJ
, et al.
TAp63 prevents premature aging by promoting adult stem cell maintenance . Cell Stem Cell.
2009; ; 5 : :64.–75. 5.
Flores
ER.
The roles of p63 in cancer . Cell Cycle.
2007; ; 6 : :300.–304. 6.
Guo
X
,
Mills
AA.
p63, cellular senescence and tumor development . Cell Cycle.
2007; ; 6 : :305.–311. 7.
Celli
J
,
Duijf
P
,
Hamel
BC
, et al.
Heterozygous germline mutations in the p53 homolog p63 are the cause of EEC syndrome . Cell.
1999; ; 99 : :143.–153. 8.
Mills
AA
,
Zheng
B
,
Wang
XJ
, et al.
p63 is a p53 homologue required for limb and epidermal morphogenesis . Nature.
1999; ; 398 : :708.–713. 9.
Yang
A
,
Schweitzer
R
,
Sun
D
, et al.
p63 is essential for regenerative proliferation in limb, craniofacial and epithelial development . Nature.
1999; ; 398 : :714.–718. 10.
Koster
MI
,
Kim
S
,
Mills
AA
, et al.
p63 is the molecular switch for initiation of an epithelial stratification program . Genes Dev.
2004; ; 18 : :126.–131. 11.
Coraux
C
,
Hilmi
C
,
Rouleau
M
, et al.
Reconstituted skin from murine embryonic stem cells . Curr Biol.
2003; ; 13 : :849.–853. 12.
Aberdam
E
,
Barak
E
,
Rouleau
M
, et al.
A pure population of ectodermal cells derived from human embryonic stem cells . stem cells.
2008; ; 26 : :440.–444. 13.
Gambaro
K
,
Aberdam
E
,
Virolle
T
, et al.
BMP-4 induces a Smad-dependent apoptotic cell death of mouse embryonic stem cell-derived neural precursors . Cell Death Differ.
2006; ; 13 : :1075.–1087. 14.
Medawar
A
,
Virolle
T
,
Rostagno
P
, et al.
DeltaNp63 is essential for epidermal commitment of embryonic stem cells . PLoS One.
2008; ; 3 : :e3441.. 15.
Shalom-Feuerstein
R
,
Lena
AM
,
Zhou
H
, et al.
ƒNp63 is an ectodermal gatekeeper of epidermal morphogenesis . Cell Death Differ.
2011; ; 18 : :887.–896. 16.
Rostagno
P
,
Wolchinsky
Z
,
Vigano
AM
, et al.
Embryonic stem cells as an ectodermal cellular model of human p63-related dysplasia syndromes . Biochem Biophys Res Commun.
2010; ; 395 : :131.–135. 17.
Rouleau
M
,
Medawar
A
,
Hamon
A
, et al.
TAp63 is critical for cardiac differentiation of embryonic stem cells and heart development . stem cell.
2011 ( sous presse.). 18.
Maury
Y
,
Gauthier
M
,
Peschanski
M
,
Martinat
C.
Les cellules souches pluripotentes humaines: un outil-clé pour décrypter les mécanismes physiopathologiques . Med Sci (Paris).
2011; ; 27 : :443.–446. |