| |
| Med Sci (Paris). 2011 November; 27(11): 921–923. Published online 2011 November 30. doi: 10.1051/medsci/20112711002.La théorie de l’équilibre ponctué Un bond en avant dans la compréhension du cancer Caroline Reynaud1* and Marc Billaud2** 1Institut de biologie et chimie des protéines, 7, passage du Vercors, 69367Lyon Cedex 07, France 2Institut Albert Bonniot, CRI Inserm/UJF U823, rond-point de la Chantourne, 38706La Tronche Cedex, France MeSH keywords: Aberrations des chromosomes, Compréhension, physiologie, Homéostasie, génétique, Humains, Modèles biologiques, Modèles génétiques, Modèles théoriques, Tumeurs, étiologie, Analyse de séquence d'ADN, Facteurs temps, Études de validation comme sujet |
Le développement d’un cancer est classiquement conçu comme relevant d’un processus d’évolution darwinien [
1]. Sous l’influence de facteurs qui peuvent être environnementaux ou bien endogènes, les cellules de l’organisme subissent des mutations de leur génome dont certaines procurent un avantage sélectif à celles qui en sont affectées. Ainsi, la succession des cycles de mutations et de sélections suivie de phases d’expansion clonale aboutit à l’émergence de cellules malignes qui se sont affranchies des mécanismes limitant leur prolifération et leur mobilité [1]. Conformément à ce schéma explicatif, la progression d’un cancer résulterait de l’accumulation progressive de mutations s’échelonnant sur des périodes allant de quelques années jusqu’à plusieurs décennies. C’est cette vision strictement gradualiste de l’oncogenèse qui est remise en cause par un article publié dans Cell [
2]. |
Une nouvelle méthode de cartographie fine dite des « extrémités appariées » Dans cette étude, l’équipe dirigée par Peter Campbell - au Wellcome Trust Sanger Institute à Hinxton en Angleterre- exploite les nouvelles techniques dites de « séquençage parallèle en masse » . Après cassure mécanique de l’ADN génomique en plusieurs millions de fragments indépendants d’environ 400 à 500 nucléotides, chacun d’entre eux est réparti de manière individuelle sur un support, puis amplifié et séquencé in situ [
3]. Ce type de technologie s’avère particulièrement adapté à l’analyse du génome des cellules cancéreuses si la « profondeur » du séquençage, c’est-à-dire le nombre de fois où un même nucléotide est séquencé, est grande. D’une part, il permet d’identifier des mutations peu fréquentes dans un contexte où plusieurs populations de cellules coexistent, une hétérogénéité qui est la marque de nombreuses tumeurs. D’autre part, cette technique est quantitative et le nombre de fragments d’ADN séquencés reflète leur abondance dans le génome étudié. Cependant, plutôt que de lire l’intégralité de la séquence des fragments d’ADN, l’équipe de P. Campbell a développé une approche originale pour identifier les réarrangements génomiques. Cette stratégie se limite au séquençage des 37 paires de bases de chacune des extrémités de ces fragments [3]. L’alignement des séquences obtenues sur le génome de référence permet d’identifier les réarrangements génomiques incluant délétions, inversions, amplifications et translocations [3]. Cette méthode dénommée « extrémités appariées » (paired ends) permet donc, avec un gain de temps et de coût appréciable par rapport au séquençage complet, de caractériser les anomalies structurales du génome avec une résolution de l’ordre de la paire de bases. |
Chromothripsis : un processus de pulvérisation cataclysmique d’un chromosome En appliquant cette technique à l’étude de dix leucémies lymphoïdes chroniques, le groupe anglais a obtenu un résultat remarquable. En effet, les cellules de l’un de ces 10 patients leucémiques présentaient 42réarrangements somatiques complexes du bras long du chromosome 4. Cette portion du chromosome comprenait une multitude de zones de délétions, de duplications, d’inversions, et chaque région d’ADN concernée était présente en un ou deux exemplaires, rarement trois. Ce profil de réarrangements était donc différent de celui qui caractérise les tumeurs avec instabilité génétique puisque les réarrangements étaient restreints à une région chromosomique et non pas étendus à l’ensemble du génome. Afin de connaître la fréquence de ce phénomène, une analyse basée sur le génotypage des polymorphismes d’un seul nucléotide (SNP) permettant de déterminer le nombre de copies de chaque portion du génome, a été employée pour cribler 746 lignées cellulaires cancéreuses ainsi que plus de 2700 tumeurs. Il ressort de cette investigation, complétée par une analyse en paired ends pour certains échantillons, qu’environ 2 % à 3 % des tumeurs présentent ces figures complexes de réarrangements massifs d’une portion ou d’un des chromosomes. Ce type d’événement apparaît d’ailleurs plus fréquent dans les tumeurs osseuses et pourrait concerner 25 % d’entre elles. L’équipe anglaise a baptisé chromothripsis (du grec : chromos pour chromosome et thripsis pour briser en éclats) cette variété de remaniement génomique. La mise en évidence de ce nouveau type d’aberration chromosomique est en soi-même une contribution originale à l’oncogénomique. Cependant, la portée de ce travail va bien au-delà. En effet, deux hypothèses sont envisageables pour rendre compte du déroulement des événements aboutissant à la chromothripsis. Soit il s’agit d’un processus séquentiel faisant intervenir plusieurs réarrangements indépendants, soit il s’agit d’un processus de type « catastrophe » impliquant une fragmentation et un réassemblage en une seule fois d’un chromosome ou d’une partie de celui-ci. Selon le modèle progressif, on s’attend à ce que les duplications en tandem affectent des fragments d’ADN chevauchants puisque les réarrangements concernés par la chromothripsis sont très localisés à une région chromosomique. La simulation mathématique de ce scénario montre qu’il conduit à une augmentation importante du nombre de copies de certains fragments au fur et à mesure de l’accroissement du nombre de cassures du chromosome [2]. Or, ce n’est pas ce qui est observé puisque le nombre de copies des fragments est en majorité de 2 et n’excède pas 3 dans le chromosome remanié. Deux autres séries d’arguments discutés dans l’article plaident en faveur du modèle privilégiant un seul événement cataclysmique de pulvérisation et de reconstitution aberrante d’un chromosome ou d’une portion de celui-ci [2]. |
La chromothripsis : un exemple de la théorie dite des équilibres ponctués ? En 1972, deux paléontologues américains, Stephen Jay Gould et Niles Eldredge, ont proposé une théorie visant à expliquer les changements rapides - c’est-à-dire se déroulant quand même sur plusieurs milliers d’années - de la faune et de la flore au cours de l’histoire de la Terre [
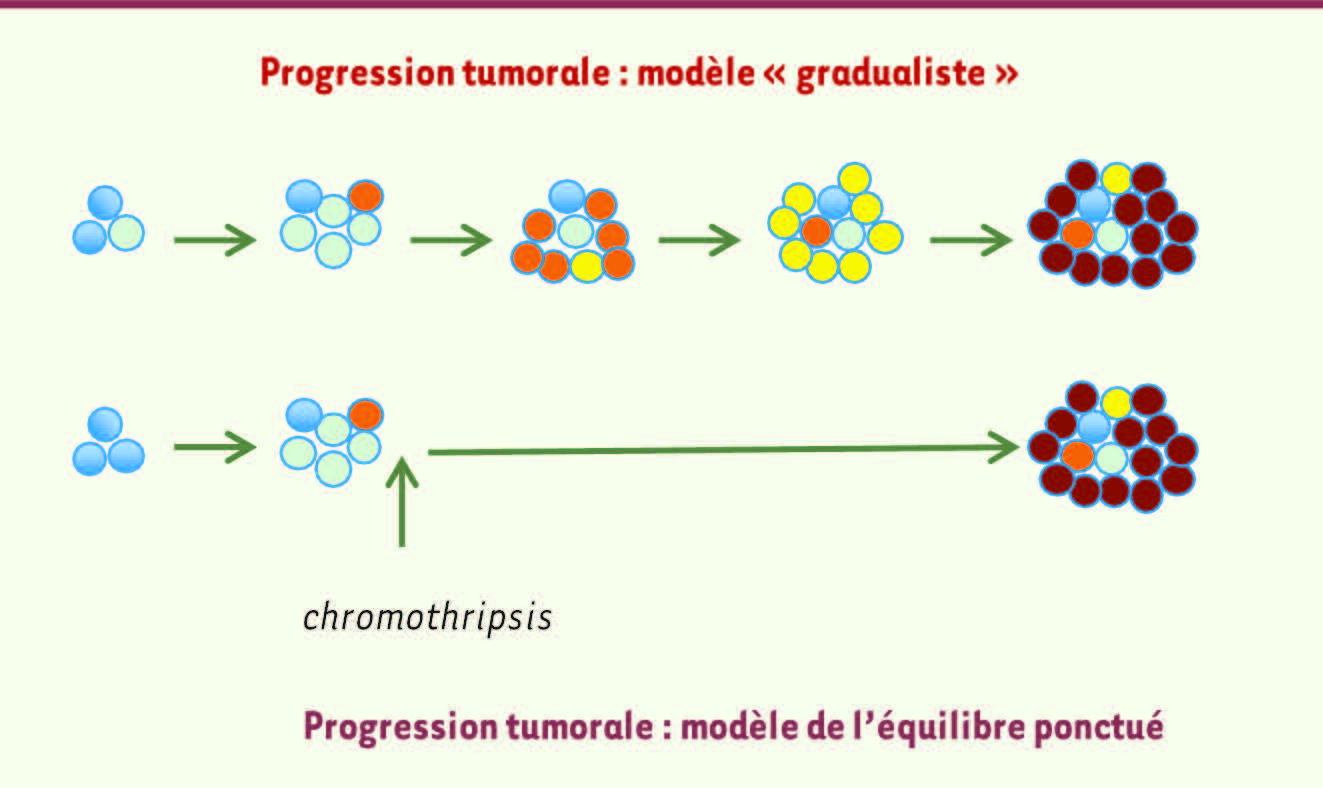
5]. Constatant pour certaines périodes géologiques la rareté des formes intermédiaires liant une espèce à l’autre dans les archives fossilifères, ils ont formulé une hypothèse qui a fait date et a suscité de vives controverses. Selon celle-ci, le processus évolutif serait stagnant sur de très longues durées, dites périodes de stase, mais serait ponctué par des phases de changements rapides accompagnées de la formation de nouvelles espèces. Un bon exemple serait la radiation évolutive du Cambrien, il y a 500 millions d’années. Or, il est frappant de remarquer que cette théorie dite des équilibres ponctués s’applique, dans un tout autre contexte, au phénomène de la chromothripsis. En effet, il s’agit bien dans ce cas d’un unique événement susceptible de réduire le nombre d’étapes conduisant à la transformation maligne d’une cellule. Y a t-il des éléments en faveur d’un avantage sélectif lié à la chromothripsis ? De fait, l’équipe de Peter Campbell a observé que ces réarrangements conduisent, pour certaines tumeurs, à la délétion conjointe d’un des deux allèles des gènes suppresseurs de tumeur CDKN2A (cyclin dependent kinase 2a/p16), WRN (Werner syndrome protein, une RECQ hélicase mutée) et FBXW7 (F-box/WD repeat-containing protein 7) [2]. Dans un cas de tumeur bronchique avec remaniements massifs du chromosome 8, la cellule tumorale comprenait de nombreux fragments d’ADN extrachromosomiques (chromosomes minuscules doubles) qui dérivaient du chromosome 8 remanié et conduisaient à l’amplification du proto-oncogène c-myc [2]. Il est donc hautement probable que ces remaniements génomiques complexes altèrent simultanément l’expression de plusieurs gènes connus pour être impliqués dans le processus tumoral, et, ce faisant, accélèrent l’évolution maligne (Figure 1).
 | Figure 1
Deux modèles de progression tumorale. Selon le modèle « gradualiste » , l’acquisition séquentielle de mutations conférant un avantage de croissance à une cellule est à l’origine du développement tumoral. Des phases de mutations, de sélections et d’expansion clonale (cercles avec différents codes de couleur) aboutissent à la formation d’une population de cellules malignes (cercles mauves). Ce type de scénario n’est pas incompatible avec le fait que la tumeur puisse être hétérogène, tant en termes moléculaires que morphologiques, du fait d’une évolution de type multiclonal [
9]. Le modèle dit de « l’équilibre ponctué » implique un événement qui accélère le processus d’évolution cancéreux, court-circuitant plusieurs étapes requises selon le modèle gradualiste. Le réarrangement massif et subit d’une région chromosomique ( chromothripsis) serait l’un de ces évènements catastrophiques qui précipite la progression néoplasique. |
|
Chronologie et causes de la chromotripsis : quelles hypothèses ? Si cette étude apporte des arguments moléculaires probants en faveur de l’idée que la chromothripsis serait un accélérateur de l’évolution cancéreuse, plusieurs questions persistent quant à la chronologie et aux causes de ce phénomène. À quel stade du cycle cellulaire pourrait-il intervenir ? Il est probable qu’il survienne lorsque le chromosome est compacté lors de la mitose car il est difficile d’imaginer comment les dommages à l’ADN décondensé à l’interphase pourraient générer une telle concentration de cassures double brin aussi bien circonscrites [2]. Une hypothèse vraisemblable serait que les multiples fragments d’ADN générés lorsque la cellule est en division seraient réassociés rapidement entre eux de manière aléatoire par un mécanisme de réparation appelé non-homologous end-joining (NHEJ). Quant aux facteurs pouvant provoquer ces remaniements génomiques, les auteurs suggèrent l’implication des radiations ionisantes qui sont connues pour générer ce type de cassures de l’ADN [2]. Une autre possibilité serait que l’érosion télomérique, qui entraîne la fusion des extrémités des chromosomes et provoque l’apparition de structures appelées « ponts anaphase » , pourrait conduire à la fragmentation des régions chromosomiques ainsi appariées lors de la cytokinèse [2]. On le voit, toutes ces suppositions sont autant de pistes de recherches futures. |
Conclusion : une découverte validée Les découvertes, telles des verres correcteurs, affinent notre perception de la réalité et permettent de distinguer ce que l’on ne voyait pas auparavant ou confusément. Si leur importance, quant à elle, se mesure au nombre croissant de travaux confirmant leur validité, c’est bien le cas ici. En effet, cinq mois après la publication du groupe de Campbell, une équipe française vient déjà d’identifier les stigmates de la chromothripsis dans le myélome multiple et de plus, elle montre que ce réarrangement génomique est un marqueur de mauvais pronostic [
6]. En outre, dès 2006, une équipe américaine travaillant sur des lésions œsophagiennes prénéoplasiques avait obtenu des résultats compatibles avec la théorie de l’équilibre ponctué [
7]. Depuis, le groupe de Michael Wigler à Cold Spring Harbor a apporté des données solides en faveur de ce modèle dans le cancer du sein [
8]. L’équilibre ponctué constitue donc un nouveau mode d’évolution des cancers, similaire dans sa dynamique à ce que les oncologues connaissent bien avec le passage brutal de la chronicité à une phase aiguë pour certaines hémopathies malignes. La chromothripsis est certainement l’un des mécanismes moléculaires impliqués, mais il y a fort à parier qu’il n’est pas le seul. Nul doute que la recherche, qui évolue aussi par stases et sauts conceptuels, va rapidement les dévoiler. Conflit d’interêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Nous remercions Sylvie Mazoyer et Jean-Pierre Rouault pour leur relecture attentive.
|
1.
Nowell
PC
. The clonal evolution of tumor cell populations . Science.
1976; ; 194 : :23.–28. 2.
Stephens
PJ
,
Greeman
CD
,
Fu
B
, et al.
Massive genomic rearrangement acquired in a single catastrophic event during cancer development . Cell.
2011; ; 144 : :27.–40. 3.
Jordan
B
. Une révolution longuement attendue . Med Sci (Paris).
2008; ; 10 : :869.–873. 4.
Campbell
PJ
,
Stephens
PJ
,
Pleasance
ED
, et al.
Identification of somatically acquired rearrangements in cancer using genome-wide massively parallel paired-end sequencing . Nat Genet.
2008; ; 40 : :722.–729. 5.
Eldredge
N
,
Gould
SJ
. Punctuated equilibria: an alternative to phyletic gradualism . In :
Schopf
TJM
, ed.
Models in Paleobiology . San Francisco: : Freeman Cooper; , 1972 : :82.–115. 6.
Magrangeas
F
,
Avet-Loiseau
H
,
Munshi
NC
,
Minvielle
S
. Chromothripsis identifies a rare and aggressive entity among newly diagnosed multiple myeloma patients . Blood.
2011; ; 118 : :675.–678. 7.
Maley
CC
,
Galipeau
PC
,
Finley
JC
, et al.
Genetic clonal diversity predicts progression to esophageal adenocarcinoma . Nat Genet.
2006; ; 38 : :468.–473. 8.
Navin
N
,
Kendall
J
,
Troge
J
, et al.
Tumour evolution inferred by single-cell sequencing . Nature.
2011; ; 472 : :90.–94. 9.
Marusyk
A
,
Polyak
K
. Tumor heterogeneity: causes and consequences . Biochim Biophys Acta.
2010; ; 1805 : :105.–117. |