| |
| Med Sci (Paris). 2011 November; 27(11): 940–944. Published online 2011 November 30. doi: 10.1051/medsci/20112711009.La cavéoline-1 force le remodelage de la matrice extracellulaire Jacky G. Goetz1* and Miguel Angel Del Pozo2** 1Institut de génétique et de biologie moléculaire et cellulaire (IGBMC), 67404Illkirch, France 2Centro Nacional de Investigaciones Cardiovasculares (CNIC), 28029Madrid, Espagne MeSH keywords: Marqueurs biologiques tumoraux, métabolisme, physiologie, Phénomènes biomécaniques, Cavéoline-1, Matrice extracellulaire, anatomopathologie, Humains, Modèles biologiques, Tumeurs, diagnostic, ultrastructure, Microenvironnement tumoral |
Rigidité des tissus tumoraux
In vivo, la plupart des cellules évoluent dans un environnement tridimensionnel dont l’architecture, les propriétés biomécaniques et physicochimiques sculptent les tissus et promeuvent leur fonctionnalité [
1]. Les cellules stromales, dont les fibroblastes constituent la grande majorité, sécrètent et remodèlent les fibres de la matrice extracellulaire qui, selon un mécanisme de « mécano-réciprocité », influencera leur propre comportement ainsi que celui des cellules voisines. Par exemple, le développement d’un tissu au cours de l’embryogenèse est contrôlé par différents modules opérant de l’échelle moléculaire à l’échelle tissulaire et gouvernant la signalisation cellulaire et l’expression génique [
2,
3]. Par ailleurs, les tensions mécaniques qui existent à l’échelle tissulaire déterminent l’identité des cellules souches [
4]. L’architecture de structures épithéliales telles que les glandes mammaires dépend étroitement de l’élasticité de la matrice extracellulaire et de la tension cellulaire [
5]. Les forces qu’exercent les tensions issues de la matrice extracellulaire s’avèrent ainsi essentielles à la physiologie tissulaire mais contribuent également à certains scénarios pathologiques. L’un des exemples les plus frappants est le cancer du sein dont une caractéristique majeure est la rigidité des tissus tumoraux. La palpation s’avère d’ailleurs être la manière la plus efficace de détecter le développement précoce d’un carcinome mammaire. En 2005, l’équipe de Valérie Weaver faisait une découverte majeure en démontrant que la rigidité des tissus tumoraux était conférée par leur stroma - la matrice environnante. Cette rigidité est détectée à la membrane plasmique par les intégrines, véritables chefs d’orchestre de la mécanotransduction [
6]. Une fois activées et regroupées, celles-ci transmettent la rigidité extracellulaire à la cellule en augmentant la tension du cytosquelette d’actine à travers l’activation de la petite GTPase Rho. La rigidité de la matrice environnante contrarie ainsi la polarité épithéliale en détruisant les contacts intercellulaires et en empêchant la formation du lumen, à l’origine de la formation d’un carcinome mammaire [
7]. Cette même équipe confirma tout récemment ces travaux et démontra que la formation de carcinomes mammaires in vivo s’accompagnait d’une augmentation de la rigidité des fibres de collagène environnantes ; la contrarier en ciblant une enzyme impliquée dans la polymérisation de ces fibres suffisait à réduire à la fois l’apparition et l’agressivité des mêmes carcinomes [
8]. La formation d’un carcinome s’accompagne également d’une rupture de la lame basale et d’un recrutement de cellules stromales, les myofibroblastes [5]. Celles-ci consolident (voire induisent) le caractère rigide tout en sculptant - à travers l’activation de la petite GTPase Rho - le stroma péritumoral. L’orientation de fibres par rapport à la frontière tumorale dicte son potentiel invasif : une orientation parallèle conduit à l’encapsulation de la tumeur et contraint son invasion, une orientation perpendiculaire la promeut [
9]. En effet, les myofibroblastes associés aux carcinomes, non seulement rigidifient la matrice environnante, mais ils la remodèlent également de telle manière que se créent de véritables autoroutes pour l’invasion des cellules tumorales, qu’ils précèderont toujours [
10]. Outre cette composante mécanique, ces cellules mésenchymateuses - souches pour certaines - facilitent la progression tumorale via la sécrétion paracrine de cytokines [
11,
12]. Ces découvertes récentes contrastent vivement avec la vision réductionniste qu’une tumeur n’est autre qu’un amas de cellules tumorales dont le développement repose sur leur potentiel autonome et justifient l’émergence d’un nouveau domaine d’investigation, le microenvironnement tumoral. |
Rôle de la cavéoline-1 dans l’organisation de la matrice extracellulaire La cavéoline-1, protéine transmembranaire connue pour son rôle primordial dans la formation des structures endocytiques que sont les cavéoles, pouvait prétendre à un rôle important dans ce microenvironnement. En effet, l’implication de cette protéine dans le développement tumoral faisait l’objet d’une intense controverse, certains lui attribuant un rôle protumoral, d’autres antitumoral [
13]. Néanmoins, un consensus se dessinait progressivement : alors que les cellules tumorales ou nouvellement transformées perdaient l’expression de la cavéoline-1, l’acquisition de traits métastatiques corrélait avec une réexpression de cette protéine permettant notamment de rendre les cellules plus motiles [
14]. Par ailleurs, la cavéoline-1 est fortement exprimée par les fibroblastes, ce qui suggère son rôle potentiel dans le remodelage de la matrice extracellulaire [
15]. En effet, des travaux menés dans notre laboratoire ont montré que la morphologie et l’aptitude à migrer de manière directionnelle des fibroblastes s’avèrent être étroitement contrôlées par la cavéoline-1 et le contrôle qu’elle exerce sur la signalisation des petites GTPases Rho. Une hypothèse évidente émergeait de ces observations : la cavéoline-1, par son influence sur les RhoGTPases, régulait le remodelage de la matrice extracellulaire et, par ce biais, affectait l’architecture tridimensionnelle à la fois de tissus sains et tumoraux. Pour tester cette hypothèse, nous avons eu recours à une approche multidisciplinaire basée sur l’utilisation d’approches physiologiques in vivo, mais également de modèles de culture cellulaire tridimensionnels jusqu’alors peu exploités [
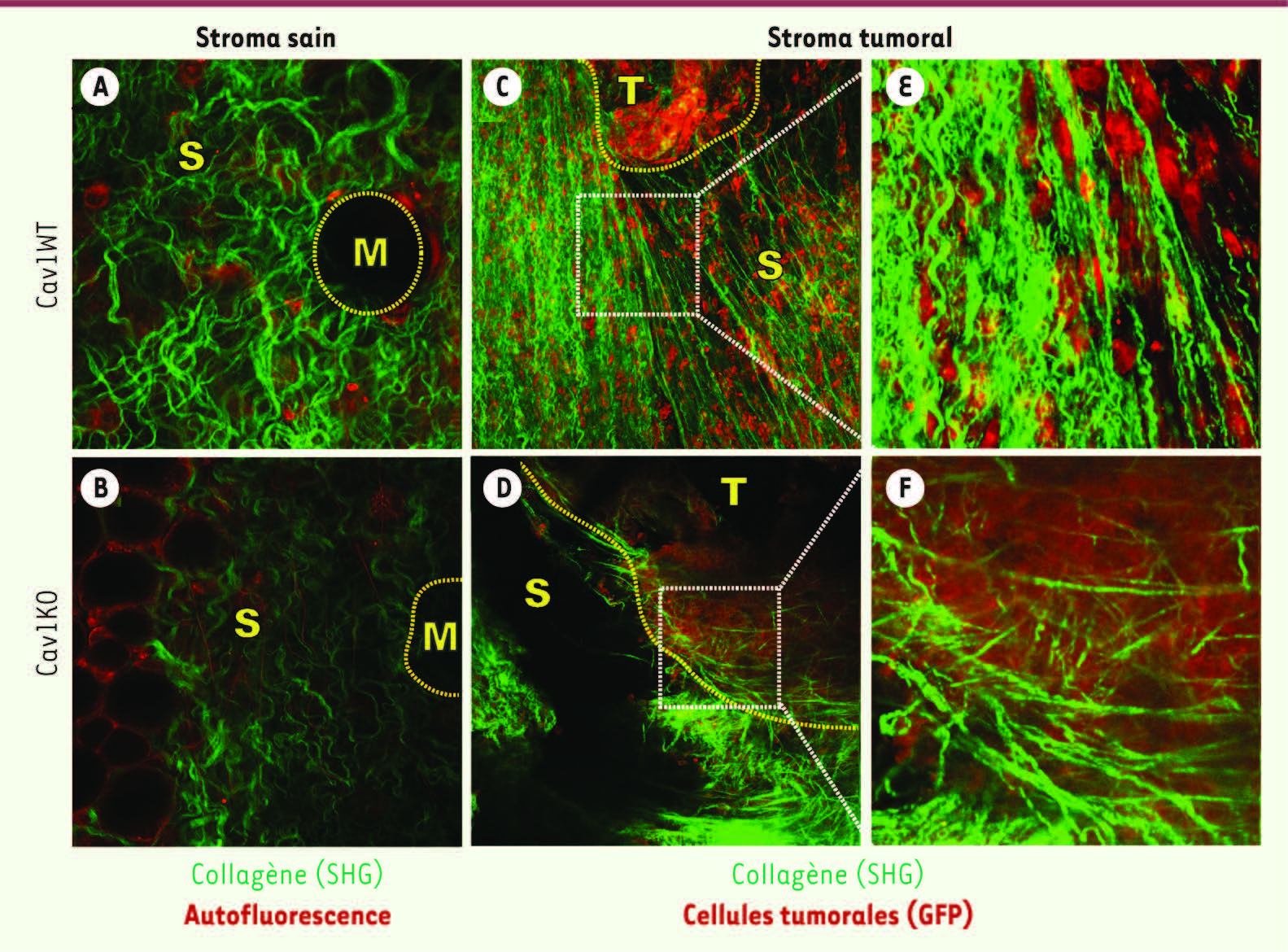
16]. Le premier modèle consistait à créer in vitro des environnements tridimensionnels ayant conservé leurs propriétés mécaniques, topographiques et moléculaires. Pour ce faire, nous avons eu recours à une méthode développée par Edna Cukierman qui consistait à cultiver pendant huit jours une population de fibroblastes tout en stimulant la sécrétion et la stabilisation de protéines de la matrice extracellulaire. La matrice ainsi créée peut être physiquement séparée - tout en restant intacte - des cellules l’ayant créée, à l’aide d’un tampon au pH très basique. Nous avons ainsi pu démontrer que des fibroblastes n’exprimant pas la cavéoline-1, non seulement n’acquéraient pas une morphologie caractéristique dans des environnements tridimensionnels, mais étaient également incapables de remodeler la matrice environnante. En effet, les fibres des matrices créées à l’aide de ces fibroblastes avaient une distribution aléatoire et non ordonnée, alors que celles provenant de fibroblastes sauvages (exprimant la cavéoline-1) étaient mieux alignées et organisées. À l’aide de la microscopie à force atomique, nous avons ensuite démontré que des matrices déposées par des fibroblastes dépourvus de cavéoline-1 étaient sensiblement moins rigides que celles créées par des fibroblastes exprimant la cavéoline-1, et étaient incapables de conférer aux cellules qui y avaient été ensemencées une morphologie normale. En effet, les cellules ensemencées dans ces matrices étaient incapables de créer des contacts suffisants avec la matrice pour stimuler la morphogenèse cellulaire. Ce résultat mettait en évidence une fois de plus l’importance des influences mécaniques et de l’échange bidirectionnel qui existent entre une cellule et son environnement. À l’aide de la microscopie multiphotonique et de la propriété qu’ont les fibres de collagène d’émettre un signal de seconde harmonique1, mais également de techniques simples d’histologie, nous avons observé in vivo des altérations de l’architecture du stroma de tissus tels que la peau et les glandes mammaires chez la souris (Figure 1).
 | Figure 1
L’architecture du stroma de glandes mammaires saines et de carcinomes mammaires est contrôlée par la cavéoline-1. L’émission de signal de seconde harmonique détectée à l’aide d’un microscope à excitation multiphotonique permet de visualiser in vivo et de façon non invasive les fibres de collagène au sein de glandes (A, B) et de carcinomes mammaires (C-F). L’absence d’expression stromale de la cavéoline-1 décroît le signal - et donc l’organisation des fibres - au niveau de glandes mammaires saines (A, B). Par ailleurs, l’expression stromale de la cavéoline-1 promeut le remodelage de ces fibres lors de l’évolution d’un carcinome mammaire (C-F). En présence de la cavéoline-1, les fibres sont fortement alignées et perpendiculaires à la frontière tumeur-stroma, permettant ainsi l’invasion des cellules tumorales le long de ces dernières (C, E). Inversement, l’absence de la cavéoline-1 conduit à l’encapsulation de la tumeur à l’intérieur de fibres orientées parallèlement à cette même frontière (D, F). M : glande mammaire; T : tumeur; S : stroma (images tirées de [ 16] © Cell). |
|
Remodelage du stroma péri- et intratumoral par la cavéoline-1 Nous avons par la suite voulu savoir si l’absence de la cavéoline-1 dans les fibroblastes pouvait affecter le comportement in vitro et in vivo de cellules tumorales. L’utilisation de deux modèles différents d’invasion tumorale in vitro a permis de mettre en évidence qu’un microenvironnement produit par des fibroblastes exprimant la cavéoline-1 promouvait fortement le potentiel invasif de cellules métastatiques. In vivo, l’utilisation combinée d’injections orthotopiques d’allogreffe et de xénogreffe au niveau des glandes mammaires de souris sauvages et knock-out pour la cavéoline-1 nous a permis de démontrer qu’un stroma dépourvu de cavéoline-1 empêchait à la fois la croissance tumorale et la formation de métastases. Dans le but de pouvoir contrôler la population de fibroblastes à l’origine du remodelage de la matrice, nous avons également développé un modèle expérimental basé sur l’injection sous-cutanée d’un gel contenant à la fois les cellules tumorales et les fibroblastes de notre choix, et nous avons ainsi confirmé le rôle protumoral et prométastatique des fibroblastes exprimant la cavéoline-1. Une analyse détaillée des échantillons prélevés sur les différentes souris injectées a mis en évidence que l’expression fibroblastique de la cavéoline-1 permet de remodeler le stroma péri et intratumoral. Les fibres encerclant la tumeur étaient orientées perpendiculairement à la frontière stroma-tumeur, ce qui stimulait l’invasion locale, alors qu’elles restaient parallèles à cette même frontière en l’absence de cavéoline-1, encapsulant la tumeur et réprimant son potentiel invasif (Figure 1). De manière concomitante, l’expression de la cavéoline-1 dans le stroma favorise l’alignement des fibres intratumorales, dont le degré corrèle presque parfaitement avec le potentiel métastatique des tumeurs. À l’inverse, l’absence d’expression de la cavéoline-1 par les fibroblastes induit un environnement désorganisé, voire chaotique, similaire à celui qui est observé in vitro. |
Cavéoline-1, marqueur potentiel diagnostique de carcinomes humains ? Enfin, nous avons voulu tester la pertinence clinique et diagnostique de nos observations expérimentales. Pour ce faire, nous avons étudié le stroma de carcinomes mammaires, colorectaux, rénaux ainsi que celui de métastases de mélanomes. Dans tous les cas, le stroma, et plus spécifiquement les fibroblastes associés aux tumeurs, exprimaient très fortement la cavéoline-1. Dans le cas particulier des tumeurs mammaires, l’étude approfondie de 140 échantillons a révélé que l’expression de la cavéoline-1 dans le stroma associé aux carcinomes était un facteur de mauvais pronostic et corrélait de manière significative avec une diminution de la survie. En conclusion, nos observations montrent que l’expression endogène de la cavéoline-1 par les fibroblastes et l’architecture de la matrice que ceux-ci génèrent agissent en concertation pour favoriser la morphologie cellulaire et tissulaire ainsi que l’invasivité tumorale (Figure 2). Ces résultats suggèrent non seulement que l’influence de la cavéoline-1 dans l’échange bidirectionnel et mécanique entre la matrice et les cellules est essentielle pour une bonne homéostasie et architecture tissulaire(s), mais surtout qu’elle est cruciale à la progression tumorale, en particulier à l’invasion locale et à la formation de métastases. Nos résultats identifient la cavéoline-1 comme un potentiel marqueur diagnostique de carcinomes et confirment l’importance du microenvironnement ambiant dans la progression tumorale.
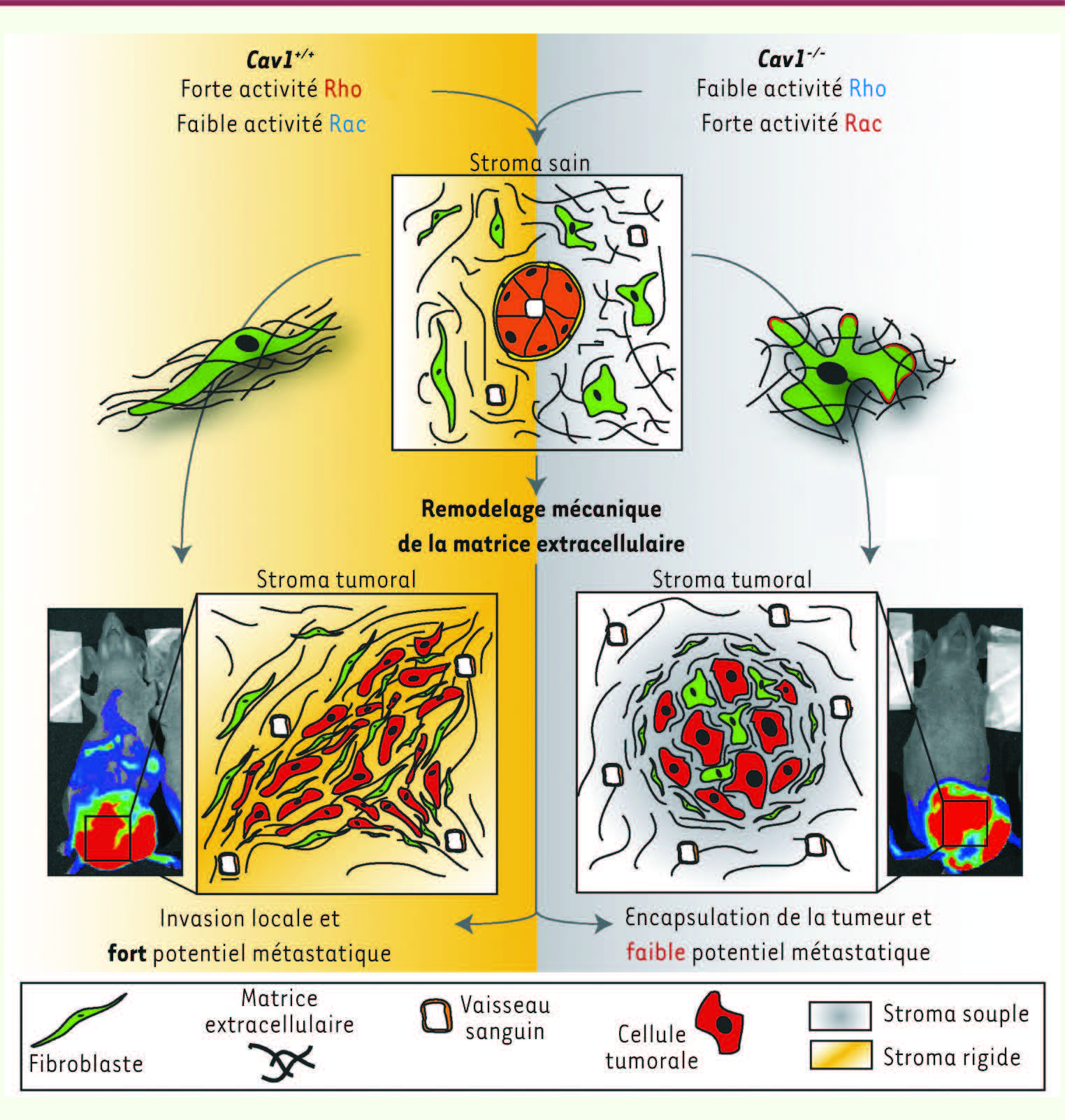
 | Figure 2
La cavéoline-1 sculpte la matrice extracellulaire. Le remodelage physiologique et pathologique de la matrice extracellulaire est dicté par l’expression fibroblastique de la cavéoline-1. Les fibroblastes exprimant la cavéoline-1 sont allongés et produisent une matrice rigide et organisée, alors que les fibroblastes dépourvus de cavéoline-1 présentent une altération de leur morphologie et de la matrice qu’ils produisent (en haut). Au sein de tumeurs, l’expression de la cavéoline-1 promeut le remodelage péri et intratumoral de la matrice environnante, ce qui conduit à l’invasion locale et à la formation de métastases, représentées par l’apparition de multiples foyers bioluminescents au sein d’organes solides et lymphoïdes (en bas à gauche). Inversement, l’absence de la cavéoline-1 conduit à l’encapsulation de la tumeur, ce qui entrave la formation de métastases (en bas à droite) (images tirées de [ 16] © Cell). |
|
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Ce travail a été financé par des subventions attribuées à MAP (SAF2008-02100, RTICC RD06/0020/1033 and CSD2009-00016). JGG est soutenu par une bourse européenne Marie Curie FP7 (IEF).
|
Footnotes |
1.
Engler
AJ
,
Humbert
PO
,
Wehrle-Haller
B
,
Weaver
VM
. Multiscale modeling of form and function . Science.
2009; ; 324 : :208.–212. 2.
Krieg
M
,
Arboleda-Estudillo
Y
,
Puech
PH
, et al.
Tensile forces govern germ-layer organization in zebrafish . Nat Cell Biol.
2008; ; 10 : :429.–436. 3.
Viasnoff
V
. Vers une cartographie des tensions mécaniques intracellulaires ?
Med Sci (Paris).
2011; ; 27 : :14.–16. 4.
Engler
AJ
,
Sen
S
,
Sweeney
HL
,
Discher
DE
. Matrix elasticity directs stem cell lineage specification . Cell.
2006; ; 126 : :677.–689. 5.
Ronnov-Jessen
L
,
Bissell
MJ
. Breast cancer by proxy: can the microenvironment be both the cause and consequence?
Trends Mol Med.
2008; ; 15 : :5.–13. 6.
Albiges-Rizo
C
,
Bouvard
D
,
Bouin
AP
, et al.
La taline : une allure d’haltérophile et la pratique du stretching pour mieux transmettre les forces . Med Sci (Paris).
2009; ; 25 : :909.–911. 7.
Paszek
MJ
,
Zahir
N
,
Johnson
KR
, et al.
Tensional homeostasis and the malignant phenotype . Cancer Cell.
2005; ; 8 : :241.–254. 8.
Levental
KR
,
Yu
H
,
Kass
L
, et al.
Matrix crosslinking forces tumor progression by enhancing integrin signaling . Cell.
2009; ; 139 : :891.–906. 9.
Provenzano
PP
,
Eliceiri
KW
,
Campbell
JM
, et al.
Collagen reorganization at the tumor-stromal interface facilitates local invasion . BMC Med.
2006; ; 4 : :38.. 10.
Gaggioli
C
,
Hooper
S
,
Hidalgo-Carcedo
C
, et al.
Fibroblast-led collective invasion of carcinoma cells with differing roles for RhoGTPases in leading and following cells . Nat Cell Biol.
2007; ; 9 : :1392.–1400. 11.
Karnoub
AE
,
Dash
AB
,
Vo
AP
, et al.
Mesenchymal stem cells within tumour stroma promote breast cancer metastasis . Nature.
2007; ; 449 : :557.–563. 12.
Orimo
A
,
Gupta
PB
,
Sgroi
DC
, et al.
Stromal fibroblasts present in invasive human breast carcinomas promote tumor growth and angiogenesis through elevated SDF-1/CXCL12 secretion . Cell.
2005; ; 121 : :335.–348. 13.
Goetz
JG
,
Lajoie
P
,
Wiseman
SM
,
Nabi
IR
. Caveolin-1 in tumor progression: the good, the bad and the ugly . Cancer Metastasis Rev.
2008; ; 27 : :715.–735. 14.
Goetz
JG
,
Joshi
B
,
Lajoie
P
, et al.
Concerted regulation of focal adhesion dynamics by galectin-3 and tyrosine-phosphorylated caveolin-1 . J Cell Biol.
2008; ; 180 : :1261.–1275. 15.
Grande-Garcia
A
,
Echarri
A
,
de Rooij
J
, et al.
Caveolin-1 regulates cell polarization and directional migration through Src kinase and Rho GTPases . J Cell Biol.
2007; ; 177 : :683.–694. 16.
Goetz
JG
,
Minguet
S
,
Navarro-Lerida
I
, et al.
Biomechanical remodeling of the microenvironment by stromal caveolin-1 favors tumor invasion and metastasis . Cell.
2011; ; 146 : :148.–163. |