| |
| Med Sci (Paris). 2011 November; 27(11): 979–985. Published online 2011 November 30. doi: 10.1051/medsci/20112711014.Sonic Hedgehog, un morphogène en quête de fonction dans le cerveau adulte Martial Ruat,1* Élodie Angot,1 and Élisabeth Traiffort1** 1CNRS, Institut de neurobiologie Alfred Fessard, Laboratoire de neurobiologie et développement, équipe transduction du signal et neuropharmacologie développementale, UPR-3294 du CNRS, 1, avenue de la Terrasse, Bâtiment 33, F-91198, Gif-sur-Yvette, France |
Chez les mammifères, le morphogène Sonic Hedgehog (Shh) joue un rôle primordial au cours du développement du système nerveux central notamment lors du développement de la partie ventrale du tube neural où Shh est indispensable à la génération des motoneurones, interneurones et oligodendrocytes [
1]. La découverte d’une voie de signalisation Shh dans le cerveau de rongeurs adultes a révélé de nouvelles fonctions associées à cette protéine [
2]. La présente revue dresse le bilan des connaissances acquises sur la distribution cérébrale des effecteurs de la voie Shh, mais aussi sur le rôle de cette voie dans le maintien des précurseurs neuraux adultes et la régulation de l’activité neuronale, ou encore son implication dans les tumeurs cérébrales et les maladies neurodégénératives. |
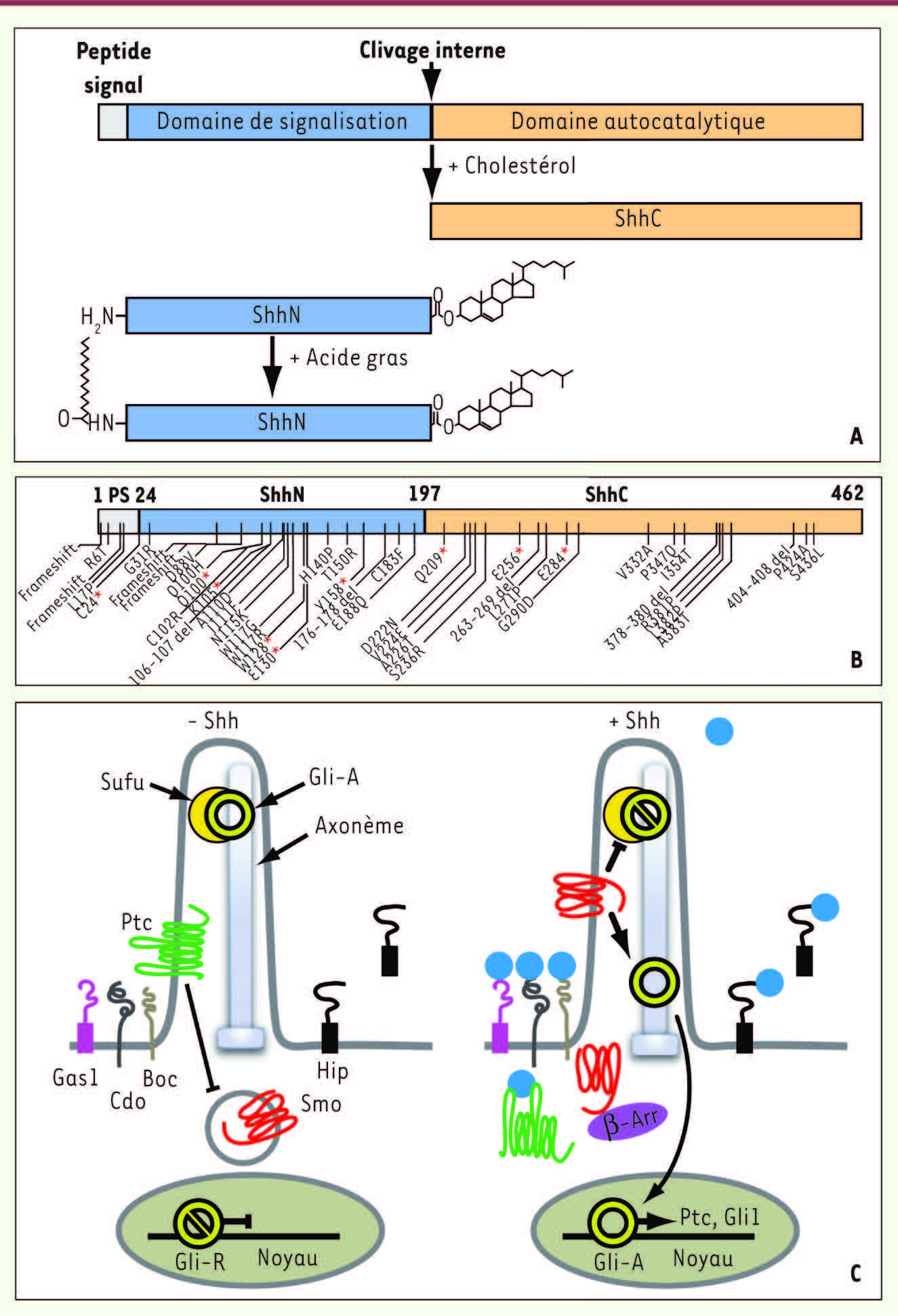
La voie de signalisation Hedgehog La protéine Shh est synthétisée sous forme d’un précurseur capable de s’autoprotéolyser et de générer un polypeptide amino-terminal actif (Figure 1A), désigné par la suite ShhN. Ce dernier exerce ses activités en se fixant sur la protéine membranaire Patched (Ptc), levant ainsi l’inhibition que Ptc exerce sur le récepteur à sept domaines transmembranaires Smoothened (Smo). L’activation de la voie Shh est à l’origine d’une cascade de signalisations intracellulaires complexes qui met notamment en jeu les facteurs de transcription de la famille Gli et aboutit à la régulation de l’expression de gènes cibles tels Patched lui-même (Figure 1C). Une activité Shh déficiente au cours de l’embryogenèse, liée par exemple à des mutations de Shh localisées dans la partie codant pour le fragment actif amino-terminal ShhN ou dans la partie carboxy-terminale impliquée dans l’autoprotéolyse, peut se traduire par une pathologie, l’holoprosencéphalie (Figure 1B). Cette dernière associe des anomalies cérébrales à des malformations de la tête chez l’homme. Plus récemment, le cil primaire, un organite (comportant un axonème de quelques microns) présent à la surface de la plupart des cellules chez les vertébrés, a également été impliqué dans la transmission du signal Shh in vitro et in vivo [
3,
4]. Des réponses qui mettent en jeu les composantes de la voie Shh, mais n’utilisent pas les mécanismes initialement décrits ont également été rapportées. Il s’agit, par exemple, des effets antiprolifératifs ou proapoptotiques médiés par Ptc en l’absence de son ligand, ou de réponses transmises indépendamment de la cascade Ptc-Smo-Gli ou ne faisant pas appel à l’induction transcriptionnelle par les facteurs Gli tels que, respectivement, les effets de Shh sur la migration des cellules de la crête neurale ou sur le guidage axonal [
5,
6].
 | Figure 1.
Synthèse de la protéine Shh, localisation des mutations associées à l’holoprosencéphalie et transduction du signal Shh. A. La protéine Shh est sécrétée sous forme d’un précurseur de 48 kDa possédant un peptide signal à son extrémité amino-terminale. Le précurseur est capable de s’autoprotéolyser grâce à l’activité de son domaine autocatalytique et de générer une protéine amino-terminale ShhN de 20 kDa constituant le domaine de la protéine responsable de la signalisation. ShhN est modifiée de façon covalente par un acide gras et une molécule de cholestérol respectivement à ses extrémités amino- et carboxy-terminales. B. Les mutations, délétions et insertions identifiées chez des sujets atteints d’holoprosencéphalie sont distribuées dans le peptide signal (PS) (acides aminés 1-23) et les polypeptides amino- et carboxy-terminaux (respectivement, acides aminés 24-197 et 198-462). Les étoiles rouges et « del » indiquent respectivement des mutations non-sens et les délétions (une liste complète des mutations identifiées chez l’homme est disponible à l’adresse www.hgmd.cf.ac.uk).
C. ShhN utilise le cil primaire pour transmettre son signal. En l’absence de son ligand (schéma de gauche), le récepteur Ptc, une protéine membranaire apparentée aux perméases bactériennes, est localisé dans le cil et réprime Smo, un membre potentiel de la famille des récepteurs à sept domaines transmembranaires couplés aux protéines G. Smo est alors majoritairement situé en dehors du cil. Le régulateur négatif Su(Fu) interagit avec les formes activatrices des facteurs de transcription Gli (GliA) et les maintient en dehors du noyau. À l’inverse, la forme répressive des facteurs Gli (GliR) est générée et migre dans le noyau. La transcription des gènes cibles est bloquée. En présence de Shh (schéma de droite), Ptc est internalisé, l’inhibition exercée sur Smo est levée permettant sa translocation dans le cil vraisemblablement par interaction avec la β-arrestine (β-Arr). Dans le cil, Smo peut inhiber la formation de Gli-R et activer Gli-A dont la translocation dans le noyau permet d’induire la transcription des gènes cibles de la voie comme Ptc et Gli1. Sur la membrane de la cellule, les protéines Hip, Boc, Cdo et Gas1 sont également proposées comme des récepteurs de Shh capables de moduler son activité signalisatrice. |
|
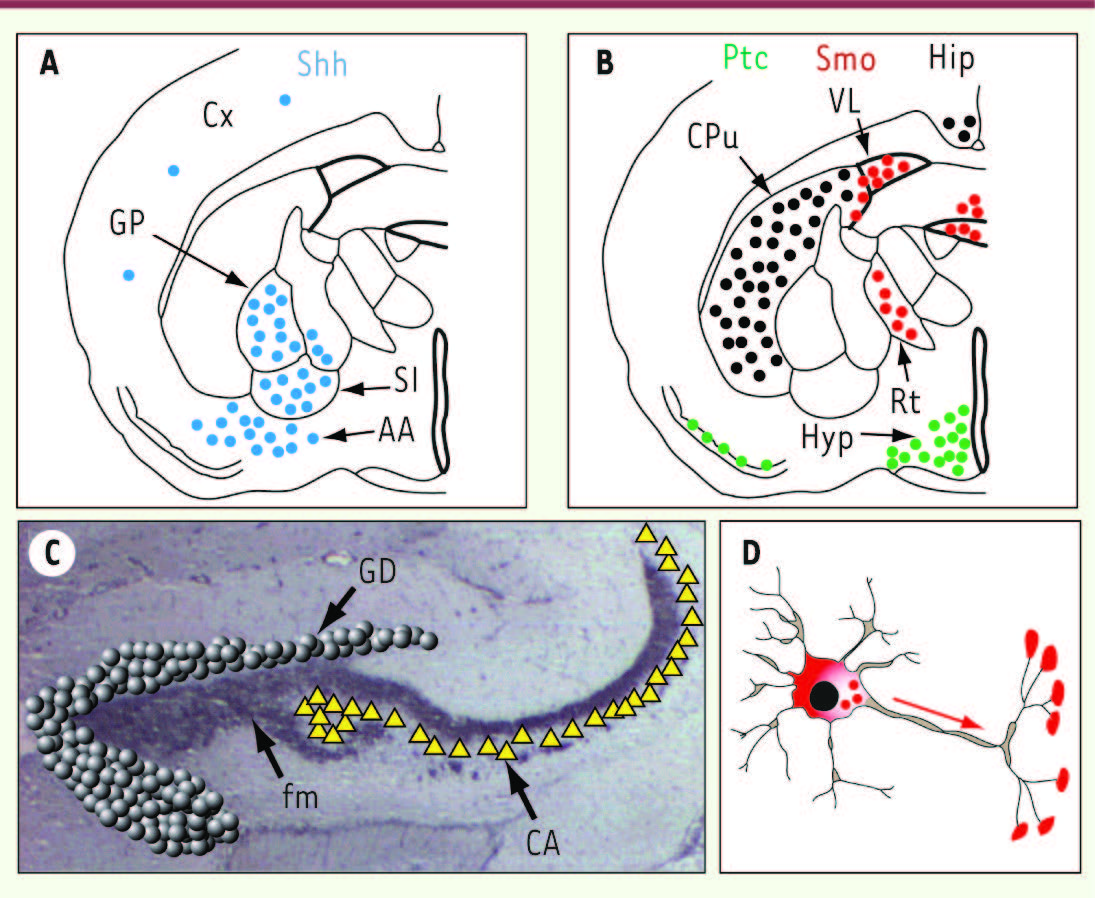
Voie de signalisation Hedgehog neuronale Expression des effecteurs de Shh En 1998, l’identification de neurones exprimant Shh ou encore ses récepteurs Ptc et Smo dans diverses aires cérébrales chez le rongeur adulte a été l’indice d’une voie de signalisation Shh spécifique. La distribution des cellules exprimant les différents effecteurs impliqués dans cette signalisation a alors été établie (Figure 2A
,
2B). Elle a également été rapportée dans quelques régions du cerveau de primates [ 2]. Chez les rongeurs, les cellules qui expriment Shh sont des neurones GABAergiques, les cellules de Purkinje du cortex cérébelleux et les motoneurones des noyaux moteurs des nerfs crâniens et de la moelle épinière. Ptc ainsi que Hip ( Hedgehog-interacting protein), qui code pour une protéine capable de fixer Shh et d’inhiber son activité, sont fréquemment détectés dans des régions n’exprimant pas les transcrits Shh, mais correspondant à des aires de projection des neurones exprimant ces transcrits. L’expression de Hip est par ailleurs détectée dans une population de neurones striataux exprimant l’enzyme de synthèse de l’oxyde nitrique, suggérant une possible interaction entre ces deux systèmes de signalisation. Des structures comme le noyau facial coexpriment Shh et Ptc, laissant envisager l’existence d’une signalisation locale indépendante de Smo à l’inverse de ce qui est observé dans le cortex cérébelleux, le gyrus denté de l’hippocampe et l’hypothalamus où Ptc et Smo sont colocalisés. L’expression de Smo en l’absence de Ptc notamment dans les organes circumventriculaires et le noyau réticulaire du thalamus suggère que d’autres mécanismes moléculaires sont capables de réguler l’activité de Smo. De façon intéressante, dans la glande pinéale, qui joue un rôle central dans la régulation des rythmes biologiques, l’expression de Ptc serait potentiellement indépendante de Shh et serait régulée par un mécanisme d’horloge [
7].
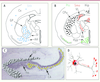 | Figure 2.
Localisation des cellules exprimant Shh, Ptc, Smo et Hip dans le cerveau de rongeurs. A, B. Schéma d’une section frontale de cerveau de rat sur laquelle les transcrits de Shh (bleu, A), Ptc (vert, B), Smo (rouge, B) et Hip (noir, B) sont identifiés par des pastilles colorées. AA : amygdale antérieure ; Cx : cortex cérébral ; CPu : caudé putamen ; GP : globus pallidus ; Hyp : hypothalamus ; Rt : noyau réticulaire du thalamus ; SI : substance innominée ; VL : ventricule latéral. C. Expérience d’immunohistochimie réalisée sur une section sagittale de cerveau de souris en utilisant un antisérum anti-Smo. L’immunoréactivité Smo est observée au niveau des fibres moussues (fm) de l’hippocampe qui sont les axones des cellules granulaires (sphères grises) du gyrus denté (GD) projetant vers les cellules de la corne d’Ammon (CA, triangles jaunes). D. Schéma d’un neurone granulaire dans lequel la protéine Smo (rouge) est synthétisée dans le corps cellulaire, puis transportée jusqu’aux terminaisons de sa projection axonale, la fibre moussue. |
Localisation de Shh dans les aires cérébrales Fortement exprimée avant la naissance et plus faiblement au cours des stades néonataux précoces chez les rongeurs, la protéine ShhN présente un niveau d’expression élevé chez l’adulte laissant supposer l’existence de nouveaux rôles pour Shh dans le cerveau mature [ 2]. ShhN est détectée dans le cortex cérébelleux, les régions ventrales du télencéphale, le cortex cérébral, mais aussi dans les passages de fibres [
8] en accord avec la description de son transport axonal identifié entre les cellules ganglionnaires de la rétine et leur principale aire de projection, les collicules supérieurs. De façon surprenante, la protéine est enrichie dans des microdomaines de la membrane plasmique appelés radeaux lipidiques et considérés comme un lieu d’échafaudage de récepteurs de multiples voies de signalisation. Plusieurs hypothèses ont été avancées afin d’expliquer comment cette molécule lipidique peut être sécrétée. Au cours du développement embryonnaire, Dispatched, une protéine apparentée, comme Ptc, aux transporteurs bactériens et exprimée par les cellules qui synthétisent le morphogène, pourrait participer à cette sécrétion. Il en est de même des protéines de la matrice extracellulaire appelées protéoglycanes à héparanes sulfates dont la présence est requise pour la modulation des activités de prolifération et de spécification induites par ShhN dans différentes régions du cerveau en développement [ 4]. L’identification des aires de réception du signal Shh repose soit sur l’utilisation d’anticorps reconnaissant les composantes réceptrices du signal ou participant à sa transmission intracellulaire, soit sur la caractérisation de lignées de souris exprimant un gène rapporteur contrôlé par le promoteur spécifique de l’une de ces composantes. Les lignées de souris Ptc-LacZ et Gli1-LacZ révèlent des localisations de Ptc et Gli1 compatibles avec les sources endogènes de Shh [ 8]. L’étude de ces lignées ainsi que des lignées Gli2-LacZ et Gli3-LacZ ont permis de montrer que des populations d’astrocytes expriment l’ensemble de ces composantes [
9]. Par ailleurs, des anticorps spécifiques ont permis de visualiser Smo dans les terminaisons synaptiques des fibres moussues du gyrus denté de l’hippocampe (Figure 2C, 2D), en association étroite avec les vésicules synaptiques observées en microscopie électronique [ 2]. |
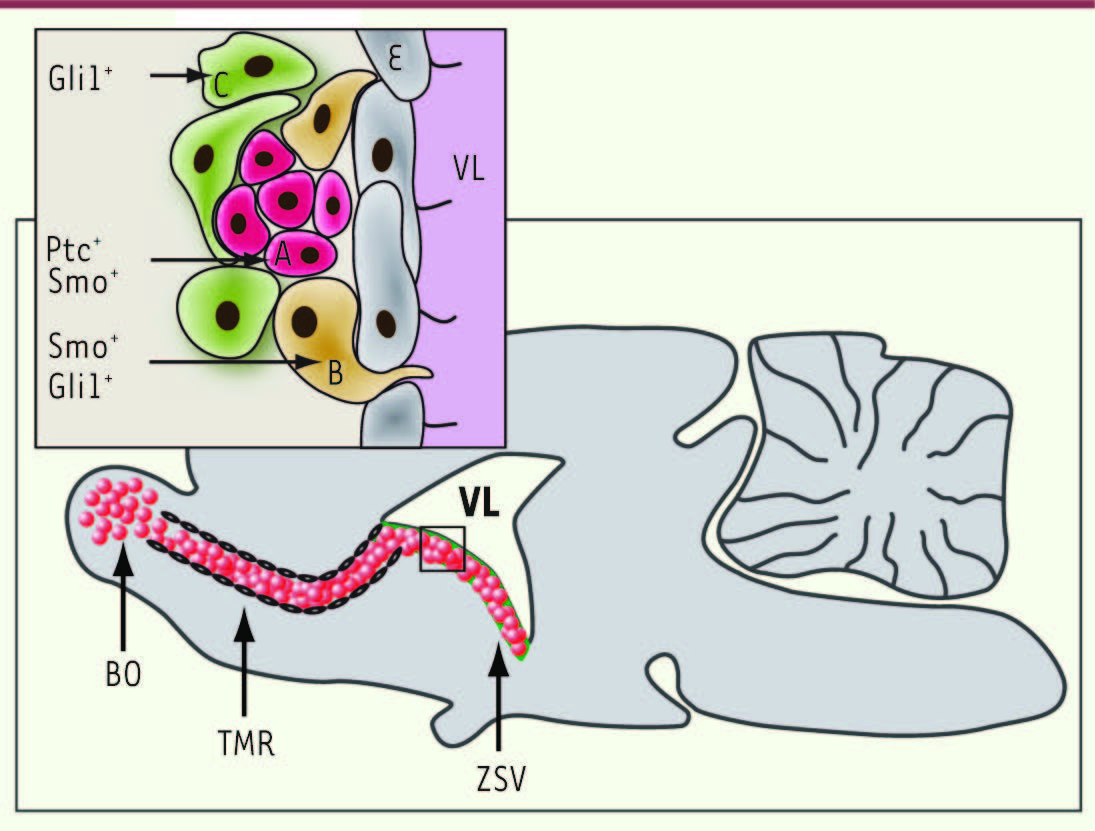
Signalisation Shh dans les zones de neurogenèse et contrôle des propriétés des précurseurs neuraux adultes La zone sous-ventriculaire (ZSV) des ventricules latéraux est l’une des principales aires de neurogenèse du cerveau adulte générant de nouveaux neurones tout au long de la vie (Figure 3) [
10]). La voie Shh est active dans ce système neurogénique [8,
11]. L’expression de Gli1 par les cellules B (cellules souches astrocytaires) et C (les cellules transitoires à amplification rapide) [
12] et celle de Ptc par les cellules A (neuroblastes migrants) [
13] indiquent que l’ensemble des cellules constituant cette niche neurogénique sont capables de répondre à la signalisation Shh. De plus, la protéine ShhN, détectable dans la ZSV et le liquide céphalorachidien, pourrait être synthétisée soit localement, soit à distance par des neurones projetant à proximité de la ZSV ou par les cellules de la paroi du troisième ventricule qui pourraient sécréter la protéine dans le liquide céphalorachidien [13,
14].
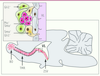 | Figure 3.
Shh régule la migration des neuroblastes du cerveau adulte. Le schéma illustre la niche neurogénique de la zone sous-ventriculaire (ZSV) où sont continuellement générées de nouvelles cellules, le trajet de migration rostral (TMR) à travers lequel migrent les précurseurs des neurones (neuroblastes visualisés par des sphères rouges) qui viennent d’être générés, et les bulbes olfactifs (BO), la destination finale de ces cellules. Le long du TMR, les neuroblastes migrent à l’intérieur d’un tunnel de cellules gliales (noir). L’agrandissement de la paroi du ventricule latéral (VL) indique que les cellules constituant la ZSV sont les cellules souches astrocytaires ou cellules B, les cellules transitoires à amplification rapide sont les cellules C et les neuroblastes migrants les cellules A. L’expression de Ptc, Smo et Gli1 est indiquée pour chacun de ces types cellulaires [ 12- 14]. Les cellules épendymaires ou cellules E constituent la zone ventriculaire. Le transfert adénoviral de Shh dans le VL accroît la rétention que Shh exerce sur les neuroblastes migrants, ce qui freine le nombre de neuroblastes qui sortent de la niche et donc de ceux qui atteignent les BO. À l’inverse, le blocage de l’activité de Shh par le transfert adénoviral de son antagoniste physiologique Hip dans le VL diminue la rétention exercée par Shh sur les cellules A et conduit à une augmentation du nombre de cellules migrantes atteignant les BO [ 14]. |
L’induction de la transcription de Ptc observée dans la ZSV après l’injection intracérébrale de la protéine ShhN recombinante a suggéré pour la première fois le caractère fonctionnel de la voie Shh dans le cerveau adulte [2]. La modulation de la prolifération cellulaire dans la ZSV par des molécules capables d’activer ou de bloquer Smo [8, 14] confirme ces résultats. Plus récemment, il a été montré que la protéine Shh était capable de retenir les neuroblastes nouvellement générés dans la ZSV en restreignant leur migration en direction du bulbe olfactif (Figure 3) et en s’opposant à l’activité d’autres protéines qui, à l’inverse, favorisent cette migration. Shh serait donc un facteur qui régule la migration des neuroblastes du cerveau adulte [13]. La modulation de cette activité de Shh par des molécules chimiques pourrait être intéressante dans le traitement de pathologies où le nombre et la capacité migratoire des neuroblastes sont réduits, comme dans le cas de la maladie de Parkinson. Cette nouvelle propriété de Shh permettra peut-être aussi de mieux comprendre les mécanismes qui aboutissent à la migration inappropriée des cellules cancéreuses à l’origine des métastases survenant dans les tumeurs cérébrales associées à une dérégulation de la signalisation Shh (voir plus loin). Des approches comparables ont permis de proposer le rôle critique de la signalisation Shh, via le cil primaire, dans l’expansion des progéniteurs neuraux dans la zone sous-granulaire (ZSG) de l’hippocampe, la seconde aire majeure de neurogenèse du cerveau adulte [2, 8,
15,
16]. La signalisation Shh contrôle également les précurseurs neuraux dans d’autres régions cérébrales. Ainsi, Shh participe à la maturation du cortex cérébelleux au cours des premières semaines post-natales en induisant la prolifération des précurseurs des cellules granulaires [
17]. Par ailleurs, une augmentation du nombre de cellules en phase proliférative est détectable dans plusieurs aires cérébrales après administration intracérébrale de la protéine ShhN [
18]. L’expression de marqueurs du lignage oligodendrocytaire par ces cellules en prolifération a permis de les identifier comme des précurseurs oligodendrocytaires [18]. La prolifération de précurseurs oligodendrocytaires est également observée dans un modèle de traumatisme lésionnel au cours duquel l’inflammation induirait l’expression de Shh dans des cellules astrocytaires [
19]. Ces données laissent envisager un rôle modulateur de Shh dans les pathologies associées à un déficit du lignage oligodendrocytaire. |
Contrôle des propriétés électrophysiologiques des neurones matures La large distribution de ShhN dans le cerveau a très rapidement suggéré l’existence d’activités autres que celles impliquées dans la régulation des propriétés des précurseurs neuraux. Cette hypothèse est confirmée par des études rapportant l’activité neuromodulatrice de Shh dans le noyau subthalamique [
20], l’une des régions dont l’activité est altérée dans la maladie de Parkinson, et dans le noyau du tractus solitaire impliqué dans la régulation cardiorespiratoire. Shh a d’ailleurs été proposé comme participant au processus d’acclimatation à l’hypoxie associé à l’augmentation de la réponse ventilatoire induite par une hypoxie prolongée [
21]. ShhN induit une inhibition de l’activité neuronale locale dans ces deux aires cérébrales suivie, dans le cas du noyau du tractus solitaire, d’une bouffée d’activité. Celle-ci rappelle l’activité détectée au cours des processus développementaux de croissance axonale et de formation du réseau neuronal suggérant que ShhN pourrait induire la réapparition d’activités détectables dans les neurones immatures. Ces réponses survenant en quelques minutes après l’activation de la voie font vraisemblablement intervenir un mécanisme non transcriptionnel déclenché très rapidement. |
La voie Shh, une cible thérapeutique potentielle dans les tumeurs cérébrales et les maladies neurodégénératives Voie Hedgehog et tumeurs cérébrales Les médulloblastomes, tumeurs cérébrales malignes les plus courantes chez l’enfant, sont des tumeurs primitives neuroectodermales du cervelet. Elles peuvent être liées à l’existence de mutations spontanées de l’un des effecteurs de la voie Shh, Ptc ou Smo, mais elles peuvent aussi faire partie du syndrome de Gorlin, une maladie génétique caractérisée par des mutations inactivatrices de Ptc [
22]. La perte d’activité de suppresseurs de tumeurs, la dégradation de régulateurs négatifs, l’activation de proto-oncogènes ou encore la régulation anormale de microARN (petits ARN non codants capables d’induire la dégradation ou de réprimer la traduction d’ARN messagers spécifiques) ont été proposées comme des mécanismes capables de déréguler l’activité de la voie et donc de favoriser le développement de tumeurs. Les cellules cibles de l’activité oncogénique de la signalisation Shh sont les précurseurs des cellules granulaires du cervelet. Les cellules souches cancéreuses identifiées dans les médulloblastomes murins expriment fortement Gli1 et ont perdu les mécanismes protecteurs qui conduisent les cellules souches non malignes à restreindre leur prolifération. La cyclopamine, un composé naturel et tératogène inhibant Smo, a été utilisée pour bloquer la voie Shh dans plusieurs modèles précliniques de médulloblastomes. Plus récemment, le composé GDC-0449 (Genentech, États-Unis) a permis une régression rapide de la tumeur dans un essai clinique de phase I chez un patient atteint d’un médulloblastome métastatique. Cette régression fut malheureusement suivie de l’apparition d’une résistance à la molécule liée à l’acquisition d’une mutation de Smo. L’investigation des mécanismes moléculaires et biochimiques impliqués dans cette résistance permettra d’améliorer l’efficacité des traitements. L’activation d’une famille de kinases (phosphoinositol 3-kinase) capables de phosphoryler des lipides a été récemment proposée comme l’un de ces mécanismes [
23]. Les autres tumeurs associées à une dérégulation de la voie Shh sont les gliomes (tumeurs cérébrales les plus communes chez l’adulte et qui possédent les caractéristiques géniques et morphologiques des cellules gliales) et les adénomes hypophysaires. Les cellules souches cancéreuses identifiées dans les gliomes dérivent de cellules exprimant le facteur de transcription Gli1. Le blocage de la voie Shh par la cyclopamine s’est révélé capable d’inhiber la prolifération de cellules dérivées de ces tumeurs [
24]. Dans le cas des adénomes hypophysaires, l’analyse de tumeurs humaines a suggéré que la signalisation Shh pourrait maintenir les cellules de l’hypophyse dans un état non prolifératif et que toute diminution de son activité pourrait être impliquée dans la genèse des adénomes hypophysaires (pour revue, voir [2]). Voie Hedgehog et autres pathologies cérébrales De nombreuses données expérimentales suggèrent que la signalisation Shh pourrait constituer une approche thérapeutique potentielle de plusieurs pathologies dégénératives cérébrales [ 2] (
Tableau I
). Pour la maladie de Parkinson et à un moindre degré pour la maladie d’Alzheimer, ces hypothèses reposent sur les activités de survie et de différenciation induites par Shh seul ou en présence d’autres facteurs de croissance. Ces activités ont été identifiées soit in vitro dans des cultures de précurseurs neuraux ou de neurones dopaminergiques, soit in vivo après transfert adénoviral de Shh ou de Gli1 dans des modèles animaux de la maladie de Parkinson. Par ailleurs, comme mentionné précédemment, Shh est capable de réduire in vitro l’activité des neurones du noyau subthalamique [ 20] dont la majorité des afférences sont issues du globus pallidus. Or, une réduction de la transcription de Shh a été rapportée dans le globus pallidus d’animaux modèles de la maladie de Parkinson. La normalisation des taux de Shh dans le noyau subthalamique pourrait donc constituer une nouvelle approche permettant de contrôler l’hyperactivité neuronale de cette aire cérébrale au cours de cette pathologie [ 20]. La modulation de l’activité Shh pourrait aussi être intéressante dans la maladie de Huntington puisque Shh a été proposé comme l’un des médiateurs des effets neuroprotecteurs du BDNF ( brain derived neurotrophic factor) lors du dysfonctionnement mitochondrial induit par l’acide 3-nitropropionique dans des cultures primaires de neurones corticaux [
25].
Tableau I.
| Régions cérébrales |
Rôles potentiels/pathologies |
Références |
| Cervelet |
Maturation du cortex cérébelleux |
[2, 22,
28] |
|
Médulloblastomes, neurotoxicité des glucocorticoïdes |
|
| Hippocampe |
Transmission synaptique |
[8, 15, 16,
26] |
| Zone sous-granulaire |
Maintien de la niche neurogénique |
|
|
Pathologies dépressives |
|
| Zone sous-ventriculaire |
Maintien de la niche neurogénique |
[8, 11-14, 24] |
|
Maladie de Parkinson, accidents ischémiques, gliomes |
|
| Cortex cérébral |
Régulation des précurseurs oligodendrocytaires |
[18, 19,
29,
30] |
| Corps calleux |
Pathologies démyélinisantes |
|
| Septum |
Différenciation et survie des neurones cholinergiques |
Pour revue [2] |
|
Maladie d’Alzheimer |
|
| Noyau subthalamique |
Régulation de l’activité neuronale |
[20] |
|
Maladie de Parkinson |
|
| Moelle épinière |
Régulation des précurseurs neuraux |
Pour revue [2] |
|
Lésions de la moelle |
|
| Hypophyse |
Régulation de la prolifération cellulaire |
Pour revue [2] |
|
Adénomes hypophysaires |
|
Principaux rôles proposés pour la signalisation Sonic Hedgehog dans le cerveau adulte et intérêts potentiels en thérapeutique.
|
Des liens ont aussi été établis entre les perturbations de la transmission monoaminergique cérébrale et la signalisation Shh. La déplétion combinée en sérotonine et norépinéphrine induit une réduction significative de Ptc et Smo dans l’hippocampe. Cependant les traitements aigus et chroniques par les antidépresseurs, capables de moduler la neurotransmission monoaminergique, ne régulent pas la cascade d’expressions des acteurs de la voie Shh contrairement aux chocs électroconvulsifs utilisés avec succès dans les désordres dépressifs majeurs. De plus amples investigations sont requises afin de déterminer le rôle potentiel de la signalisation Shh dans l’activité des antidépresseurs [26]. Les lésions traumatiques des nerfs et les accidents ischémiques sont d’autres conditions pathologiques où la modulation de la signalisation Shh pourrait être bénéfique pour la régénération neuronale [2]. Ainsi, la surexpression de Shh est capable de s’opposer à la mort neuronale induite dans un modèle de lésion du nerf facial. De plus, étant donné le rôle de Shh dans le guidage des axones au cours de l’embryogenèse [
27], on peut envisager que l’activation de la signalisation Shh puisse faciliter la croissance et le branchement des connexions axonales lésées. Par ailleurs, Shh serait responsable de la régulation des progéniteurs neuraux induite par un dérivé de l’érythropoïétine qui possède des propriétés neuroprotectives dans les accidents ischémiques aigus. Enfin, la modulation de la signalisation Shh permettrait de bloquer les effets néfastes des glucocorticoïdes sur le développement du cervelet chez les nouveau-nés recevant ce traitement dans le cadre d’une détresse respiratoire ou d’un pontage cardiaque [28]. Dans la sclérose en plaques et plusieurs modèles animaux de la maladie, une diminution ou une augmentation du niveau d’expression de la protéine Shh ont été toutes deux rapportées. Malgré des données parfois contradictoires, il apparaît que Shh pourrait participer à l’amélioration clinique et à l’atténuation de la démyélinisation observées dans des modèles animaux traités par l’interféron β ou la tri-iodothyronine, utilisés pour leur effet sur la maturation oligodendrocytaire [29, 30]. Par ailleurs, des greffes de précurseurs oligodendrocytaires, associées à l’administration de Shh ou d’un agoniste de la voie, améliorent la symptomatologie clinique dans un modèle de contusion de la moelle épinière et augmentent la prolifération d’une population de précurseurs neuraux endogènes (pour revue, voir [2]). La modulation de la signalisation Shh comme nouvelle approche des maladies démyélinisantes mérite une étude plus approfondie. Les données disponibles permettent d’ores et déjà de considérer la signalisation Shh comme un acteur essentiel dans les processus de réparation tissulaire au cours des pathologies cérébrales dégénératives, mais aussi comme la cible de nouvelles approches thérapeutiques des tumeurs cérébrales. Dans ce contexte, le développement d’agonistes et d’antagonistes Hh constitue un enjeu thérapeutique majeur. Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
-
Dessaud
E
,
McMahon
AP
,
Briscoe
J
. Pattern formation in the vertebrate neural tube: a sonic hedgehog morphogen-regulated transcriptional network . Development.
2008; ; 135 : :2489.–2503.
-
Traiffort
E
,
Angot
E
,
Ruat
M
. Sonic Hedgehog signaling in the mammalian brain . J Neurochem.
2010; ; 113 : :576.–590.
-
Goetz
SC
,
Anderson
KV
. The primary cilium: a signaling centre during vertebrate development . Nat Rev Genet.
2010; ; 11 : :331.–344.
-
Simpson
F
,
Kerr
MC
,
Wicking
C
. Trafficking, development and hedgehog . Mech Dev.
2009; ; 126 : :279.–288.
-
Fabre
P
,
Morin
S
,
Charron
F
. Sonic hedgehog et Boc. Une histoire de guidage axonal très attirante . Med Sci (Paris).
2008; ; 24 : :129.–131.
-
Jenkins
D
. Hedgehog signalling: Emerging evidence for non-canonical pathways . Cell Signal.
2009; ; 21 : :1023.–1034.
-
Borjigin
J
,
Deng
J
,
Wang
MM
, et al.
Circadian rhythm of patched1 transcription in the pineal regulated by adrenergic stimulation and cAMP . J Biol Chem.
1999; ; 274 : :35012.–35015.
-
Machold
R
,
Hayashi
S
,
Rutlin
M
, et al.
Sonic hedgehog is required for progenitor cell maintenance in telencephalic stem cell niches . Neuron.
2003; ; 39 : :937.–950.
-
Garcia
AD
,
Petrova
R
,
Eng
L
,
Joyner
AL
. Sonic hedgehog regulates discrete populations of astrocytes in the adult mouse forebrain . J Neurosci.
2010; ; 30 : :13597.–13608.
-
Zhao
C
,
Deng
W
,
Gage
FH
. Mechanisms and functional implications of adult neurogenesis . Cell.
2008; ; 132 : :645.–660.
-
Charytoniuk
D
,
Traiffort
E
,
Hantraye
P
, et al.
Intrastriatal sonic hedgehog injection increases Patched transcript levels in the adult rat subventricular zone . Eur J Neurosci.
2002; ; 16 : :2351.–2357.
-
Ahn
S
,
Joyner
AL
.
In vivo analysis of quiescent adult neural stem cells responding to Sonic hedgehog . Nature.
2005; ; 437 : :894.–897.
-
Angot
E
,
Loulier
K
,
Nguyen-Ba-Charvet
KT
, et al.
Chemoattractive activity of sonic hedgehog in the adult subventricular zone modulates the number of neural precursors reaching the olfactory bulb . Stem Cells.
2008; ; 26 : :2311.–2320.
-
Palma
V
,
Lim
DA
,
Dahmane
N
, et al.
Sonic hedgehog controls stem cell behavior in the postnatal and adult brain . Development.
2005; ; 132 : :335.–344.
-
Lai
K
,
Kaspar
BK
,
Gage
FH
,
Schaffer
DV
. Sonic hedgehog regulates adult neural progenitor proliferation in vitro and in vivo
. Nat Neurosci.
2003; ; 6 : :21.–27.
-
Spassky
N
,
Aguilar
A
. Cil primaire et développement cérébral . Med Sci (Paris).
2008; ; 24 : :790.–791.
-
Fuccillo
M
,
Joyner
AL
,
Fishell
G
. Morphogen to mitogen: the multiple roles of hedgehog signalling in vertebrate neural development . Nat Rev Neurosci.
2006; ; 7 : :772.–783.
-
Loulier
K
,
Ruat
M
,
Traiffort
E
. Increase of proliferating oligodendroglial progenitors in the adult mouse brain upon Sonic hedgehog delivery in the lateral ventricle . J Neurochem.
2006; ; 98 : :530.–542.
-
Amankulor
NM
,
Hambardzumyan
D
,
Pyonteck
SM
, et al.
Sonic hedgehog pathway activation is induced by acute brain injury and regulated by injury-related inflammation . J Neurosci.
2009; ; 29 : :10299.–10308.
-
Bezard
E
,
Baufreton
J
,
Owens
G
, et al.
Sonic hedgehog is a neuromodulator in the adult subthalamic nucleus . Faseb J.
2003; ; 17 : :2337.–2338.
-
Pascual
O
,
Traiffort
E
,
Baker
DP
, et al.
Sonic hedgehog signalling in neurons of adult ventrolateral nucleus tractus solitarius . Eur J Neurosci.
2005; ; 22 : :389.–396.
-
Gulino
A
,
Arcella
A
,
Giangaspero
F
. Pathological and molecular heterogeneity of medulloblastoma . Curr Opin Oncology.
2008; ; 20 : :668.–675.
-
Low
JA
,
de Sauvage
FJ
. Clinical experience with hedgehog pathway inhibitors . J Clin Oncol.
2010; ; 28 : :5321.–5326.
-
Bar
EE
,
Chaudhry
A
,
Lin
A
, et al.
Cyclopamine-mediated hedgehog pathway inhibition depletes stem-like cancer cells in glioblastoma . Stem Cells.
2007; ; 25 : :2524.–2533.
-
Wu
CL
,
Chen
SD
,
Yin
JH
, et al.
Erythropoietin and sonic hedgehog mediate the neuroprotective effects of brain-derived neurotrophic factor against mitochondrial inhibition . Neurobiol Dis.
2010; ; 40 : :146.–154.
-
Banerjee
SB
,
Rajendran
R
,
Dias
BG
, et al.
Recruitment of the Sonic hedgehog signalling cascade in electroconvulsive seizure-mediated regulation of adult rat hippocampal neurogenesis . Eur J Neurosci.
2005; ; 22 : :1570.–1580.
-
Charron
F
,
Tessier-Lavigne
M
. Novel brain wiring functions for classical morphogens: a role as graded positional cues in axon guidance . Development.
2005; ; 132 : :2251.–2262.
-
Heine
VM
,
Rowitch
DH
. Hedgehog signaling has a protective effect in glucocorticoid-induced mouse neonatal brain injury through an 11betaHSD2-dependent mechanism . J Clin Invest.
2009; ; 119 : :267.–277.
-
Harsan
LA
,
Steibel
J
,
Zaremba
A
, et al.
Recovery from chronic demyelination by thyroid hormone therapy: myelinogenesis induction and assessment by diffusion tensor magnetic resonance imaging . J Neurosci.
2008; ; 28 : :14189.–14201.
-
Mastronardi
FG
,
Min
W
,
Wang
H
, et al.
Attenuation of experimental autoimmune encephalomyelitis and nonimmune demyelination by IFN-beta plus vitamin B12: treatment to modify notch-1/sonic hedgehog balance . J Immunol.
2004; ; 172 : :6418.–6426.
|