| |
| Med Sci (Paris). 2011 November; 27(11): 987–992. Published online 2011 November 30. doi: 10.1051/medsci/20112711015.La barrière hémato-encéphalique Une nouvelle cible thérapeutique dans la maladie d’Alzheimer ? Fabien Gosselet,1* Pietra Candela,1 Roméo Cecchelli,1 and Laurence Fenart1 1Université d’Artois, Université Lille-Nord de France, Laboratoire de physiopathologie de la barrière hématoencéphalique, EA 2465-IMPRT 114, Faculté Jean Perrin, rue Jean Souvraz, SP 18, F-62300 Lens, France |
La maladie d’Alzheimer : cascade amyloïde et théorie vasculaire En 2010, en France, près de 900 000 personnes sont atteintes de la maladie d’Alzheimer (MA) et 225 000 nouveaux cas sont diagnostiqués chaque année. Cette pathologie affecte essentiellement les personnes âgées de plus de 65 ans et se traduit par la mort progressive et irréversible des neurones aboutissant à terme au décès du patient. L’espérance de vie se situe entre sept et neuf ans après le diagnostic initial (world Alzheimer report, 20091). Seule une autopsie réalisée post-mortem valide définitivement ce diagnostic en montrant la présence de deux types de lésions cérébrales caractéristiques de cette maladie : (1) les plaques amyloïdes issues de l’accumulation et de l’agrégation cérébrales exacerbées de différentes formes du peptide β amyloïde (Aβ) (majoritairement les formes Aβ1-40 et Aβ1-42) [
31], et (2) les dégénérescences neurofibrillaires provoquées par l’accumulation d’une protéine du cytosquelette neuronal, la protéine tau (tubule associated unit), anormalement (hyper)phosphorylée [
1,
32]. Il existe des relations très étroites entre ces deux lésions et le débat concernant leur rôle respectif dans l’apparition et l’évolution de la maladie d’Alzheimer est loin d’être clos. Cependant, certains arguments de poids plaident en faveur d’un rôle prédominant des peptides Aβ dans la maladie d’Alzheimer : tout d’abord, les formes familiales de la maladie d’Alzheimer, qui représentent environ 1 % des malades, sont exclusivement porteuses de mutations sur les gènes des voies de synthèse des peptides Aβ, ce qui aboutit, à terme, à la formation de plaques amyloïdes qui provoquent le dysfonctionnement et la mort des neurones [1]. Ensuite, ces observations sont corrélées avec divers modèles animaux dans lesquels les peptides Aβ sont produits en excès mimant ainsi la maladie d’Alzheimer et démontrant qu’augmenter la synthèse des peptides Aβ suffit à l’apparition de plaques amyloïdes et au développement de la pathologie. Cette hypothèse, appelée « cascade amyloïde », explique pourquoi la majorité des études se focalise sur la caractérisation du métabolisme de ces peptides. Mais il a été constaté que les cerveaux de patients atteints de la maladie d’Alzheimer ne produisaient pas davantage de peptides Aβ que les cerveaux de patients sains. Cette observation a été confirmée récemment par des études démontrant que les patients atteints de la maladie d’Alzheimer et ceux qui n’en sont pas atteints produisent les mêmes quantités de peptides Aβ et que l’accumulation et l’agrégation des peptides sont la conséquence d’un défaut d’élimination cérébrale de ce peptide [
2]. Le problème semble donc résider dans l’élimination de ces peptides dont le rôle physiologique n’est d’ailleurs toujours pas élucidé. En condition physiologique normale, l’élimination de ces peptides du système nerveux central (SNC) fait intervenir des protéases spécifiques et des mécanismes d’efflux vers le sang à travers la barrière hémato-encéphalique (BHE) [
3]. Les peptides Aβ plasmatiques pénètrent eux aussi dans le SNC en traversant la BHE [
4], suggérant que des altérations de ces échanges pouvaient être à l’origine du processus pathologique. Cette hypothèse - ou « théorie vasculaire » - place la BHE au centre du processus de la maladie. Elle est d’autant plus pertinente que dans la majorité des cas de maladie d’Alzheimer, une accumulation massive de peptides Aβ est observée autour ou à proximité des microvaisseaux, sièges de la BHE [1]. De plus, la grande majorité des facteurs de risque associés à la maladie d’Alzheimer (athérosclérose, diabètes, hyperlipidémie, accidents vasculaires cérébraux, hypertension, etc.) sont également des facteurs de risque de maladies vasculaires [
5]. Dès lors, il est essentiel de mieux comprendre la physiologie et le rôle de cette barrière dans les échanges de peptides Aβ entre le sang et le cerveau afin de pouvoir, à terme, développer de nouvelles approches thérapeutiques. |
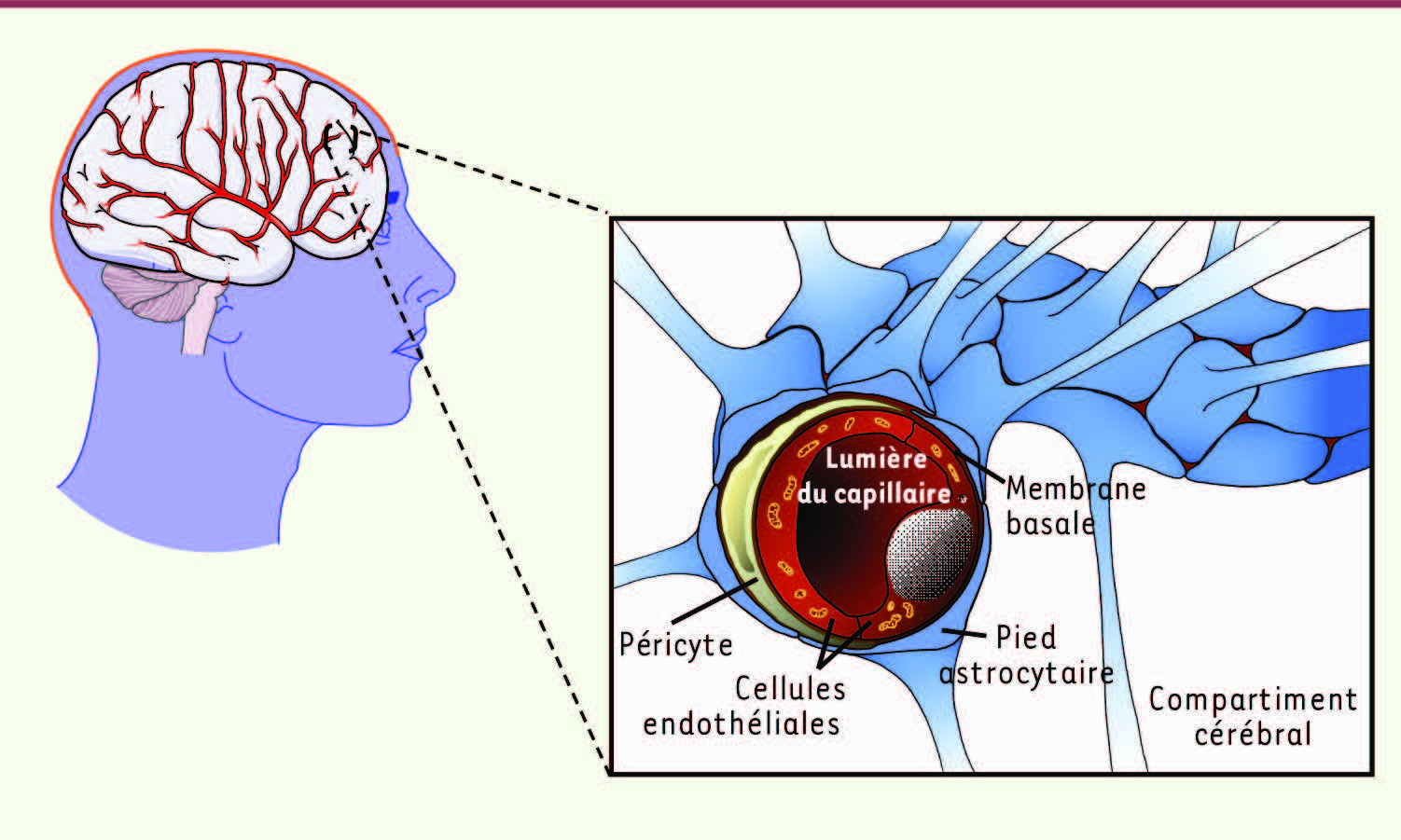
La barrière hémato-encéphalique (BHE) La barrière hémato-encéphalique (BHE) est une barrière physique et métabolique qui isole le cerveau du reste de l’organisme (pour revue, voir [
6]). Elle intervient quotidiennement dans la régulation de l’homéostasie cérébrale. Chez l’adulte, elle est associée aux 650 km de capillaires cérébraux et est plus particulièrement localisée au niveau des cellules endothéliales cérébrales (CEC) qui la composent (
Figure 1
). Elle est composée également de péricytes, cellules musculaires lisses qui sont enchâssés dans la membrane basale, ainsi que de pieds astrocytaires. La BHE est une barrière physique qui contrôle étroitement les échanges entre le sang et le compartiment cérébral, car en plus des jonctions adhérentes, les CEC expriment de nombreuses protéines intervenant dans l’édification de jonctions serrées (
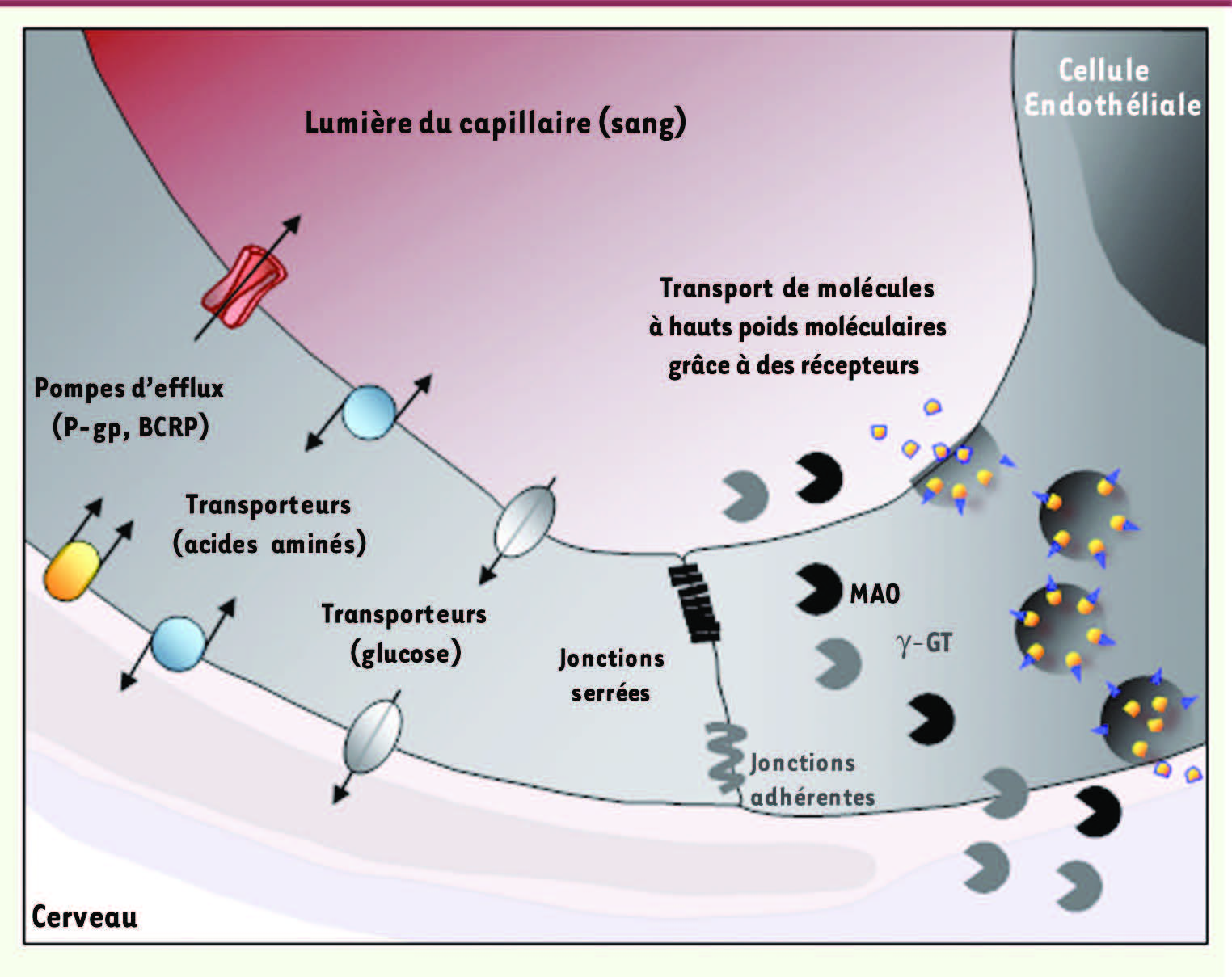
Figure 2
). La régulation des échanges sang-cerveau se fait alors à travers le cytoplasme des CEC qui expriment à leur face abluminale (cerveau) ou luminale (plasmatique) des récepteurs et transporteurs (
Figure 2
). Ce mécanisme de transcytose via des récepteurs reste encore peu étudié et semble faire intervenir dans certains cas les cavéosomes et les cavéoles [
7].
 | Figure 1.
Représentation schématique de la barrière hémato-encéphalique (BHE) localisée au niveau des capillaires cérébraux. Cette barrière est constituée de cellules endothéliales cérébrales (CEC) aux propriétés particulières, de péricytes et de pieds astrocytaires. |
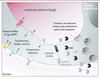 | Figure 2.
La BHE est une barrière physique et métabolique. Les jonctions serrées sont formées de nombreuses protéines transmembranaires qui restreignent considérablement le passage de molécules entre deux CEC. Les jonctions adhérentes, elles, stabilisent les interactions entre les CEC. Ces dernières expriment des transporteurs impliqués spécifiquement dans le transport du glucose ou des acides aminés, par exemple. D’autres transporteurs restreignent l’entrée de molécules dans le parenchyme cérébral, c’est le cas notamment des pompes d’efflux que sont la P-gp et BCRP. Le transport des molécules à hauts poids moléculaires (protéines, lipoprotéines, etc.) au travers de la BHE se fait grâce à des récepteurs spécifiques situés sur les faces luminale et abluminale des CEC. Les mécanismes de transcytose restent encore peu étudiés. Certaines enzymes exprimées et parfois sécrétées par les CEC sont responsables de la dégradation de molécules potentiellement toxiques pour le SNC. C’est le cas de la monoamide oxidase (MAO) ou de la γ-glutamyl transpeptidase (γ-GT). |
La BHE est également une barrière métabolique, car on y trouve l’expression intra et extracellulaire d’enzymes telles que la monoamine oxydase (MAO) ou la γ-glutamyl transpeptidase (γ-GT), capables d’hydrolyser des substrats susceptibles d’être toxiques pour le SNC (
Figure 2
). De plus, des pompes d’efflux utilisant l’énergie issue de l’hydrolyse de l’ATP telles que la P-gp (P-glycoprotéine), les protéines de la famille des MRP (multidrug resistance-associated proteins) ou BCRP (breast cancer resistant protein) sont exprimées par les CEC et empêchent certaines substances d’atteindre le SNC ou facilitent leur élimination cérébrale. |
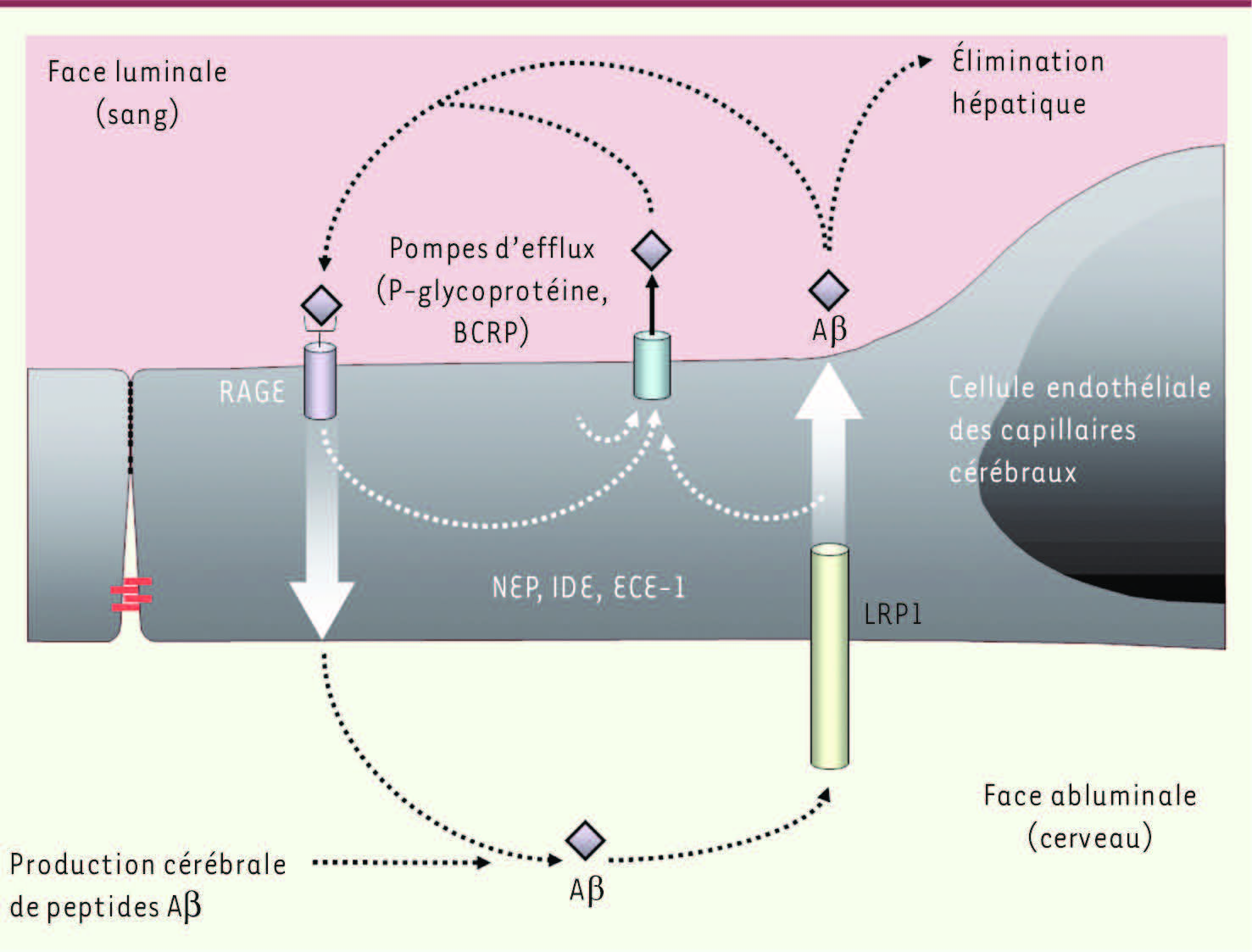
Transport des peptides Aβ à travers la BHE La BHE joue donc un rôle essentiel dans le fonctionnement cérébral, et des études réalisées in vivo ont démontré l’implication de certains récepteurs localisés au niveau de la BHE dans les échanges de peptides Aβ entre le sang et le cerveau (
Figure 3
). C’est, par exemple, le cas des récepteurs LRP1 (low density lipoprotein receptor-related protein-1) [3], et RAGE (receptor for advanced glycation end-products) [4]. Ces deux récepteurs interviendraient respectivement dans l’efflux (du SNC vers le sang) et dans l’influx (du sang vers le SNC) de peptides Aβ à travers la BHE. La mise en évidence, au niveau de microvaisseaux cérébraux de patients atteints de la maladie d’Alzheimer, d’une diminution d’expression de LRP1 et au contraire d’une augmentation de l’expression de RAGE [
8] renforce l’hypothèse de leur implication dans la maladie d’Alzheimer et motive les chercheurs à décrypter les mécanismes de transport endothéliaux de ces peptides.
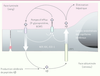 | Figure 3.
La BHE est au centre du métabolisme des peptides Aβ. Le récepteur RAGE est impliqué dans l’influx de ces peptides alors que le récepteur LRP1 est impliqué dans l’efflux cérébral. Les pompes d’efflux telles que la P-gp ou BCRP restreignent l’entrée des peptides Aβ vers le parenchyme cérébral. Le pool cérébral de ces peptides est également contrôlé par la présence d’enzymes capables de les dégrader et synthétisées en partie par les CEC telles que NEP, ECE-1 ou IDE. |
Le récepteur LRP1 et l’endocytose des peptides Aβ LRP1 fait partie de la famille des récepteurs aux lipoprotéines de faible densité (famille LDLR pour low density lipoproteins receptor). In vitro, LRP1 est exprimé au niveau des CEC de rat et semble capable de lier les peptides Aβ afin d’engager leur endocytose [
9]. Cependant le processus de transcytose doit encore être élucidé d’autant plus que cette internalisation a pour conséquence la dégradation de ces peptides et non leur transcytose. L’implication de LRP1 dans ce mécanisme reste d’autant plus discutée que l’inhibition in vivo de ce récepteur avec certains de ses ligands, en l’occurrence RAP ( receptor-associated protein) ou l’α2-macroglobuline, donne des résultats contradictoires chez la souris ou le rat. Alors que l’élimination cérébrale des peptides Aβ est diminuée chez le rat (avec RAP) [
10], aucune variation n’est observée chez la souris (avec l’α2-macroglobuline) [
11], ce qui contraste avec l’étude initiale rapportant cette inhibition chez la souris (mais avec RAP !) [ 3]. Au contraire, une étude récente sur la contribution de LRP1 dans le transport des peptides Aβ, utilisant in vitro des CEC murines, a démontré que ce récepteur était impliqué non seulement dans l’efflux mais aussi dans l’influx de ces peptides [
12], soulignant la difficulté d’étudier les mécanismes de transport au niveau de la BHE. RAGE et l’influx des peptides Aβ RAGE, quant à lui, fait partie de la superfamille des immunoglobulines et reste très peu étudié dans le cadre de la maladie d’Alzheimer. Or, il est de plus en plus admis que les peptides Aβ situés en périphérie peuvent de nouveau traverser la BHE pour rejoindre le compartiment cérébral où ils participeraient à l’évolution de la maladie. En effet, l’injection de doses massives de ces peptides en périphérie permet de reproduire les lésions cérébrales de la maladie d’Alzheimer [
13]. De plus, une baisse des concentrations plasmatiques de peptides Aβ synthétisés par le foie diminue également leur accumulation cérébrale [
14]. Enfin, une augmentation de l’expression de RAGE est observée au niveau des microvaisseaux des patients atteints de la maladie d’Alzheimer [ 8,
15]. Nous avons utilisé un modèle de BHE reproduisant in vitro les caractéristiques majeures de la BHE in vivo [ 6], et avons mis en évidence dans ce modèle la présence exclusive de ce récepteur sur la face luminale (en contact avec le compartiment sanguin) des CEC [
16]. En utilisant un inhibiteur compétitif de RAGE, nous avons démontré qu’il est capable d’intervenir dans l’influx de peptides Aβ sans qu’aucune protéolyse ne soit observée. Le mécanisme de transcytose semble faire intervenir les cavéoles. Aucune implication de ce récepteur dans les mécanismes d’efflux n’a été observée [ 16]. RAGE semble donc exclusivement impliqué dans l’influx des peptides Aβ et un essai clinique utilisant un inhibiteur de ce récepteur est actuellement envisagé [
17]. Rôle des pompes d’efflux dans le transport des peptides Aβ à travers la BHE Les pompes d’efflux exprimées au niveau des CEC de la BHE sont très étudiées du fait de leur rôle dans la restriction de passage de médicaments à visée cérébrale vers le parenchyme cérébral. La P-gp est la mieux caractérisée d’entre elles, mais on sait que les CEC expriment également BCRP et des pompes d’efflux de la famille des MRP [ 6]. Alors que les souris transgéniques p-gp−/−
présentent davantage de dépôts amyloïdes dans le cerveau [
18] et que la protéine semble moins exprimée au niveau de la BHE de patients atteints de maladie d’Alzheimer [
19], l’administration d’inhibiteurs de P-gp à des rats ne modifie pas l’efflux de peptides Aβ en comparaison de rats non traités [ 10]. Là encore, les résultats diffèrent en fonction du modèle, de la méthode et du type cellulaire utilisés, et l’idée dominante à ce jour serait que les pompes d’efflux telles que la P-gp et BCRP empêcheraient l’influx de peptides Aβ périphériques sans intervenir dans l’efflux du pool cérébral de peptides (
Figure 3
). Nos résultats sont en accord avec cette hypothèse, car nous avons récemment démontré dans notre modèle in vitro de BHE que la P-gp et BCRP étaient effectivement capables de restreindre l’entrée des peptides Aβ dans le cerveau [ 16]. Les peptides Aβ ne sont pas les seuls substrats de ces pompes d’efflux, il faut savoir que de nombreuses molécules lipophiles, et notamment celles utilisées dans le traitement de nombreuses pathologies (traitements contre l’hypertension, l’hypercholestérolémie, l’obésité), peuvent aussi être prises en charge par ces pompes. On pourrait donc supposer que chez ces personnes traitées pour ces diverses pathologies, qui sont essentiellement des personnes âgées, les pompes d’efflux localisées au niveau de la BHE seraient en quelque sorte trop occupées à limiter l’entrée de ces molécules dans le SNC. Cela permettrait ainsi, en retour, un transport accru de peptides Aβ dans le compartiment cérébral et favoriserait l’apparition et le développement de la maladie d’Alzheimer. |
Rôle des CEC dans la dégradation des peptides Aβ Le pool cérébral de peptides Aβ est également étroitement contrôlé par une batterie de protéases impliquées dans diverses autres voies métaboliques et généralement exprimées par les neurones et cellules gliales. Les mieux caractérisées de ces enzymes sont IDE (insulin degrading enzyme), la NEP (néprilysine) et ECE-1 (endothelin-converting enzyme 1). Diverses études décrivent l’expression de ces trois enzymes par l’endothélium du système vasculaire cérébral et les CEC en culture. In vivo et in vitro, IDE est exprimée par les cellules endothéliales des microvaisseaux cérébraux chez l’homme [
20], essentiellement sur leur membrane abluminale faisant face au compartiment cérébral [
21]. L’expression de NEP au niveau des microvaisseaux cérébraux des patients atteints de maladie d’Alzheimer est diminuée lorsqu’elle est comparée aux patients non atteints [
22]. D’autres études suggèrent également des mécanismes de dégradations intracellulaires impliquant vraisemblablement les lysosomes des cellules endothéliales [9]. L’ensemble de ces données suggère que les cellules endothéliales joueraient également un rôle dans la dégradation des peptides Aβ cérébraux et que ces mécanismes de dégradation seraient moins efficaces lors de la maladie, contribuant ainsi à l’accumulation cérébrale de ces peptides. |
Les péricytes, une contribution inattendue ? Les études se focalisant sur la BHE concernent bien évidemment les CEC mais très peu de travaux s’orientent vers les péricytes, éléments indispensables à l’établissement et au maintien des propriétés de la BHE in vivo. Ces cellules sont directement au contact du liquide interstitiel cérébral et expriment fortement le récepteur LRP1 [
23] et l’enzyme de dégradation NEP [22]. C’est donc en toute logique que les péricytes interagissent avec les peptides Aβ et interviennent dans leur élimination [
24]. De plus, il a été observé une expression diminuée de NEP au niveau des cellules musculaires du système vasculaire cérébral chez les patients atteints de maladie d’Alzheimer [22]. Au contraire, l’expression de facteurs de transcription essentiels à la différenciation des péricytes tels que SRF (serum response factor) et MYOCD (myocardin) est augmentée chez ces patients, affectant ainsi le phénotype de ces cellules [
25]. Comme LRP1 est un gène cible de ces deux facteurs de transcription, l’hypothèse du rôle des péricytes dans la maladie d’Alzheimer et dans l’élimination des peptides Aβ n’en est que renforcée. |
Perméabilité de la BHE dans la maladie d’Alzheimer Certains travaux ont suggéré que des modifications d’intégrité de cette barrière pouvaient être à l’origine de la maladie d’Alzheimer. Par exemple, une étude récente réalisée chez des patients atteints de la maladie d’Alzheimer démontre qu’environ 25 % d’entre eux présentent des altérations de la perméabilité de la BHE [
26]. Il est cependant probable que cette dysfonction observée chez certains patients soit la conséquence de la maladie et non la cause. En effet, les souris transgéniques produisant un excès de peptides Aβ développent des lésions de la BHE comparées aux souris sauvages [
27], et diverses études réalisées in vitro démontrent l’effet potentiellement néfaste des peptides Aβ sur l’intégrité de la BHE et notamment sur l’expression et la localisation de certaines protéines de jonctions serrées [
28,
29]. Reste à déterminer si ce sont les formes solubles ou insolubles de peptides Aβ qui provoquent cette réponse au niveau des CEC ainsi que les mécanismes cellulaires et moléculaires impliqués, mais une étude récente suggère que c’est par le récepteur RAGE exprimé par les CEC qu’est déclenchée cette réponse de stress endothélial [
30]. Ainsi dans la maladie d’Alzheimer, l’altération de la perméabilité de la BHE n’est pas systématique et serait probablement une conséquence de l’accumulation cérébrale de peptides Aβ et non la cause. Cette accumulation a vraisemblablement pour origine un défaut d’élimination de peptides Aβ, élimination dans laquelle la BHE est étroitement impliquée. |
Selon « l’hypothèse vasculaire » de la maladie d’Alzheimer, certains facteurs favorisant l’apparition et le développement de la maladie tels que le diabète, l’hypertension, les maladies cardiovasculaires ou encore l’hyperlipidémie modifient en fait la physiologie de la BHE. C’est pourquoi in vivo, une augmentation de l’expression de RAGE, une diminution d’expression de LRP1, de la P-pg, de BCRP et des enzymes de dégradation des peptides Aβ sont observées et aboutissent à une accumulation cérébrale de peptides Aβ. Ces derniers s’agrègent alors et forment les plaques amyloïdes caractéristiques de la maladie et influencent en retour la BHE en modifiant son intégrité. À ce jour, les traitements utilisés dans la maladie d’Alzheimer ont essentiellement pour cible les neurones. Or, aucun d’entre eux ne permet de ralentir ou stopper le processus de dépôt des peptides Aβ. Les espoirs thérapeutiques reposent donc sur des essais ciblant les vaisseaux afin de réduire l’influx cérébral de peptides Aβ ou favoriser leur dégradation ou leur élimination cérébrale. Ainsi, la prévention (gymnastique cérébrale et physique, alimentation, hygiène de vie) reste pour le moment le meilleur moyen de ralentir l’apparition et l’évolution de cette maladie. Élucider les mécanismes cellulaires et moléculaires à l’origine de la maladie d’Alzheimer est donc primordial afin de développer des moyens diagnostiques précoces ainsi que des approches thérapeutiques innovantes afin de lutter efficacement un jour contre cette maladie. Conflit d’intérêts
Les auteurs ne déclarent n’avoir aucun conflit d’intérêts contenant les données publiées dans cette revue.
|
Les auteurs remercient tout particulièrement le professeur Vincent Bérézowski pour son aide graphique inestimable. Les travaux de Fabien Gosselet, de Pietra Candela et de Laurence Fenart sont actuellement financés par la Ligue européenne contre la maladie d’Alzheimer (LECMA) et la Fondation cœur et artères.
|
Footnotes |
-
Selkoe
DJ
. Alzheimer’s disease: genes, proteins, and therapy . Physiol Rev.
2001; ; 81 : :741.–766.
-
Mawuenyega
KG
,
Sigurdson
W
,
Ovod
V
, et al.
Decreased clearance of CNS beta-amyloid in Alzheimer’s disease . Science.
2010; ; 330 : :1774..
-
Shibata
M
,
Yamada
S
,
Kumar
SR
, et al.
Clearance of Alzheimer’s amyloid-ss(1–40) peptide from brain by LDL receptor-related protein-1 at the blood-brain barrier . J Clin Invest.
2000; ; 106 : :1489.–1499.
-
Deane
R
,
Du Yan
S
,
Submamaryan
RK
, et al.
RAGE mediates amyloid-beta peptide transport across the blood-brain barrier and accumulation in brain . Nat Med.
2003; ; 9 : :907.–913.
-
Helmer
C
,
Pasquier
F
.
Dartigues
JF
. Épidémiologie de la maladie d’Alzheimer et des syndromes apparentés.
Med Sci (Paris).
2006; ; 22 : :288.–296.
-
Cecchelli
R
,
Berezowski
V
,
Lundquist
S
, et al.
Modelling of the blood-brain barrier in drug discovery and development . Nat Rev Drug Discov.
2007; ; 6 : :650.–661.
-
Candela
P
,
Gosselet
F
,
Miller
F
, et al.
Physiological pathway for low-density lipoproteins across the blood-brain barrier: transcytosis through brain capillary endothelial cells in vitro
. Endothelium.
2008; ; 15 : :254.–264.
-
Donahue
JE
,
Flaherty
SL
,
Johanson
CE
, et al.
RAGE, LRP-1, and amyloid-beta protein in Alzheimer’s disease . Acta Neuropathol.
2006; ; 112 : :405.–415.
-
Yamada
K
,
Hashimoto
T
,
Yabuki
C
, et al.
The low density lipoprotein receptor-related protein 1 mediates uptake of amyloid beta peptides in an in vitro model of the blood-brain barrier cells . J Biol Chem.
2008; ; 283 : :34554.–34562.
-
Ito
S
,
Ohtsuki
S
,
Terasaki
T
. Functional characterization of the brain-to-blood efflux clearance of human amyloid-beta peptide (1–40) across the rat blood-brain barrier . Neurosci Res.
2006; ; 56 : :246.–252.
-
Ito
S
,
Ueno
T
,
Ohtsuki
S
, et al.
Lack of brain-to-blood efflux transport activity of low-density lipoprotein receptor-related protein-1 (LRP-1) for amyloid-beta peptide(1–40) in mouse: involvement of an LRP-1-independent pathway . J Neurochem.
2010; ; 113 : :1356.–1363.
-
Pflanzner
T
,
Janko
MC
,
Andre-Dohmen
B
, et al.
LRP1 mediates bidirectional transcytosis of amyloid-beta across the blood-brain barrier . Neurobiol Aging.
2010; ; 12
(juillet). DOI: 10.16/j.neurobiolaging.2010.05.025
..
-
Eisele
YS
,
Obermuller
U
,
Heilbronner
G
, et al.
Peripherally applied Abeta-containing inoculates induce cerebral beta-amyloidosis . Science.
2010; ; 330 : :980.–982.
-
Sutcliffe
JG
,
Hedlund
PB
,
Thomas
EA
, et al.
Peripheral reduction of beta-amyloid is sufficient to reduce brain beta-amyloid: implications for Alzheimer’s disease . J Neurosci Res.
2011; ; 89 : :808.–814.
-
Jeynes
B
,
Provias
J
. Evidence for altered LRP/RAGE expression in Alzheimer lesion pathogenesis . Curr Alzheimer Res.
2008; ; 5 : :432.–437.
-
Candela
P
,
Gosselet
F
,
Saint-Pol
J
, et al.
Apical-to-basolateral transport of amyloid-beta peptides through blood-brain barrier cells is mediated by the receptor for advanced glycation end-products and is restricted by P-glycoprotein . J Alzheimers Dis.
2010; ; 22 : :849.–859.
-
Sabbagh
MN
,
Agro
A
,
Bell
J
, et al.
PF-04494700, an oral inhibitor of receptor for advanced glycation end products (RAGE), in Alzheimer disease . Alzheimer Dis Assoc Disord.
2011; ; 25 : :206.–212.
-
Cirrito
JR
,
Deane
R
,
Fagan
AM
, et al.
P-glycoprotein deficiency at the blood-brain barrier increases amyloid-beta deposition in an Alzheimer disease mouse model . J Clin Invest.
2005; ; 115 : :3285.–3290.
-
Vogelgesang
S
,
Warzok
RW
,
Cascorbi
I
, et al.
The role of P-glycoprotein in cerebral amyloid angiopathy : implications for the early pathogenesis of Alzheimer’s disease . Curr Alzheimer Res.
2004; ; 1 : :121.–125.
-
Gao
W
,
Eisenhauer
PB
,
Conn
K
, et al.
Insulin degrading enzyme is expressed in the human cerebrovascular endothelium and in cultured human cerebrovascular endothelial cells . Neurosci Lett.
2004; ; 371 : :6.–11.
-
Lynch
JA
,
George
AM
,
Eisenhauer
PB
, et al.
Insulin degrading enzyme is localized predominantly at the cell surface of polarized and unpolarized human cerebrovascular endothelial cell cultures . J Neurosci Res.
2006; ; 83 : :1262.–1270.
-
Carpentier
M
,
Robitaille
Y
,
DesGroseillers
L
, et al.
Declining expression of neprilysin in Alzheimer disease vasculature: possible involvement in cerebral amyloid angiopathy . J Neuropathol Exp Neurol.
2002; ; 61 : :849.–856.
-
Gosselet
F
,
Candela
P
,
Sevin
E
, et al.
Transcriptional profiles of receptors and transporters involved in brain cholesterol homeostasis at the blood-brain barrier: use of an in vitro model . Brain Res.
2009; ; 1249 : :34.–42.
-
Urmoneit
B
,
Prikulis
I
,
Wihl
G
, et al.
Cerebrovascular smooth muscle cells internalize Alzheimer amyloid beta protein via a lipoprotein pathway: implications for cerebral amyloid angiopathy . Lab Invest.
1997; ; 77 : :157.–166.
-
Bell
RD
,
Deane
R
,
Chow
N
, et al.
SRF and myocardin regulate LRP-mediated amyloid-beta clearance in brain vascular cells . Nat Cell Biol.
2009; ; 11 : :143.–153.
-
Bowman
GL
,
Kaye
JA
,
Moore
M
, et al.
Blood-brain barrier impairment in Alzheimer disease: stability and functional significance . Neurology.
2007; ; 68 : :1809.–1814.
-
Ujiie
M
,
Dickstein
DL
,
Carlow
DA
, et al.
Blood-brain barrier permeability precedes senile plaque formation in an Alzheimer disease model . Microcirculation.
2003; ; 10 : :463.–470.
-
Tai
LM
,
Holloway
KA
,
Male
DK
, et al.
Amyloid-beta-induced occludin down-regulation and increased permeability in human brain endothelial cells is mediated by MAPK activation . J Cell Mol Med.
2010; ; 14 : :1101.–1112.
-
Marco
S
,
Skaper
SD
. Amyloid beta-peptide1–42 alters tight junction protein distribution and expression in brain microvessel endothelial cells . Neurosci Lett.
2006; ; 401 : :219.–224.
-
Carrano
A
,
Hoozemans
JJ
,
van der Vies
SM
, et al.
Amyloid beta Induces oxidative stress-mediated blood-brain barrier changes in capillary amyloid angiopathy . Antioxid Redox Signal.
2011; ; 15 : :1167.–1178.
-
Hémar
A
,
Mulle
C
. Maladie d’Alzheimer, peptide β-amyloïde et synapses . Med Sci (Paris).
2011; ; 27 : :733.–736.
-
Clavaguera
F
,
Goedert
M
,
Tolnay
M
. Induction et propagation de la pathologie par la protéine tau chez un modèle murin de la maladie d’Alzheimer . Med Sci (Paris).
2010; ; 26 : :121.–124.
|