| |
| Med Sci (Paris). 2011 November; 27(11): 1028–1034. Published online 2011 November 30. doi: 10.1051/medsci/20112711022.À propos de Ralph M. Steinman et des cellules dendritiques Prix Nobel de Médecine 2011 : Ralph M. Steinman, Jules A. Hoffman et Bruce A. Beutler Laurence Zitvogel,1* Sebastian Amigorena,2** and Jean-Luc Teillaud3*** 1Inserm UMR 1015, Institut Gustave Roussy, 114, rue Edouard Vaillant, 94805Villejuif, France 2Inserm U932, Institut Curie, 26, rue d’Ulm, 75248Paris Cedex 05, France 3Inserm U872, Centre de recherche des Cordeliers, Université Pierre et Marie Curie-Paris 6, UMRS 872, Université Paris Descartes, 15, rue de l’École de Médecine, 75270Paris Cedex 06, France |
Une molécule est « immunogène » lorsqu’elle induit une réponse immunitaire cellulaire effectrice et/ou mémoire dirigée contre elle. Cela requiert qu’une cellule « accessoire » apprête cette molécule, conduisant alors à une réponse immune cellulaire et/ou humorale. Cible d’anticorps ou de lymphocytes T, elle est alors appelée « antigène ». Découverte en 1973 par Ralph Steinman et Zanvil Cohn [
1], cette cellule accessoire – arborisée en prolongements mobiles – fut nommée « dendritique » (nom dérivé du grec dendreon) (Figure 1). Elle fut rapidement reconnue comme une cellule stimulatrice puissante des réactions lymphocytaires mixtes traduisant une incompatibilité du système HLA in vitro [
2] et comme une cellule jouant un rôle central dans les mécanismes de rejets de greffons rénaux chez le rat (1982). Cette découverte fondamentale de l’immunologie cellulaire a permis de comprendre le lien existant entre immunité innée (ou immédiate, ne nécessitant pas la génération et la sélection de récepteurs spécifiques de l’antigène et dépourvue de mécanismes de « mise en mémoire » de l’antigène) et immunité adaptative (celle-ci mettant en jeu les lymphocytes B et T pourvus de récepteurs spécifiques de l’antigène et capables de se transformer en cellules mémoires). Partant de cette découverte, l’intelligence visionnaire de Ralph Steinman et son énergie fédérative dans de nombreux domaines de la biologie cellulaire, moléculaire et de l’immunologie clinique ont permis à son équipe et à ses nombreux collègues à travers le monde de générer les conditions de culture et de différenciation des cellules dendritiques in vitro, prérequis pour décrypter leurs diverses sous-populations douées de fonctions régulatrices différentes, identifier les facteurs contrôlant leur maturation et dictant leur fonction immunogène (rejoignant ainsi la découverte des TLR [toll like receptors] par J. Hoffmann et B. Beutler) et, finalement, vacciner des individus atteints de cancers ou infectés par le VIH (virus de l’immunodéficience humaine). C’est ainsi que la génération d’anticorps monoclonaux spécifiques de cellule dendritique, notamment par son équipe [
3], et les expériences génétiques de ciblage de certains facteurs de transcription ont permis de démontrer le rôle majeur des CD au carrefour de l’immunité innée et de l’immunité adaptative.
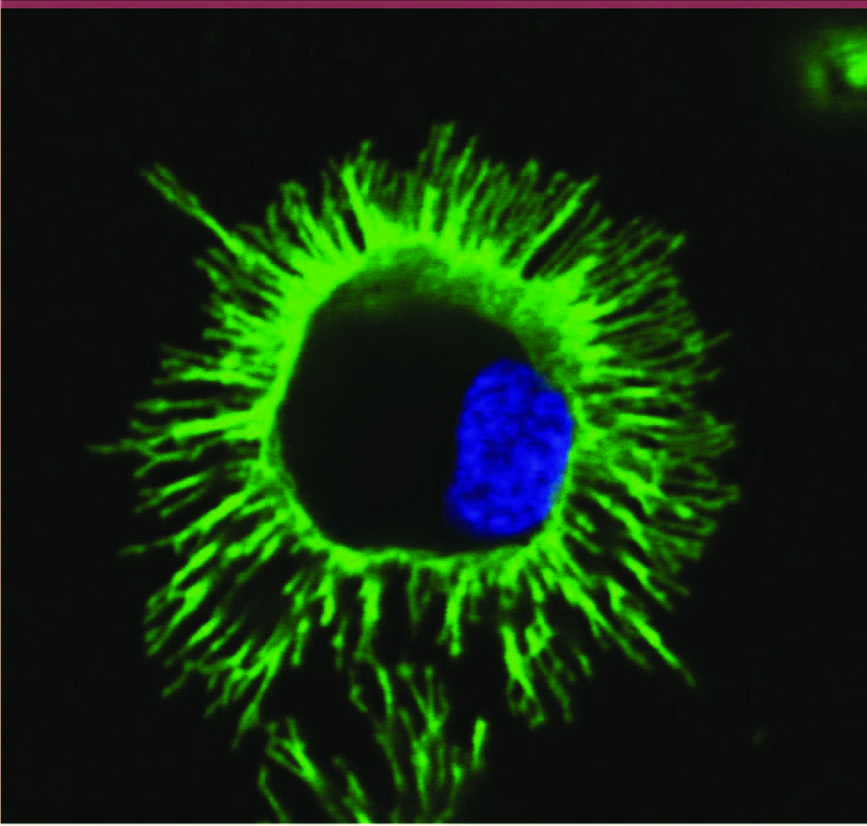
 | Figure 1
Phénotype d’une cellule dendritique. Photographie d’une cellule dendritique humaine mature dérivée de monocytes et marquée par un anticorps anti-CMH de classe II couplé à une fluorochrome. Observation en microscopie confocale (© Photo S. Viaud, U1015 Inserm). |
|
La découverte de la cellule dendritique et de ses propriétés fonctionnelles Dans les années 1960, une question fondamentale pour les immunologistes fut de comprendre comment une molécule pouvait être l’inductrice (l’immunogène) et la cible (l’antigène) d’une réponse immunitaire spécifique dirigée contre elle. En cherchant à disséquer les mécanismes de la réponse humorale dirigée contre les globules rouges de mouton dans les rates de souris, R. Steinman et Z. Cohn ont identifié morphologiquement une cellule rare, stellée, radiorésistante, sans laquelle la réponse immunitaire contre ces globules rouges ne pouvait avoir lieu. Malgré la caractérisation détaillée des molécules du complexe majeur d’histocompatibilité (CMH) de classe II au milieu des années 1970 et la preuve expérimentale que les antigènes protéiques devaient être apprêtés (découpés par des enzymes) en peptides pour être « présentés » aux lymphocytes T en association avec ces molécules du CMH (revue dans [
4]), il fallut attendre les années 1980 pour que le rôle essentiel joué par les cellules dendritiques dans cette présentation de l’antigène aux lymphocytes T soit mis en évidence. Peter C. Doherty et Rolf Zinkernagel ont reçu le Prix Nobel de physiologie ou médecine en 1996 pour cette découverte (→) [
49].
(→) Voir m/s n° 11, novembre 1996, page 1316
Les preuves expérimentales de l’activité présentatrice d’antigènes des cellules dendritiques in vivo furent apportées grâce à l’utilisation des modèles de transplantation rénale et pancréatique : la déplétion de ces cellules dendritiques par un anticorps produit dans le laboratoire de R. Steinman [
5] réduisait ou prévenait le rejet du greffon [
6,
7]. Ce rôle central joué par la cellule dendritique dans les mécanismes de rejet était la traduction in vivo de ce que Ralph Steinman avait parallèlement démontré in vitro : la mise en évidence de l’extraordinaire capacité de ces cellules à induire une réponse proliférative des lymphocytes T allogéniques (provenant d’un autre individu différant par ses molécules du CMH) in vitro [2] et de son rôle central dans ce phénomène [
8]. Il fallut ensuite quinze ans de recherches assidues dans le domaine pour que la cellule dendritique soit utilisée en routine dans les tests de prolifération in vitro (test de réaction lymphocytaire mixte ou MLR). Au cours de la même période, le laboratoire de Ralph Steinman démontra que la cellule dendritique (et non pas une autre cellule présentatrice comme le lymphocyte B ou le macrophage) était essentielle au développement d’une réponse immunitaire T CD8+ cytotoxique contre un haptène [
9]. En 1985, en collaboration avec K. Inaba à Kyoto au Japon, R. Steinman et son équipe mirent en évidence le rôle central que joue la cellule dendritique dans l’activation des lymphocytes T CD4+ auxiliaires et l’élaboration de réponses anticorps spécifiques d’un antigène protéique [
10]. Ainsi, en un peu moins d’une décennie, Ralph Steinman démontra le rôle central joué par la cellule dendritique qu’il avait décrite avec Zanvil Cohn au début des années 1970, tant en ce qui concerne les réponses lymphocytaires T, auxiliaires ou cytotoxiques, que les réponses lymphocytaires B, à l’origine de la production d’anticorps spécifiques. D’autres laboratoires ont ensuite décrit l’existence de cellules dendritiques dotées de propriétés accessoires très différentes des macrophages dans divers tissus et espèces, conduisant à considérer la cellule dendritique comme une cellule probablement issue d’une lignée médullaire spécifique [4]. |
La présentation antigénique par la cellule dendritique Les mécanismes moléculaires permettant à la cellule dendritique de jouer un rôle central dans l’initiation et le déclenchement d’une réponse immunitaire adaptative (impliquant lymphocytes T et lymphocytes B) ne furent cependant décryptés par Ralph Steinman et son équipe qu’en 1990 dans deux articles publiés dans le Journal of Experimental Medicine [
11,
12]. L’équipe montra d’abord que les cellules dendritiques de la rate présentent la protéine injectée à une souris sous forme de fragments immunogènes, permettant le recrutement de lymphocytes T spécifiques [11]. Dans un second temps, elle montra que les cellules dendritiques peuvent être « chargées » par un antigène protéique
ex vivo
, réinjectées à un animal « naïf », ce qui déclenche
in vivo
une réponse primaire conduisant à l’apparition de lymphocytes T spécifiques [12]. Ainsi, cette dernière expérience représente-t-elle la première démonstration qu’il est possible de développer une nouvelle stratégie de vaccination, sans addition d’aluminium ou d’adjuvant complet de Freund, concrétisant ainsi le concept « CD as nature’s adjuvants in vivo
» [12]. La maturation des cellules dendritiques Les travaux de Ralph Steinman permirent l’émergence de toute une série d’études portant tant sur la biologie des cellules dendritiques que sur leurs nombreux rôles dans les mécanismes de l’immunité innée et adaptative (Figure 2). Les travaux de G. Schuler and N. Romani contribuèrent ainsi à démontrer ce processus majeur qu’est la maturation des cellules dendritiques. Cette maturation est en effet indispensable à leurs fonctions stimulatrices vis-à-vis des lymphocytes T. Ces auteurs montrèrent notamment que les cellules épidermiques de Langerhans, des cellules très proches des cellules dendritiques précédemment décrites, connues pour exposer les molécules du CMH de classe II à leur surface, ne fonctionnent comme cellules présentatrices d’antigènes qu’après activation par un facteur hématopoïétique, le GM-CSF ( granulocyte macrophage colony-stimulating factor) [ 4]. Les travaux ultérieurs de l’équipe de Ralph Steinman et des très nombreuses autres équipes ayant rejoint ce champ d’études ont montré que la maturation des cellules dendritiques s’accompagnait d’une expression accrue des molécules de costimulation (membres de la famille B7, du TNF [ tumor necrosis factor], Notch). Ces molécules délivrent un second signal aux lymphocytes T, en plus de celui engendré par l’interaction du récepteur T de l’antigène - TcR - avec les peptides présentés par la cellule dendritique en association avec les molécules du CMH de classe II, et permettent leur activation ainsi que la production de cytokines (IL-12, IFN type 1, IL-15) et de chimiokines polarisant et dictant l’efficacité de la réponse lymphocytaire T adaptative (revue dans [
13]).
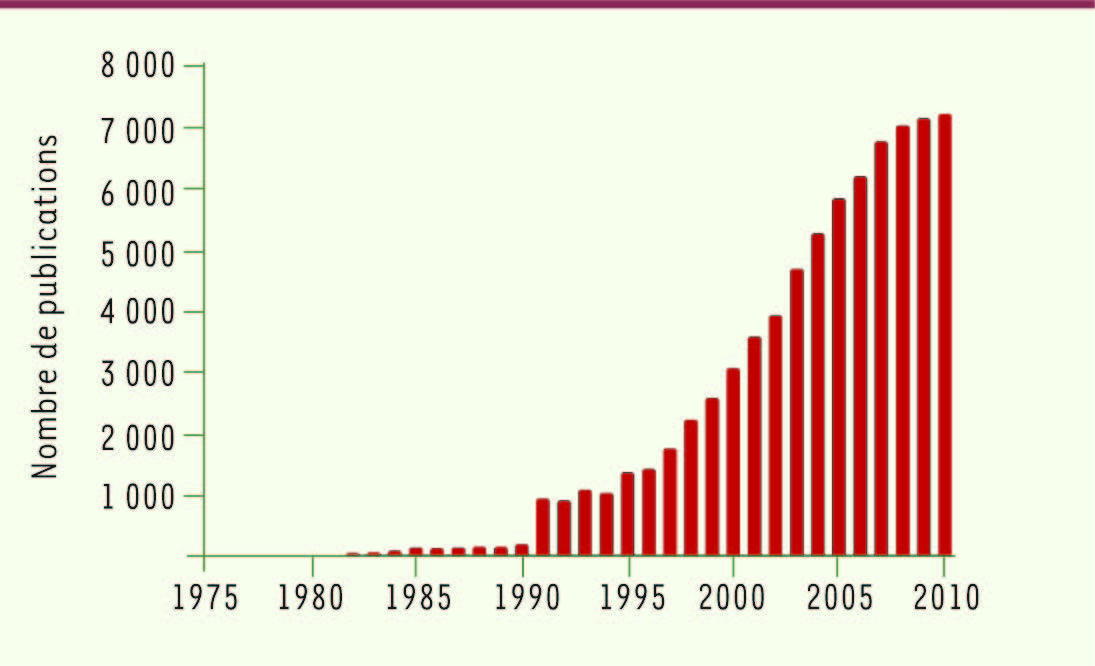
 | Figure 2
Évolution du nombre de publications concernant les cellules dendritiques (Source : PubMed). |
L’étude de la régulation de la maturation des cellules dendritiques a également déclenché une cascade de découvertes majeures concernant les récepteurs dits de danger [
14,
15], le fonctionnement des toll-like receptors (TLR) (→) et celui des récepteurs NOD ou des récepteurs lectin-like. Il est alors apparu que les signaux passant par ces différents récepteurs agissaient, seuls ou de concert, pour optimiser l’apprêtement et la présentation antigéniques par les cellules dendritiques.
(→) Voir l’article de Jean-Luc Imler et Dominique Ferrandon, page 1019 de ce numéro
Présentation de l’antigène par les cellules dendritiques aux lymphocytes T CD8+ : le concept de présentation croisée des antigènes exogènes La mise en évidence du rôle central joué par les cellules dendritiques dans l’induction d’une immunité adaptative, grâce à leur extraordinaire capacité à présenter l’antigène, c’est-à-dire présenter des fragments d’antigènes (principalement protéiques) en association avec des molécules de classe II aux lymphocytes T CD4 + dits auxiliaires, a conduit les immunologistes à examiner les capacités de présentation des cellules dendritiques à l’autre grande catégorie de lymphocytes T, les lymphocytes T CD8 + dits cytotoxiques. Les travaux de l’équipe de Ralph Steinman furent une fois encore décisifs dans la démonstration, en 1987, d’une activation directe des lymphocytes T CD8 + cytotoxiques par les cellules dendritiques [
16]. Ce travail pionnier conduisit à la notion de présentation dite « croisée » des antigènes exogènes, en association avec les molécules du CMH de classe I pour l’activation des lymphocytes T CD8 + naïfs. Cette capacité unique des cellules dendritiques est importante dans les situations où la présentation directe de l’antigène par la cible infectée ou transformée est altérée (détournée par certains virus ou tumeurs) comme l’ont montré I. Mellman et S. Amigorena [
17]. Ces derniers, étudiant les compartiments enrichis en molécules du CMH de classe II, caractérisèrent également les différences entre cellules dendritiques et macrophages pour l’apprêtement de l’antigène, et révélèrent la dynamique de l’endocytose, micropinocytose et phagocytose dans les cellules dendritiques immatures comme matures. Leurs travaux ont d’ailleurs permis de montrer que la maturation des cellules dendritiques régule l’appareil d’apprêtement, en abaissant le pH des vacuoles endocytiques, en activant la protéolyse et en transportant les complexes CMH classe II/peptides à la membrane plasmique. L’analyse de la fonction des cellules dendritiques in vivo a été grandement facilitée au cours de ces quinze dernières années par les efforts de nombreux investigateurs qui ont généré des animaux déficients en certains facteurs de transcription jouant un rôle essentiel dans les cellules dendritiques (Batf3, IRF8, Ikaros, Flt3L, Siglec H) ou chez lesquels les cellules dendritiques ont été éliminées. Cela a pu se réaliser notamment en mettant le gène de la toxine diphtérique sous le contrôle du promoteur de la molécule CD11c ou de la langérine (ces deux molécules étant exprimées spécifiquement dans les cellules dendritiques, cela réalise une ablation conditionnelle) ou encore en provoquant la libération du cytochrome c dans le cytosol des cellules dendritiques, ce qui les tue, ou à l’aide d’anticorps neutralisants (anti-PDCA) [
18]. Le rôle majeur des cellules dendritiques dans la présentation croisée des antigènes exogènes pour l’activation des lymphocytes T CD8+ a pu ainsi été démontré [
19]. Les cellules dendritiques sont également capables d’interagir directement avec des cellules autres que les lymphocytes T. En 1999 et 2001, l’équipe de L. Zitvogel montra que les cellules dendritiques matures sont aussi de très puissantes cellules activatrices de lymphocytes NK (natural killer) et NKT [
20,
21]. En 2002, une équipe italienne, en collaboration avec Ralph Steinman, montra que les cellules dendritiques humaines activent les cellules NK au repos et sont reconnues par des cellules NK par l’intermédiaire de la molécule NKp30 exprimées par ces dernières cellules [
22]. D’autres montreront, par la suite, leurs capacités d’interaction directe avec des neutrophiles, des cellules épithéliales et d’autres cellules intervenant à une étape précoce de l’inflammation, conférant ainsi à la cellule dendritique le rôle de chef d’orchestre des réactions immunitaires innées puis acquises (Figure 3).
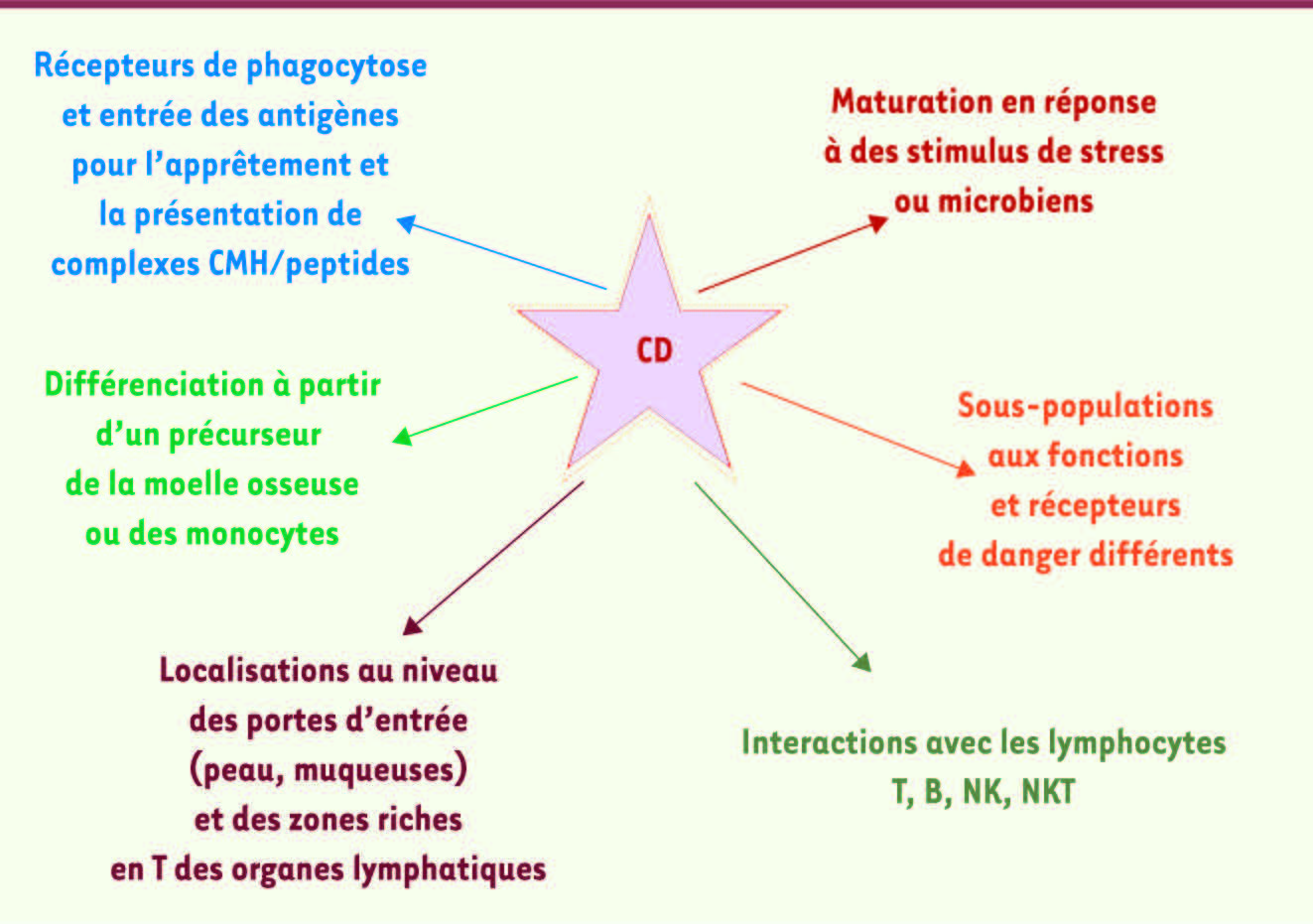
 | Figure 3
Cellules dendritiques : cellules pivots du système immunitaire.
|
|
Le monde complexe des cellules dendritiques : facteurs de différenciation et sous-populations Afin de mieux comprendre les différentes fonctions des cellules dendritiques in vitro et in vivo, et avant d’envisager utiliser ces cellules à des fins thérapeutiques chez l’homme, il devint rapidement nécessaire de maîtriser leur production
ex vivo
s’agissant notamment de cellules humaines. F. Sallusto et A. Lanzavecchia, ainsi que l’équipe de J. Banchereau, proposèrent les premières méthodes de culture permettant d’obtenir des cellules dendritiques à partir de monocytes (en présence de GM-CSF et d’IL[interleukine]-4) ou de précurseurs hématopoïétiques CD34+ (en présence de l’association SCF [stem cell factor], GM-CSF et TNFα) (revue dans [13]). Ces cellules dendritiques humaines ont permis de confirmer les données - obtenues chez la souris - de présentation antigénique ex vivo. J. Banchereau et son équipe ont démontré qu’il était possible, en fonction des conditions de culture, d’orienter les cellules dendritiques dermiques ou épidermiques de façon à ce qu’elles dirigent des réponses humorales ou cellulaires respectivement. C’est autour de ces questions que s’est constituée une communauté « cellules dendritiques » (comme en témoigne la création du club francophone des cellules dendritiques) dont un des rôles a été de convaincre les autorités réglementaires de différents pays que ces cellules pourraient être utilisées pour vacciner des patients. Le développement de ces méthodes de culture a bientôt révélé toute la complexité du paysage des cellules dendritiques. C’est ainsi que Yong Jun Liu a distingué les cellules dendritiques plasmacytoïdes et les cellules dendritiques du centre germinatif, dotées de propriétés uniques : sécrétion d’IFN (interféron) de type 1 pour les premières, engagement des réponses T CD4+ auxiliaires de la maturation des lymphocytes B mémoires pour la seconde [13]. L’étude approfondie des sous-populations de cellules dendritiques a été stimulée par les polémiques nées autour de l’identification de précurseurs spécifiques de ces différentes catégories et autour de leurs fonctions, dépendantes ou non des signaux de l’environnement [
23]. Un consensus s’est établi, qui réconcilie différentes hypothèses, et reconnaît qu’il existe plusieurs sous-types de cellules dendritiques, définis par différents marqueurs et fonctions. À un stade immature, les cellules dendritiques plasmacytoïdes (CDp) sont impliquées, tout comme les cellules de Langerhans, dans la tolérance immune périphérique. Elles circulent dans le sang et pénètrent dans les ganglions lymphatiques par des veinules appelées high endothelial venules parce que bordées de cellules endothéliales cubiques hautes, et non pavimenteuses comme dans les autres vaisseaux. À un stade mature, ces CDp expriment sélectivement les TLR7 et TLR9, ainsi que des récepteurs pour la région Fc des immunoglobulines G (IgG, RFcγ activateurs) et s’accumulent dans les zones inflammatoires. Lorsque des complexes immuns contenant de l’ADN ou de l’ARN se lient aux CDp, ils sont ingérés et entraînent une production forte et immédiate d’IFN de type 1. Ces CDp peuvent aussi présenter des antigènes viraux (ingérés à partir de cellules apoptotiques) aux lymphocytes T CD8+ [
24]. Les autres cellules dendritiques, appelées « myéloïdes », sont aussi subdivisées en plusieurs catégories et ne migrent pas, une fois matures, aux mêmes endroits dans le ganglion lymphatique. Dans la peau, les cellules dendritiques épidermiques (CD207/langérine+, CD205/DEC-205+) stimulent les lymphocytes T cytotoxiques, alors que les cellules dendritiques dermiques (DC-SIGN/CD209+, mannose receptor/CD206+) activent les lymphocytes B producteurs d’anticorps [13]. L’équipe de K. Shortman a décrit de façon détaillée les sous-populations de cellules dendritiques spléniques murines. Les cellules dendritiques exprimant la molécule DEC205 sont très efficaces pour la présentation antigénique croisée (présentation de peptides dérivés d’antigènes exogènes en association avec les molécules de CMH de classe I) (voir plus haut) et l’activation/polarisation des lymphocytes T auxiliaires vers la production d’IFNγ. Une seconde sous-population, qui exprime DCIR2/CLEC4A4 et d’autres lectines, est spécialisée dans l’apprêtement des antigènes conduisant à la présentation de peptides en association avec des molécules du CMH de classe II. Dans les ganglions drainant la peau et les muqueuses, il existe une population de cellules dendritiques CD103/ITGAE+ (codécouverte par M. Merad, B. Malissen et K. Shortman [
25]) spécialisée dans la présentation croisée des antigènes et synthétisant l’acide rétinoïque pour l’éducation des lymphocytes T régulateurs Foxp3+. Ces sous-populations de cellules dendritiques sont coordonnées dans leur rôle physiopathologique et coopèrent pour orchestrer les réponses immunes innées et adaptatives. La génération de ces cellules dendritiques est contrôlée à l’état basal par la molécule Flt3L, alors que, pendant une infection ou lors d’une réponse inflammatoire, le GM-CSF mobilise des cellules dendritiques d’origine monocytaire [
26]. À l’état basal, les cellules dendritiques des organes lymphoïdes sont issues d’un précurseur ostéomédullaire unique et non des monocytes, alors que, en cas d’inflammation, ces monocytes peuvent engendrer des cellules dendritiques tissulaires. Cependant, Varol et Jung ont aussi montré que des monocytes pouvaient générer les cellules dendritiques conventionnelles des muqueuses (de la lamina propria et des poumons) à l’état basal [
27], mais pas celles des ganglions. La notion qui prévaut actuellement est que les sous-populations de cellules dendritiques orchestrent à l’état basal une tolérance périphérique orientée vers les T cytotoxiques (Tc) ou les T auxiliaires (Th) ou les T régulateurs (Treg) au sein des ganglions. À la faveur d’un stress (inflammation, infection, transplantation, tumeur, etc.), toutes ces sous-populations se mobilisent directement ou indirectement à partir des monocytes, engageant une maturation qui va activer l’appareil d’apprêtement et de présentation antigénique et/ou distinguer les antigènes du soi et du non-soi au sein des compartiments endocytiques. |
Cellules dendritiques et tolérance immunitaire Les travaux de Ralph Steinman ont également permis d’éclaircir certaines frontières distinguant l’immunogénicité de la tolérance. Dans certaines conditions, le rôle princeps des cellules dendritiques est le maintien de la tolérance périphérique. À l’état basal, en l’absence de signaux inflammatoires, ces cellules capturent les antigènes du soi et ceux du microenvironnement et induisent une tolérance dont le maintien dépendrait de l’expression de PDL-1, de FAS ou du TGFβ à leur surface [4, 13]. La preuve expérimentale formelle du rôle tolérogène des cellules dendritiques est notamment venue des travaux de Ralph Steinman montrant que leur ciblage in vivo par l’anticorps anti-DEC205 couplé à un antigène conduit à l’endocytose et à l’apprêtement de cet antigène, suivis d’une tolérance périphérique des lymphocytes T CD8+ vis-à-vis de cet antigène [
28,
29]; celle-ci peut aussi résulter de l’injection de cellules mourantes in vivo [
30]. Dans ces situations « sans adjuvant », les cellules dendritiques enclenchent une réponse immunitaire aboutissant à la délétion des lymphocytes spécifiques d’antigènes. En revanche, en présence d’un agent de maturation (anti-CD40 agoniste ou ligand de TLR3), de fortes réponses Th1 spécifiques d’antigènes sont générées. De plus, les capacités de contrôle des réponses immunes par les cellules dendritiques ont été soulignées par l’analyse de leurs effets sur le compartiment T régulateur. R. Steinman et d’autres chercheurs ont montré que les cellules dendritiques aident à la différenciation des lymphocytes T régulateurs Foxp3+ (Treg) dans le thymus [
31] et à la périphérie [
32] et les amplifient une fois formés [
33]. Ghiringhelli et ses collègues ont d’ailleurs ensuite montré la pertinence de ces observations dans les cancers en démontrant que les cellules dendritiques permettent l’expansion de ces lymphocytes Treg par l’intermédiaire de l’expression de TGFβ membranaire [
34]. |
Cellules dendritiques, pathologies, et essais cliniques Élaboration des réponses immunes dans des situations pathologiques Le rôle crucial joué par les cellules dendritiques dans l’élaboration des réponses immunitaires a été également souligné lors des études de situations pathologiques chez l’homme et par l’utilisation thérapeutique de molécules ayant un effet direct ou indirect sur ces cellules. L’implication des cellules dendritiques dans l’asthme, la rhinite allergique, les infections virales a été rapportée initialement par B. Lambrecht et ses collègues [
35]. Certaines sous-populations de cellules dendritiques ont ainsi été impliquées dans l’entrée, la dissémination de pathogènes divers et/ou la résistance à ces pathogènes. Des patients présentant une mutation autosomique dominante ou récessive dans le gène codant le facteur de transcription interferon regulatory factor (IRF8) (mutation qui empêche la fixation d’IRF8 à l’ADN) ont des taux circulants de monocytes et de cellules dendritiques très faibles voire nuls et développent une infection disséminée en réponse à l’inoculation du BCG et/ou de pathologies mycobactériennes [
36]. Par ailleurs, R. Schreiber et ses collègues ont très récemment montré que l’immunosurveillance naturelle contre les tumeurs murines induites par le méthylcholanthrène nécessite la présence de la chaîne alpha du récepteur des interférons alpha et bêta (IFNAR1) sur les cellules dendritiques CD8alpha + CD103 + et que la résistance à ces tumeurs très immunogènes disparaît chez les souris déficientes pour le facteur de transcription Batf3 [
37]. On citera aussi des arguments plus indirects en faveur du rôle important des cellules dendritiques dans l’immunosurveillance, par exemple la présence de cellules dendritiques productrices de TNFα ou d’IL-23 ou d’IFN de type 1, respectivement dans le psoriasis, les maladies inflammatoires du tube digestif ou le lupus érythémateux disséminé. D’autres observations confirment la pertinence physiopathologique des cellules dendritiques : citons l’efficacité de traitements comme celui qui utilise un agoniste des TLR7/8 (Imiquimod/ALDARA®) qui transforme les CDp en cellules tueuses (par la voie TRAIL et perforine), mécanisme à l’origine de leurs effets antitumoraux dans les cancers basocellulaires ou du col de l’utérus et de la vulve induits par les papillomavirus (HPV) [
38]. À partir de l’observation de M. Albert et N. Bardhwaj (un ancien de l’équipe de R. Steinman) montrant que les cellules dendritiques humaines cross-présentent les antigènes viraux à partir de corps apoptotiques des cellules infectées [
39], les équipes de L. Zitvogel et de G. Kroemer ont pu montrer que les cellules dendritiques myéloïdes intervenaient lors de traitements par chimiothérapie (utilisation d’anthracyclines ou d’oxaliplatine) ou radiothérapie pour présenter les antigènes aux lymphocytes T CD8+ indispensables à la régression tumorale observée après traitement [
40]. Stratégies vaccinales utilisant les cellules dendritiques Tous ces arguments expérimentaux ont conduit les diverses agences réglementaires à autoriser la vaccination de milliers de patients porteurs de tumeurs par des cellules dendritiques générées ex vivo et « chargées » par des antigènes sous diverses formulations. Dans ce domaine également, R. Steinman fût un pionnier et sa conviction du rôle essentiel joué par la cellule dendritique dans l’initiation et le développement d’une réponse immune adaptative l’a amené à élaborer des stratégies vaccinales curatives [ 13] qu’il s’est d’ailleurs appliquées à lui-même en tant que patient cancéreux. Steinman et ses collègues Dhodapkar et Bardwhaj ont d’abord montré que les cellules dendritiques humaines matures et autologues chargées d’antigènes viraux (dérivés du virus influenza) ou dérivés d’autres protéines (comme l’anatoxine tétanique ou l’hémocyanine d’un mollusque, appelée KLH pour keyhole limpet hémocyanine) permettaient d’immuniser des volontaires sains qui développent alors des réponses Tc et Th1 [
41,
42]. Les succès cliniques ont été certes limités par les problèmes de migration des cellules dendritiques vers les ganglions et par le manque d’accès aux adjuvants de maturation ad hoc [
43]. Cependant, l’étude randomisée (dupliquée) de phase III dans le cancer prostatique hormonorésistant a apporté la preuve irréfutable que des cellules dendritiques autologues, mises en présence ex vivo d’une molécule de fusion constituée de GM-CSF et d’un antigène prostatique spécifique et réinjectées aux patients, allongent la survie de ces patients [
44]. Cette stratégie d’immunothérapie cellulaire individualisée a reçu, en avril 2010, l’approbation de la Food and drug administration américaine pour le traitement du cancer prostatique hormonorésistant métastatique. Figdor et ses collègues ont aussi récemment injecté des CDp en présence d’un adjuvant vaccinal pédiatrique dans les ganglions de mélanomes au stade IV et ont obtenu des résultats prometteurs. Les efforts des cinq dernières années ont porté sur le développement d’anticorps ciblant spécifiquement des sous-populations distinctes de cellules dendritiques in vivo. Le pionnier de cette approche a été Ralph Steinman qui a généré un anticorps anti-DEC205 couplé à un antigène (conduisant à l’endocytose et à l’apprêtement de cet antigène). L’utilisation de cet anticorps, conjointement à l’activation de la molécule CD40 également exprimée à la surface des cellules dendritiques, conduit à l’activation de lymphocytes T CD8+ cytotoxiques producteurs d’IFNγ [
45]. Cette approche multiplie ainsi l’efficacité et la qualité du répertoire peptidique présenté aux lymphocytes T (par exemple des antigènes du VIH) [
46,
47]. Est née de ces aventures la compagnie de biotechnologie Celldex Therapeutics qui a lancé des essais de phase I aux États-Unis avec cette dernière approche. D’autres anticorps ciblant d’autres récepteurs de cellules dendritiques (tels que CLEC9A, LOX-1/OLR1, MMR/CD206/MRC-1, DCIR/CLEC4A, DC-SIGN/CD209, CD40) sont en voie de développement préclinique [13]. |
Malgré un parcours exceptionnel apportant des preuves expérimentales multiples sur plus de 40 ans, la carrière de Ralph Steinman a été marquée jusqu’au milieu des années 1990 par un scepticisme important quant à l’importance du rôle joué par les cellules dendritiques dans l’élaboration de la réponse immune adaptative. Pourtant, la démonstration de leur existence et l’analyse détaillée de leurs fonctions ont enfin permis de faire le lien entre antigène et immunogénicité et ouvert d’excitantes perspectives thérapeutiques de vaccination préventive ou curative (cancer, infections) ou d’induction de tolérance (allergie, transplantation, auto-immunité). La contribution majeure de Ralph Steinman à l’immunologie cellulaire moderne fût d’abord couronnée en 2007 par l’attribution du prix Albert Lasker pour la recherche médicale fondamentale [
48]. Ironie du sort, Ralph Steinman décèdera de l’« Empereur des maladies »1 [
50] 48 heures avant la divulgation publique de sa nomination en tant que corécipiendaire du prix Nobel de physiologie ou médecine 2011. Ralph Steinman a pu mener plus de quatre ans de combat contre son cancer du pancréas avancé grâce à ses propres cellules dendritiques utilisées comme vaccin thérapeutique (en association avec la chimiothérapie), générées par notre amie K. Palucka, auteur de nombreux articles sur les cellules dendritiques. Preuve indirecte qu’il ne s’était pas trompé… |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
Footnotes |
1.
Steinman
RM
,
Cohn
ZA
. Identification of a novel cell type in peripheral lymphoid organs of mice: morphology, quantitation, tissue distribution . J Exp Med.
1973; ; 137 : :1142.–1162. 2.
Steinman
RM
,
Witmer
MD
. Lymphoid dendritic cells are potent stimulators of the primary mixed leukocyte reaction in mice . Proc Natl Acad Sci USA.
1978; ; 75 : :5132.–5136. 3.
Nussenzweig
MC
,
Steinman
RM
,
Unkeless
JC
, et al.
Studies of the cell surface of mouse dendritic cells and other leukocytes . J Exp Med.
1981; ; 154 : :168.–187. 4.
Steinman
RM
. Dendritic cells: understanding immunogenicity . Eur J Immunol.
2007; ; 37 : :S53.–S60. 5.
Nussenzweig
MC
,
Steinman
RM
,
Witmer
MD
,
Gutchinov
B
. A monoclonal antibody specific for mouse dendritic cells . Proc Natl Acad Sci USA.
1982; ; 79 : :161.–165. 6.
Lechler
RI
,
Batchelor
JR
. Restoration of immunogenicity to passenger cell-depleted kidney allografts by the addition of donor strain dendritic cells . J Exp Med.
1982; ; 155 : :31.–41. 7.
Faustman
DL
,
Steinman
RM
,
Gebel
HM
, et al.
Prevention of rejection of murine islet allografts by pretreatment with anti-dendritic cell antibody . Proc Natl Acad Sci USA.
1984; ; 81 : :3864.–3868. 8.
Steinman
RM
,
Gutchinov
B
,
Witmer
MD
,
Nussenzweig
MC
. Dendritic cells are the principal stimulators of the primary mixed leukocyte reaction in mice . J Exp Med.
1983; ; 157 : :613.–627. 9.
Nussenzweig
MC
,
Steinman
RM
,
Gutchinov
B
,
Cohn
ZA
. Dendritic cells are accessory cells for the development of anti-trinitrophenyl cytotoxic T lymphocytes . J Exp Med.
1980; ; 152 : :1070.–1084. 10.
Inaba
K
,
Steinman
RM
. Protein-specific helper T lymphocyte formation initiated by dendritic cells . Science.
1985; ; 229 : :475.–479. 11.
Crowley
M
,
Inaba
K
,
Steinman
RM
. Dendritic cells are the principal cells in mouse spleen bearing immunogenic fragments of foreign proteins . J Exp Med.
1990; ; 172 : :383.–386. 12.
Inaba
K
,
Metlay
JP
,
Crowley
MT
,
Steinman
RM
. Dendritic cells pulsed with protein antigens in vitro can prime antigen-specific, MHCrestricted T cells in situ
. J Exp Med.
1990; ; 172 : :631.–640. 13.
Steinman
RM
,
Banchereau
J
. Taking dendritic cells into medicine . Nature.
2007; ; 449 : :419.–426. 14.
Janeway
CA
Jr.
. Approaching the asymptote? Evolution and revolution in immunology . Cold Spring Harb Symp Quant Biol.
1989; ; 54 : :1.–13. 15.
Matzinger
P
. Tolerance, danger, and the extended family . Annual Rev Immunol.
1994; ; 12 : :991.–1045. 16.
Inaba
K
,
Young
JW
,
Steinman
RM
. Direct activation of CD8+ cytotoxic T lymphocytes by dendritic cells . J Exp Med.
1987; ; 166 : :182.–194. 17.
Trombetta
ES
,
Mellman
I
. Cell biology of antigen processing in vitro and in vivo
. Annu Rev Immunol.
2005; ; 23 : :975.–1028. 18.
Bar-On
L
,
Jung
S
. Defining dendritic cells by conditional and constitutive cell ablation . Immunol Rev.
2010; ; 234 : :76.–89. 19.
Jung
S
,
Unutmaz
D
,
Wong
P
, et al.
In vivo depletion of CD11c+ dendritic cells abrogates priming of CD8+ T cells by exogenous cell-associated antigens . Immunity.
2002; ; 17 : :211.–220. 20.
Fernandez
NC
,
Lozier
A
,
Flament
C
, et al.
Dendritic cells directly trigger NK cell functions: cross-talk relevant in innate anti-tumor immune responses in vivo
. Nat Med.
1999; ; 5 : :405.–411. 21.
Ikarashi
Y
,
Mikami
R
,
Bendelac
A
, et al.
Dendritic cell maturation overrules H-2D-mediated natural killer T (NKT) cell inhibition: critical role for B7 in CD1d-dependent NKT cell interferon gamma production . J Exp Med.
2001; ; 194 : :1179.–1186. 22.
Ferlazzo
G
,
Tsang
ML
,
Moretta
L
, et al.
Human dendritic cells activate resting natural killer (NK) cells and are recognized via the nkp30 receptor by activated NK cells . J Exp Med.
2002; ; 195 : :343.–351. 23.
Shortman
K
,
Liu
YJ
. Mouse and human dendritic cell subtypes . Nat Rev Immunol.
2002; ; 2 : :151.–161. 24.
Hoeffel
G
,
Ripoche
AC
,
Matheoud
D
, et al.
Antigen crosspresentation by human plasmacytoid dendritic cells . Immunity.
2007; ; 27 : :481.–492. 25.
Ginhoux
F
,
Liu
K
,
Helft
J
, et al.
The origin and development of nonlymphoid tissue CD103+ DCs . J Exp Med.
2009; ; 206 : :3115.–3130. 26.
Geissmann
F
,
Manz
MG
,
Jung
S
, et al.
Development of monocytes, macrophages, and dendritic cells . Science.
2010; ; 327 : :656.–661. 27.
Varol
C
,
Landsman
L
,
Fogg
DK
, et al.
Monocytes give rise to mucosal, but not splenic, conventional dendritic cells . J Exp Med.
2007; ; 204 : :171.–180. 28.
Jiang
W
,
Swiggard
WJ
,
Heufler
C
, et al.
The receptor DEC-205 expressed by dendritic cells and thymic epithelial cells is involved in antigen processing . Nature.
1995; ; 375 : :151.–155. 29.
Bonifaz
L
,
Bonnyay
D
,
Mahnke
K
, et al.
Efficient targeting of protein antigen to the dendritic cell receptor DEC-205 in the steady state leads to antigen presentation on major histocompatibility complex class I products and peripheral CD8+ T cell tolerance . J Exp Med.
2002; ; 196 : :1627.–1638. 30.
Liu
K
,
Iyoda
T
,
Saternus
M
, et al.
Immune tolerance after delivery of dying cells to dendritic cells in situ
. J Exp Med.
2002; ; 196 : :1091.–1097. 31.
Watanabe
N
,
Wang
YH
,
Lee
HK
, et al.
Hassall’s corpuscles instruct dendritic cells to induce CD4+CD25+ regulatory T cells in human thymus . Nature.
2005; ; 436 : :1181.–1185. 32.
Luo
X
,
Tarbell
KV
,
Yang
H
, et al.
Dendritic cells with TGF-beta1 differentiate naive CD4+CD25–T cells into islet-protective Foxp3+ regulatory T cells . Proc Natl Acad Sci USA.
2007; ; 104 : :2821.–2826. 33.
Yamazaki
S
,
Iyoda
T
,
Tarbell
K
, et al.
Direct expansion of functional CD25+ CD4+ regulatory Tcells by antigen processing dendritic cells . J Exp Med.
2003; ; 198 : :235.–247. 34.
Ghiringhelli
F
,
Puig
PE
,
Roux
S
, et al.
Tumor cells convert immature myeloid dendritic cells into TGF-beta-secreting cells inducing CD4+CD25+ regulatory T cell proliferation . J Exp Med.
2005; ; 202 : :919.–929. 35.
Kool
M
,
Lambrecht
BN
. Dendritic cells in asthma and COPD: opportunities for drug development . Curr Opin Immunol.
2007; ; 19 : :701.–710. 36.
Hambleton
S
,
Salem
S
,
Bustamante
J
, et al.
IRF8 mutations and human dendritic-cell immunodeficiency . N Engl J Med.
2011; ; 365 : :127.–138. 37.
Hildner
K
,
Edelson
BT
,
Purtha
WE
, et al.
Batf3 deficiency reveals a critical role for CD8alpha+ dendritic cells in cytotoxic T cell immunity . Science.
2008; ; 322 : :1097.–1100. 38.
Stary
G
,
Bangert
C
,
Tauber
M
, et al.
Tumoricidal activity of TLR7/8-activated inflammatory dendritic cells . J Exp Med.
2007; ; 204 : :1441.–1451. 39.
Albert
ML
,
Sauter
B
,
Bhardwaj
N
. Dendritic cells acquire antigen from apoptotic cells and induce class I-restricted CTLs . Nature.
1998; ; 392 : :86.–89. 40.
Apetoh
L
,
Ghiringhelli
F
,
Tesniere
A
, et al.
Toll-like receptor 4-dependent contribution of the immune system to anticancer chemotherapy and radiotherapy . Nat Med.
2007; ; 13 : :1050.–1059. 41.
Dhodapkar
M
,
Steinman
RM
,
Sapp
M
, et al.
Rapid generation of broad T-cell immunity in humans after single injection of mature dendritic cells . J Clin Invest.
1999; ; 104 : :173.–180. 42.
Dhodapkar
MV
,
Bhardwaj
N
. Active immunization of humans with dendritic cells . J Clin Immunol.
2000; ; 20 : :167.–174. 43.
Zitvogel
L
,
Mayordomo
JI
,
Tjandrawan
T
, et al.
Therapy of murine tumors with tumor peptide-pulsed dendritic cells: dependence on T cells, B7 costimulation, and T helper cell 1-associated cytokines . J Exp Med.
1996; ; 183 : :87.–97. 44.
Cheever
MA
,
Higano
CS
. Provenge (Sipuleucel-T) in prostate cancer: the first FDA-approved therapeutic cancer vaccine . Clin Cancer Res.
2011; ; 17 : :3520.–3526. 45.
Bonifaz
L
,
Bonnyay
D
,
Mahnke
K
, et al.
Efficient targeting of protein antigen to the dendritic cell receptor DEC-205 in the steady state leads to antigen presentation on major histocompatibility complex class I products and peripheral CD8+ T cell tolerance . J Exp Med.
2002; ; 196 : :1627.–1638. 46.
Bozzacco
L
,
Trumpfheller
C
,
Siegal
FP
, et al.
DEC-205 receptor on dendritic cells mediates presentation of HIV gag protein to CD8+ T cells in a spectrum of human MHC I haplotypes . Proc Natl Acad Sci USA.
2007; ; 104 : :1289.–1294. 47.
Nchinda
G
,
Kuroiwa
J
,
Oks
M
, et al.
The efficacy of DNA vaccination is enhanced in mice by targeting the encoded protein to dendritic cells . J Clin Invest.
2008; ; 118 : :1427.–1432. 48.
Bashyam
H
. Ralph Steinman: dendritic cells bring home the Lasker . J Exp Med.
2007; ; 204 : :2245.–2248. 49.
Lotteau
V
. Prix Nobel de Médecine 1996 : Peter C. Doherty et Rolf M. Zinkernagel. La restriction de la réponse immunitaire par le complexe majeur d’histocompatibilité . Med Sci (Paris).
1996; ; 12 : :1316.–1318. 50.
Mukherjee
S
. The Emperor of all maladies: a biography of cancer . New York: : Scribner; , 2010 : :592 p.. |