| |
| Med Sci (Paris). 2011 December; 27(12): 1050–1052. Published online 2011 December 23. doi: 10.1051/medsci/20112712004.Contrôle du développement embryonnaire par des petits ARN issus de transposons
Catherine Papin1* and Martine Simonelig1** 1Institut de génétique humaine, UPR1142-CNRS, 141, rue de la Cardonille, 34396Montpellier, France MeSH keywords: Animaux, Éléments transposables d'ADN, génétique, physiologie, Drosophila, embryologie, Embryon non mammalien, Développement embryonnaire, Régulation de l'expression des gènes au cours du développement, Humains, Modèles biologiques, Polyadénylation, Stabilité de l'ARN, Petit ARN non traduit, Protéines de liaison à l'ARN |
Les transposons et leur régulation par les piARN Les éléments transposables ou transposons sont des séquences répétées d’ADN qui ont la capacité de se déplacer dans le génome, par transposition, et de provoquer des mutations. Le phénomène de transposition est en général assez rare, mais les transposons sont pourtant des constituants très importants des génomes eucaryotes et peuvent en représenter une grande proportion. Ils composent, par exemple, 45 % du génome humain [
1]. Ces transposons, découverts dans les années 1950, ont longtemps fait figure de parasites du génome. Ils sont maintenant considérés comme des acteurs incontournables de la dynamique et de l’évolution des génomes parce qu’ils créent des mutations, des réarrangements chromosomiques ou de nouvelles régulations en s’insérant à proximité de gènes [1]. Il est cependant essentiel de réprimer la transposition afin, notamment, de maintenir l’intégrité de l’ADN dans les cellules germinales et permettre sa transmission à la génération suivante. Des mécanismes de répression de la transposition ont donc été mis en place par les génomes hôtes. Une voie de régulation spécifique impliquant des petits ARN non codants, les Piwi-interacting ARN ou piARN, permet de réprimer la transposition des transposons dans la lignée germinale [
2–
4]. Les piARN sont de petits ARN de 24 à 29 nucléotides. Leur production dépend des protéines Argonaute de la famille Piwi : Piwi, Aubergine (Aub) et Ago3 chez la drosophile. Les piARN sont issus d’ARNm (ARN messagers) provenant majoritairement d’éléments transposables et de séquences répétées composées d’éléments transposables défectifs, appelées piARN clusters. Les piARN sont donc des fragments d’ARN issus d’éléments transposables. Ils s’associent aux protéines Argonaute de la famille Piwi et répriment les transposons par un mécanisme commun à toutes les voies de répression par les petits ARN non codants : la reconnaissance d’un ARN cible (ici l’ARNm de transposon) par les petits ARN non codants (ici les piARN) via leur complémentarité de séquences. Cette interaction conduit au clivage de l’ARNm de transposon par les protéines Argonaute, produisant ainsi des piARN. |
Rôle clé de la dégradation des ARNm maternels lors de l’activation du génome zygotique Chez de nombreuses espèces, les gènes de l’embryon ne sont pas exprimés lors des toutes premières étapes du développement. Le début du développement est donc assuré par les ARNm maternels apportés dans l’ovocyte. Le contrôle du développement passe ensuite du génome maternel au génome zygotique lors de la transition maternelle-zygotique. Cette transition dépend notamment de la dégradation des ARNm maternels. La déadénylation des ARNm, c’est-à-dire le raccourcissement de leurs queues polyadénylées, représente la première étape de dégradation des ARNm et implique une enzyme, la déadénylase CCR4, responsable de ce raccourcissement. Ce processus de régulation de la taille de la queue poly(A) des ARNm dépend aussi d’éléments en cis présents généralement dans les régions 3’ non traduites (3’UTR) des ARNm, et de facteurs en trans capables de reconnaître ces éléments, tels que des protéines de liaison à l’ARN ou des petits ARN non codants comme les microARN [
5]. Ces facteurs vont recruter la déadénylase à proximité de la queue poly(A) de l’ARNm et permettre la déadénylation de ce dernier. Nous avons pris comme modèle d’étude de la dégradation des ARNm maternels, l’ARNm nanos qui est un déterminant essentiel pour la formation des structures postérieures chez la drosophile (l’abdomen et les cellules germinales). L’ARNm nanos localisé au pôle postérieur de l’embryon est traduit en protéine et donne naissance à un gradient de protéine Nanos du pôle postérieur vers le pôle antérieur. À l’inverse, l’ARNm nanos présent dans le reste de l’embryon doit être absolument réprimé pour le développement correct de la tête et du thorax [
6]. Au niveau moléculaire, nous avons montré que cette répression dans le corps de l’embryon est en partie dépendante de la déadénylase CCR4 recrutée par Smaug, une protéine de liaison à l’ARN, sur l’ARNm nanos [
7]. |
Les piARN sont requis pour la dégradation de l’ARNm maternel nanos
Les microARN ont été identifiés comme des éléments importants de la régulation des ARNm. Les données récentes indiquent que le mécanisme majeur de répression par les microARN fait intervenir une déadénylation par la déadénylase CCR4 [5]. Nous avons donc étudié le rôle des petits ARN non codants dans la répression de l’ARNm nanos et montré qu’ils participent à la dégradation de cet ARNm dans l’embryon précoce. Ainsi, l’utilisation de drosophiles mutantes dépourvues des protéines impliquées dans la voie des piARN - par exemple Aub, Piwi, Ago3 ou Spindle E (SpnE) -, montre que ces protéines sont nécessaires à la déadénylation et à la dégradation de l’ARNm nanos dans le corps de l’embryon. En effet, l’absence d’une protéine de la voie des piARN conduit irrémédiablement à l’expression anormale de Nanos au pôle antérieur de l’embryon ce qui a pour conséquence de graves défauts dans le développement du squelette céphalo pharyngé (Figure 1). Ce rôle de la voie des piARN est direct. En effet, les protéines Smaug et CCR4, dont on connaît déjà le rôle dans la régulation de l’ARNm nanos, forment un complexe dans l’embryon avec les protéines spécifiques de la voie des piARN, Aub et Ago3. De plus, l’ARNm nanos interagit avec Smaug et Aub (Figure 2). De façon intéressante, cette régulation génique implique les piARN eux-mêmes. En effet, le répertoire des piARN présents dans les embryons précoces a été obtenu par séquençage. Ainsi, en recherchant, par des méthodes bio-informatiques, des piARN capables de reconnaître des séquences dans la région 3’UTR de nanos, nous avons identifié deux sites cibles potentiels, complémentaires de deux piARN présents dans les embryons. Ces deux piARN proviennent d’éléments transposables classiques, les transposons roo et 412 présents dans le génome de la drosophile. Des expériences fonctionnelles sont en accord avec la fonction directe des piARN dans la régulation de l’ARNm nanos. Ainsi, la délétion des séquences cibles potentielles de ces piARN dans la région 3’UTR de nanos affecte la déadénylation de l’ARNm nanos. De plus, l’injection dans l’embryon de petits ARN antisens des piARN des transposons roo et 412 complémentaires au 3’UTR de nanos, conduit à des défauts de développement du squelette céphalo-pharyngé suggérant une expression anormale de Nanos au pôle antérieur de l’embryon [
8].
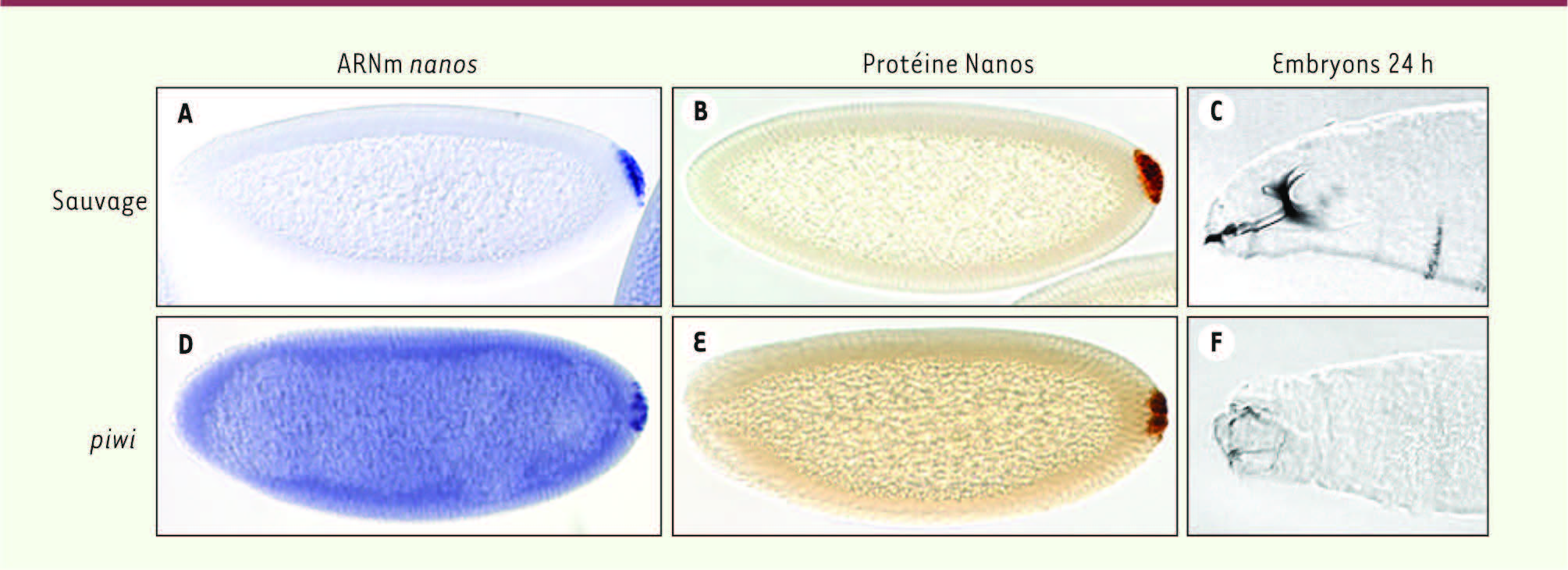
 | Figure 1
L’absence de la protéine Piwi conduit à la stabilisation de l’ARNm nanos et à l’expression ectopique de la protéine Nanos dans tout l’embryon. Des embryons de drosophiles sauvages (A-C) ou mutants pour le gène piwi
(D-F) à 3 h (A, B, D, E) ou 24 h (C, F) de développement sont montrés. Le pôle antérieur des embryons est à gauche. À 3 h de développement, l’ARNm nanos est dégradé dans le corps de l’embryon dans les embryons sauvages. Cet ARNm (A) ainsi que la protéine Nanos (B) sont restreints au pôle postérieur. Squelette céphalopharyngé d’un embryon sauvage (C). L’absence de la protéine Piwi conduit à la stabilisation de l’ARNm nanos
(D) et à l’expression ectopique de la protéine Nanos (E) dans tout l’embryon à 3 h de développement. La présence de Nanos au pôle antérieur conduit à des défauts de développement du squelette céphalo-pharyngé (F) (d’après [ 8] avec modifications). |
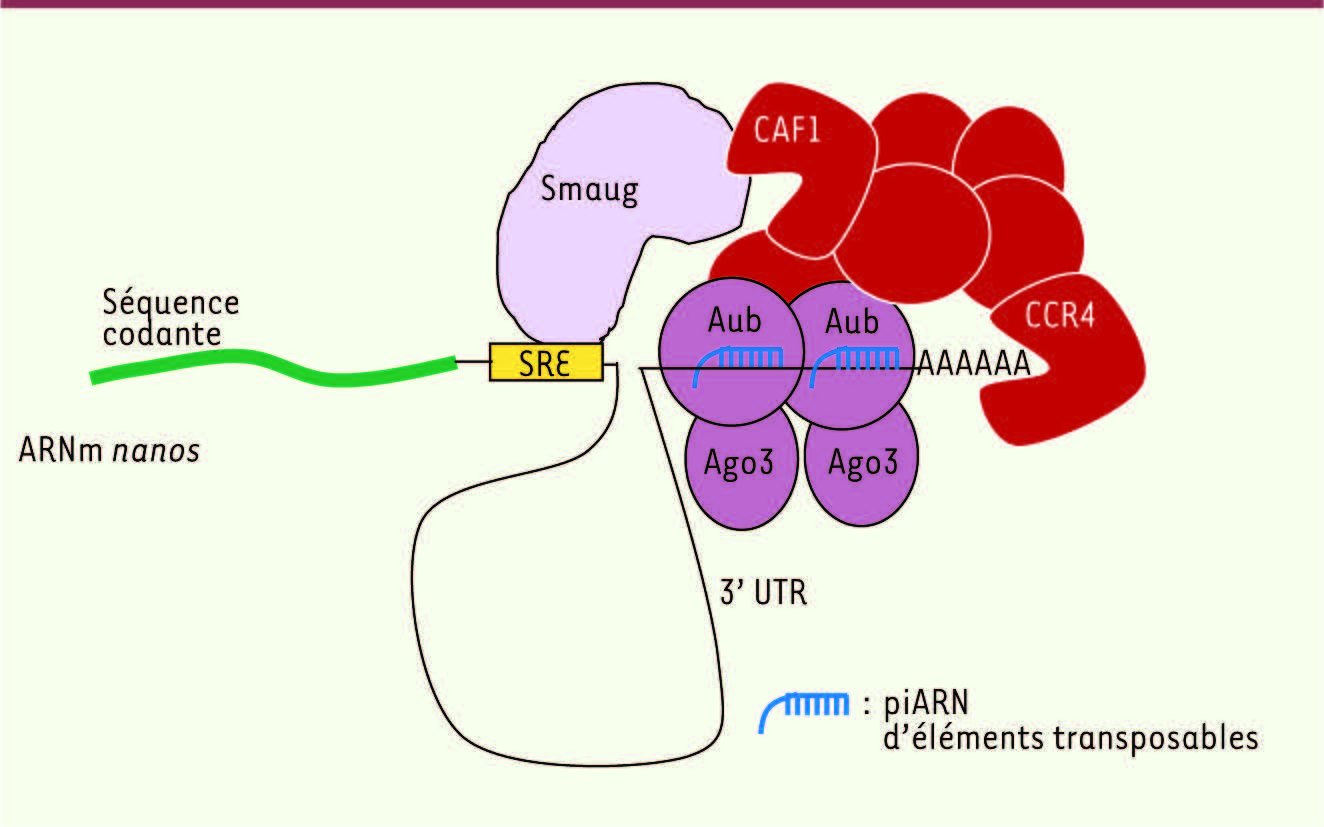
 | Figure 2
Modèle d’interactions ARN-protéine dans le complexe de déadénylation de l’ARNm nanos. La région 3’UTR de nanos est représentée par une ligne fine et la queue poly(A) par une série de A. Le complexe de déadénylation CCR4 est composé de 7 protéines (en rouge). La protéine de liaison à l’ARN Smaug interagit avec le complexe de déadénylation et recrute ce complexe sur l’ARNm nanos via la reconnaissance d’une séquence spécifique (SRE) localisée dans le 3’UTR de nanos. Les piARN complémentaires du 3’UTR de nanos, associés à Aub et Ago3, permettent de guider l’interaction de ces protéines avec la région 3’UTR de nanos. Aub et Ago3, interagissant directement ou non avec le complexe de déadénylation, aident à la stabilisation de ce complexe sur l’ARNm nanos. Une partie de la séquence codante de nanos est représentée (ligne épaisse) (d’après [ 8] avec modifications). |
Les éléments transposables sont maintenant des acteurs reconnus de la diversité, de la structure et de l’évolution des génomes. Cependant, on ne leur connaissait pas de fonction essentielle dans le développement d’un organisme. Nos résultats proposent une fonction nouvelle et directe des éléments transposables dans le développement embryonnaire par l’intermédiaire de régulations géniques. Ces données apportent un nouvel éclairage sur la fonction des éléments transposables et renforcent la notion d’une coévolution étroite entre les éléments transposables et le génome hôte [8,
9]. Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Ce travail a été financé par le Centre national de la recherche scientifique (CNRS), l’Agence nationale pour la recherche (ANR-06-BLAN-0343, ANR-2010-BLAN-1201 01), la Fondation pour la recherche médicale (« Équipe FRM 2007» et «Projets innovants ING 20101221078 »), et l’Association pour la recherche sur le cancer (ARC libre 2009, n° 3192).
|
1.
Biemont
C
,
Vieira
C
. Genetics: junk DNA as an evolutionary force . Nature.
2006; ; 443 : :521.–524. 2.
Khurana
JS
,
Theurkauf
W
. piRNAs, transposon silencing, and Drosophila germline development . J Cell Biol.
2010; ; 191 : :905.–913. 3.
Saito
K
,
Siomi
MC
. Small RNA-mediated quiescence of transposable elements in animals . Dev Cell.
2010; ; 19 : :687.–697. 4.
Senti
KA
,
Brennecke
J
. The piRNA pathway: a fly’s perspective on the guardian of the genome . Trends Genet.
2010; ; 26 : :499.–509. 5.
Huntzinger
E
,
Izaurralde
E
. Gene silencing by microRNAs: contributions of translational repression and mRNA decay . Nat Rev Genet.
2011; ; 12 : :99.–110. 6.
Dahanukar
A
,
Wharton
RP
. The Nanos gradient in Drosophila embryos is generated by translational regulation . Genes Dev.
1996; ; 10 : :2610.–2620. 7.
Zaessinger
S
,
Busseau
I
,
Simonelig
M
. Oskar allows nanos mRNA translation in Drosophila embryos by preventing its deadenylation by Smaug/CCR4 . Development.
2006; ; 133 : :4573.–4583. 8.
Rouget
C
,
Papin
C
,
Boureux
A
, et al. Maternal mRNA deadenylation and decay by the piRNA pathway in the early Drosophila embryo . Nature.
2010; ; 467 : :1128.–1132. 9.
Simonelig
M
. Developmental functions of piRNAs and transposable elements: A Drosophila point-of-view . RNA Biol.
2011; ; 8 : :754.–759. |