| |
| Med Sci (Paris). 2011 December; 27(12): 1058–1061. Published online 2011 December 23. doi: 10.1051/medsci/20112712007.Les contes de la voie Wnt Comment GSK3 fut enfermée dans les endosomes multivésiculaires Jean-Louis Plouhinec1* and Vincent Taelman1 1Howard Hughes Medical Institute et Department of Biological Chemistry, University of California, HHMI-UCLA 5577-MRL, 675 Charles E. Young Drive South, Los Angeles, CA 90095-1662, États-Unis MeSH keywords: Animaux, Endocytose, physiologie, Endosomes, métabolisme, Glycogen Synthase Kinase 3, antagonistes et inhibiteurs , génétique, Humains, Modèles biologiques, Corps multivésiculaires, Transport de protéines, Voie de signalisation Wnt |
L’étude de la signalisation cellulaire, le processus par lequel les cellules communiquent entre elles et intègrent les informations de leur environnement, a permis de grandes avancées dans la compréhension de la physiologie humaine et de ses dérèglements comme le cancer ou le diabète. La voie de signalisation Wnt dite canonique est une des voies majeures de signalisation et un acteur crucial dans le développement embryonnaire et l’homéostasie des tissus adultes, notamment des os et de l’intestin. Les mutations affectant cette voie de signalisation sont à l’origine de plusieurs maladies génétiques, affectant par exemple la densité osseuse, et sont impliquées dans de nombreux cancers comme ceux du côlon [
1]. Le contrôle de la stabilité de la protéine cytoplasmique β-caténine par la kinase GSK3 (glycogen synthase kinase 3) est un élément clé de la voie Wnt canonique. Cependant le mécanisme exact par lequel la voie Wnt inhibe l’activité de cette kinase était jusqu’à présent mal compris. Dans une étude récente [
2], nous avons montré que l’activation de la voie Wnt induit la séquestration de GSK3 à l’intérieur de vésicules intracellulaires appelées endosomes multivésiculaires (MVE). |
Fonctionnement de la voie Wnt La protéine β-caténine joue un rôle central dans la voie Wnt : c’est son accumulation nucléaire qui détermine la réponse transcriptionnelle à l’activation de cette voie. Deux décennies de recherche ont conduit à un modèle de la voie Wnt dont la logique est la suivante [
3] : lorsque la voie est inactive, la β-caténine synthétisée dans le cytoplasme est constamment dégradée par l’action d’un complexe de destruction composé des protéines d’échafaudage axine et APC (le suppresseur de tumeur adenomatous polyposis coli), ainsi que des kinases CK1 (casein kinase 1) et GSK3. Ce complexe se lie à la β-caténine, que CK1 et GSK3 phosphorylent dans sa région amino-terminale. La β-caténine phosphorylée est alors reconnue par l’ubiquitine ligase β-TRCP (β-transducin repeat containing protein), polyubiquitinylée et dégradée par le protéasome. En l’absence de β-caténine, les gènes cibles de la voie Wnt sont réprimés par les facteurs de transcription de la famille TCF/LEF (T cell factor/lymphoid enhancer factor). L’interaction du ligand Wnt avec les récepteurs LRP5/6 (low density lipoprotein receptor related protein 5/6) et Frizzled entraîne le recrutement par ces récepteurs des protéines Axin et GSK3 et, par un processus jusqu’à présent mal compris, l’inhibition de l’activité du complexe de destruction. La β-caténine, qui n’est plus phosphorylée ni dégradée, s’accumule alors dans le noyau de la cellule, y forme un complexe avec les facteurs de transcription TCF/LEF et active les gènes cibles de la voie Wnt. |
Rôle du processus d’endocytose dans l’inhibition de la kinase GSK3 Récemment, le processus d’endocytose par lequel la cellule internalise les protéines membranaires et des composés extracellulaires est apparu comme un point de régulation majeur de la signalisation cellulaire, qui conditionne notamment la terminaison du signal [
4]. Ce rôle a été mis en évidence lors des études pionnières sur la signalisation par le facteur de croissance EGF (epidermal growth factor). Lorsque le récepteur de l’EGF est activé par la liaison avec son ligand, il assemble un complexe moléculaire de signalisation aussi appelé « signalosome ». Ce complexe est rapidement internalisé dans le cytoplasme à la surface de vésicules appelées endosomes. Au cours de ce processus, le complexe reste en contact avec le cytoplasme et continue d’activer la voie de signalisation. Pour terminer le signal, la cellule utilise la machinerie ESCRT (endosomal sorting complex required for transport) qui, à la manière de poupées russes, internalise ces signalosomes dans des vésicules à l’intérieur de l’endosome, lequel devient alors un endosome multivésiculaire (MVE). Les signalosomes séquestrés dans ces vésicules intraluminales deviennent incapables de transmettre un signal au cytoplasme. Le MVE fusionne ultérieurement avec un lysosome, un organite intracellulaire chargée de dégrader son contenu. Le ligand Wnt avait déjà été détecté dans des MVE chez la drosophile [
5], laissant penser que la voie Wnt pourrait fonctionner suivant un principe similaire à celui que nous venons de décrire pour la voie EGF. Nous avons donc émis l’hypothèse que l’internalisation du signalosome Wnt dans des MVE par la machinerie ESCRT entraînerait la séquestration physique de GSK3 dans des vésicules intraluminales (Figure 1). Cette séquestration induirait l’inhibition de GSK3, offrant ainsi une explication moléculaire à l’inhibition de cette kinase lors de l’activation de la voie Wnt.
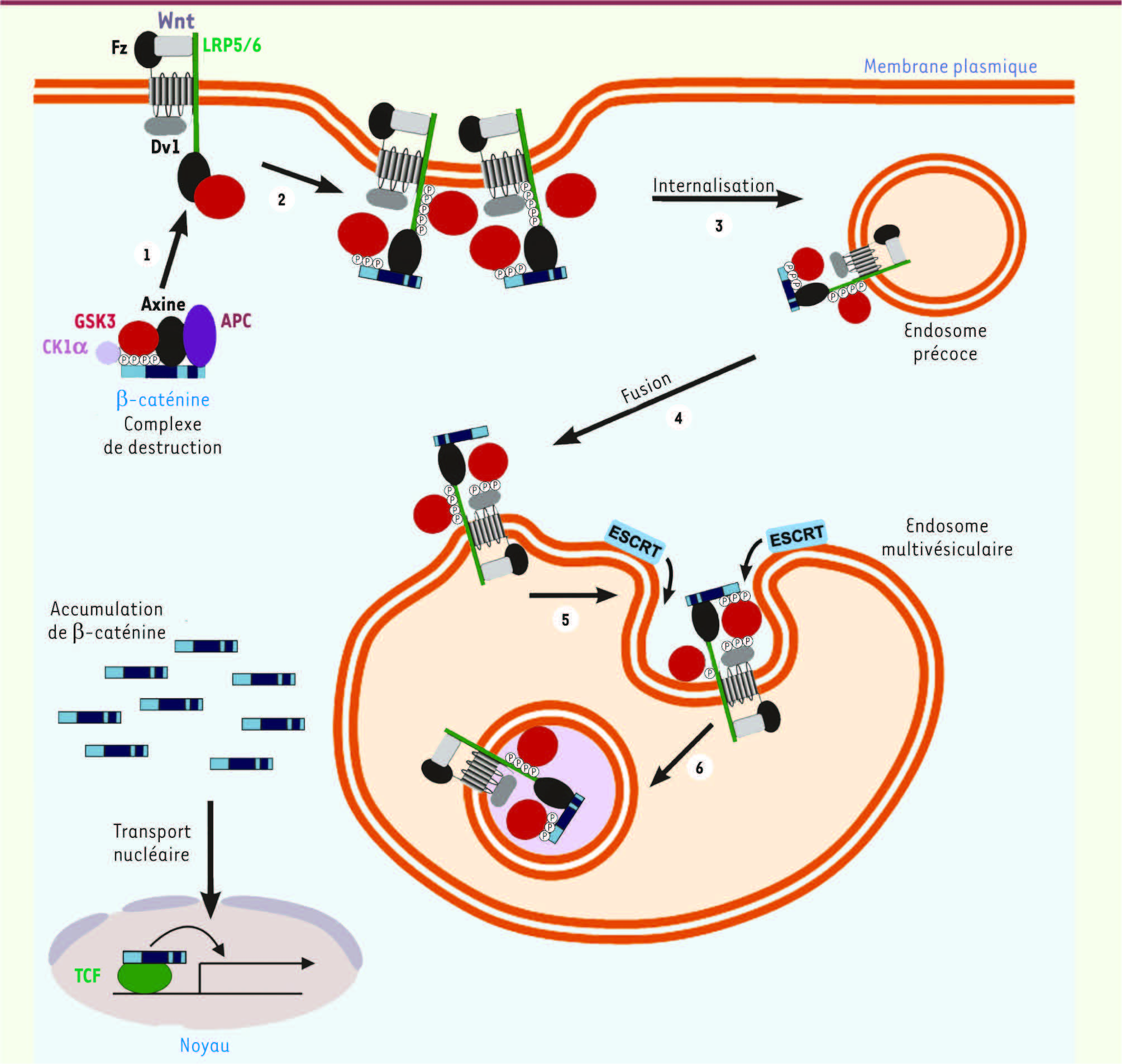
 | Figure 1
Modèle de la séquestration de GSK3 dans des endosomes multivésiculaires par la voie de signalisation Wnt canonique. L’association du ligand Wnt avec ses récepteurs induit le recrutement de la sérine/thréonine kinase GSK3 (en rouge) à partir du cytoplasme vers le complexe récepteur au niveau de la membrane plasmique (1). Ces complexes se regroupent pour former des signalosomes (2) et sont ensuite internalisés dans des endosomes précoces (3). Ces derniers fusionnent alors avec des endosomes multivésiculaires (4) et l’action de la machinerie ESCRT (5) conduit à l’internalisation du signalosome et de GSK3 dans des vésicules intraluminales (6). Cette séquestration de GSK3 dans des vésicules intracellulaires entraîne la stabilisation de ses substrats cytosoliques tels que la β-caténine ainsi que d’une multitude d’autres protéines cibles (diagramme adapté de [ 2]). |
Nos observations expérimentales corroborent cette hypothèse : bien que la quantité de kinase GSK3 reste constante dans la cellule, son activité dans le cytoplasme décroît de plus de 60 % lorsque la voie Wnt est stimulée. Cette stimulation protège également GSK3 contre l’action de protéases qui digèrent les protéines cytoplasmiques. Or, ces deux caractéristiques, diminution d’activité de GSK3 et insensibilité aux protéases, sont abolies par l’addition de détergents qui dissolvent les membranes lipidiques, ce qui suggère que lors de l’activation de la voie de signalisation Wnt, une proportion significative du stock cellulaire de GSK3 est relocalisée dans des compartiments membranaires inaccessibles aux protéases. Par ailleurs, on observe que GSK3 et le ligand Wnt endocyté sont colocalisés au niveau d’endosomes; de plus, GSK3, qui est cytoplasmique en l’absence de Wnt, est détectée par microscopie électronique à l’intérieur de MVE après la liaison du ligand. Enfin, nous avons montré que la machinerie ESCRT, indispensable à la formation des MVE et à l’internalisation de GSK3, est requise pour l’activation de la voie Wnt. Il est intéressant de noter que, contrairement à ce qui se passe lors de l’activation du récepteur à l’EGF où l’internalisation du signalosome dans les MVE entraîne la terminaison du signal, dans le cas de la voie Wnt activée, la séquestration de GSK3 dans les MVE par la machinerie ESCRT est un signal d’activation. |
Effets de la voie Wnt sur les cibles de la kinase GSK3 Outre la β-caténine, il a été montré que GSK3 contrôle la dégradation de plusieurs autres protéines impliquées dans le contrôle de la prolifération cellulaire : c’est le cas des facteurs de transcription Smad, intermédiaires clés de la voie de signalisation du TGFβ (transforming growth factor), ainsi que de plusieurs oncogènes (Myc, Maf, Snail) [
6]. La séquestration d’une partie importante du stock cellulaire de GSK3 au cours de l’activation de la voie Wnt pourrait donc affecter globalement la phosphorylation des cibles de cette kinase et leur stabilité. En mesurant la demi-vie des protéines nouvellement synthétisées dans des cellules en culture, nous avons observé que l’activation de la voie Wnt et l’inhibition de GSK3 augmentent la stabilité de nombreuses protéines cellulaires. Nous avons identifié les protéines cibles potentielles de GSK3 en réalisant une analyse bioinformatique du protéome humain à la recherche de motifs peptidiques reconnus par GSK3. Cette kinase reconnaît comme substrat des protéines contenant une sérine ou une thréonine (S/T) phosphorylée, et elle phosphoryle à son tour une sérine ou une thréonine située quatre acides aminés (aa) en amont dans la séquence de la protéine substrat. Cette réaction peut se poursuivre s’il existe une autre sérine/thréonine quatre aa en amont, permettant des phosphorylations en chaîne à partir d’une sérine/thréonine d’amorçage phosphorylée par une autre kinase [
7,
8]. Par exemple, dans le cas du motif LDSGIHSGATSTAPSLS présent dans la β-caténine, la phosphorylation par CK1 de la sérine représentée en bleu (ci-dessus) entraîne la phosphorylation par GSK3 des autres sérines soulignées. Ces phosphorylations en série peuvent être reconnues, comme dans le cas de la β-caténine, par des ubiquitine ligases qui marquent la protéine qui sera dégradée. Cette analyse montre que 20 % des protéines humaines contiennent un tel motif. Ces motifs ne sont probablement pas tous fonctionnels, car ils doivent être accessibles à GSK3 et non enfouis dans la protéine, et ils doivent être reconnus également par une kinase d’amorçage. Cependant, une proportion importante de ces motifs sont probablement accessibles : beaucoup contiennent un site d’amorçage potentiellement reconnu par une kinase (MAPK, CK2, PKA) et sont conservés au cours de l’évolution dans les protéines de la même famille. Cette analyse nous apprend également que les protéines impliquées dans la transcription et la régulation de la chromatine sont surreprésentées parmi les cibles de GSK3, ce qui suggère que GSK3 est particulièrement impliquée dans la régulation de ces processus. Nous avons validé cette analyse sur une des protéines contenant un motif conservé, HDAC4 (histone déacétylase 4, impliquée dans la régulation de la chromatine), en montrant qu’elle est stabilisée par la voie Wnt et que cette stabilisation est régulée par le motif identifié. Enfin, cette observation peut être généralisée : en effet, nous avons montré que si l’on ajoute à une protéine un motif reconnu par GSK3, sa stabilité dépend alors de l’activation de la voie Wnt. Ce résultat suggère que de tels motifs peuvent servir de senseurs combinant la lecture de l’activité de la voie Wnt et de la kinase d’amorçage. Du fait de leur simplicité, ces motifs peuvent être facilement gagnés ou perdus par une protéine en quelques mutations au hasard de l’évolution pour adapter sa régulation à de nouvelles nécessités. |
Conclusions et perspectives Notre étude a permis de montrer que la séquestration par la machinerie d’endocytose d’une protéine cytoplasmique, la kinase GSK3, est une étape essentielle de l’activation de la voie de signalisation Wnt. Nous avons mis en évidence un nouveau mécanisme d’inhibition d’une protéine par sa séquestration dans des vésicules intracellulaires. Cette découverte souligne l’adaptabilité de la machinerie d’endocytose et son importance dans la signalisation cellulaire, ce qui explique qu’elle soit souvent dérégulée dans les cellules tumorales [
9]. En revanche, le mécanisme contrôlant la terminaison du signal Wnt et le retour de GSK3 dans le cytoplasme reste inconnu. Cette étude a également démontré que la voie Wnt régule au niveau post-traductionnel la stabilité de nombreuse protéines intracellulaires. Cette régulation ne se limite pas à la stabilité de ces protéines et peut également affecter leur activité [
10]. Ce résultat souligne que l’activation de cette voie de signalisation ne donne pas seulement lieu à une réponse transcriptionnelle classique, mais peut également affecter directement le fonctionnement de nombreux processus cellulaires. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Les auteurs remercient Lise Zakin, René Plouhinec, et Hélène Plouhinec pour leur relecture attentive du manuscrit.
|
1.
Clevers
H
. Wnt/β-catenin signaling in development and disease . Cell.
2006; ; 127 : :469.–480. 2.
Taelman
VF
,
Dobrowolski
R
,
Plouhinec
JL
, et al.
Wnt signaling requires sequestration of glycogen synthase kinase 3 inside multivesicular endosomes . Cell.
2010; ; 143 : :1136.–1148. 3.
MacDonald
BT
,
Tamai
K
,
He
X
. Wnt/β-catenin signaling: components, mechanisms, and diseases . Dev Cell.
2009; ; 17 : :9.–26. 4.
Platta
HW
,
Stenmark
H
. Endocytosis and signaling . Curr Opin Cell Biol.
2011; ; 23 : :1.–11. 5.
Van den Heuvel
M
,
Nusse
R
,
Johnston
P
,
Lawrence
PA
,
Lawrence
PA
. Distribution of the wingless gene product in Drosophila embryos: a protein involved in cell-cell communication . Cell.
1989; ; 59 : :739.–749. 6.
Sutherland
C
. What are the bona fide GSK3 substrates?
Int J Alzheimer Dis.
2011; ; 2011 : :505.–607. 7.
Fiol
CJ
,
Wang
A
,
Roeske
RW
,
Roach
PJ
. Ordered multisite protein phosphorylation. Analysis of glycogen synthase kinase 3 action using model peptide substrates . J Biol Chem.
1990; ; 265 : :6061.–6065. 8.
Dajani
R
,
Fraser
E
,
Roe
SM
, et al.
Crystal structure of glycogen synthase kinase 3β: structural basis for phosphate-primed substrate specificity and autoinhibition . Cell.
2001; ; 105 : :721.–732. 9.
Mosesson
Y
,
Mills
GB
,
Yarden
Y
. Derailed endocytosis: an emerging feature of cancer . Nat Rev Cancer.
2008; ; 8 : :835.–850. 10.
Rocques
N
,
Abou Zeid
N
,
Sii-Felice
K
, et al.
GSK-3-mediated phosphorylation enhances Maf-transforming activity . Mol Cell.
2007; ; 28 : :584.–597. |