| |
| Med Sci (Paris). 2011 December; 27(12): 1061–1064. Published online 2011 December 23. doi: 10.1051/medsci/20112712008.La morphogenèse de l’enroulement intestinal Thierry Savin1* 1ETH Zürich, Department of Materials, 8093Zürich, Suisse MeSH keywords: Animaux, Phénomènes biophysiques, physiologie, Oiseaux, anatomie et histologie , embryologie, Plan d'organisation du corps, Embryon de poulet, Développement embryonnaire, Humains, Intestins, Souris, Modèles biologiques, Morphogenèse, Phénomènes physiques |
L’intestin est l’un des plus gros organes du corps humain, mais demeure l’un des moins étudiés par les biologistes [
1]. Le tube intestinal présente pourtant une architecture fascinante, nettement conditionnée par sa fonction, qui est assurée par un agencement de villosités et de courbures servant à maximiser la surface d’absorption des nutriments. Dans un article récemment publié dans la revue Nature [
2], nous avons étudié la morphogenèse des boucles intestinales. Une démarche interdisciplinaire en biologie et en physique, à la fois expérimentale et théorique, nous a permis de montrer que l’enroulement intestinal a pour origine un équilibre tissulaire de forces élastiques. Ces dernières sont générées par la croissance différentielle entre le tube intestinal et la membrane mésentérique qui le lie à l’abdomen. |
Développement de l’intestin Entre la conception et la naissance, le tube intestinal humain se développe pour atteindre plus de deux mètres de long, en formant un enroulement complexe à l’intérieur de l’abdomen. Pour les individus d’une même espèce de vertébrés, l’intestin moyen (ou intestin grêle) se développe de façon similaire et présente toujours la même structure de boucles. Dans les premiers instants de son développement, l’intestin est un tube droit, en bordure de l’embryon, qui croît plus rapidement que les tissus environnants. Il devient alors plus long que le tronc, et forme une première anse qui, en émergeant, vrille invariablement dans le sens antihoraire. Cette immuable chiralité est déclenchée par une asymétrie dans l’arrangement cellulaire du mésentère dorsal, un tissu initialement épais qui connecte l’intestin à la paroi abdominale [
3,
4]. Le mésentère s’affine par la suite jusqu’à devenir un feuillet épithélial de deux cellules d’épaisseur sans asymétrie apparente. Dans le même temps, l’intestin continue sa croissance en formant d’autres boucles tout en restant attaché sur toute sa longueur au mésentère, lui permettant ainsi de rester confiné dans la cavité abdominale. La
Figure 1
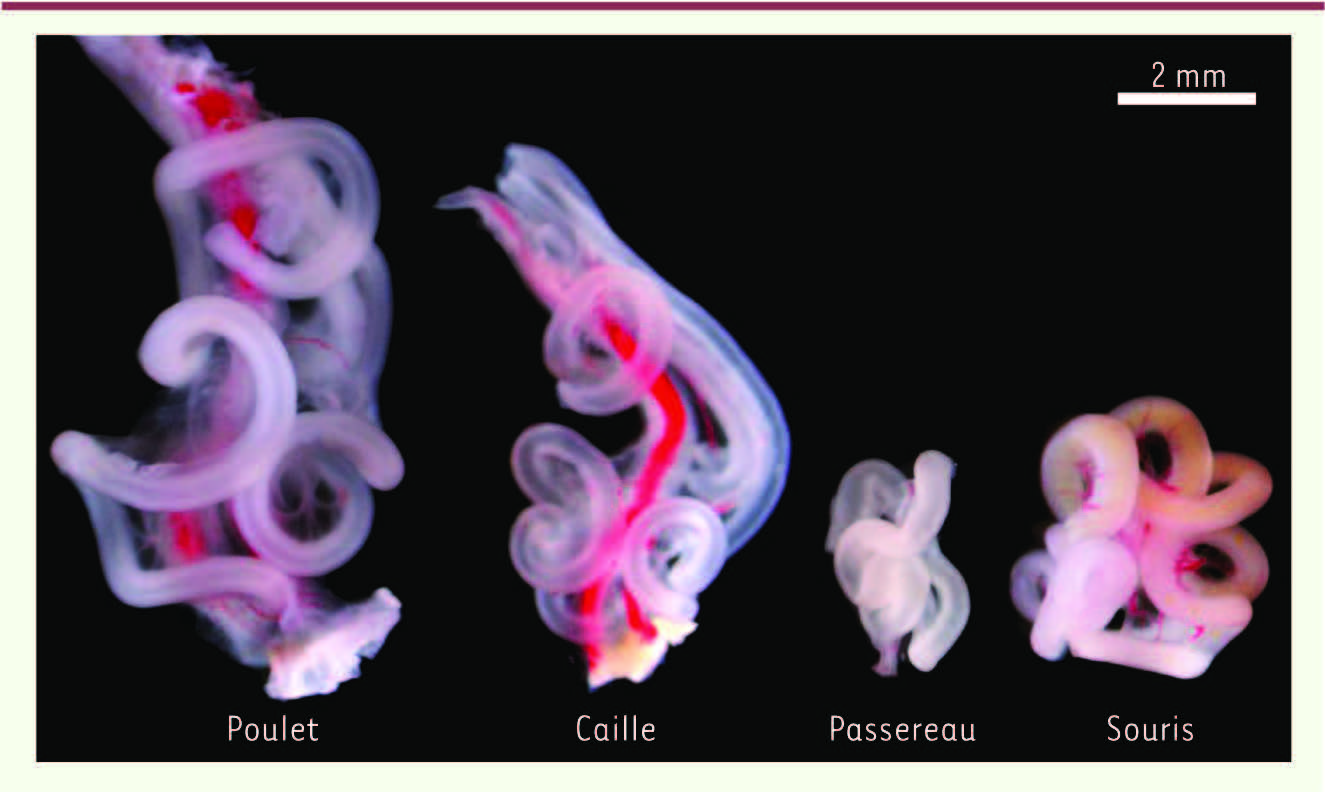
montre des exemples de l’enroulement intestinal pour quatre espèces différentes, et illustre la remarquable diversité dans la taille et la forme de cet organe, qui est souvent associée au régime alimentaire de l’animal. Jusqu’à présent, la morphogenèse de ces boucles était restée inexpliquée.
 | Figure 1.
Intestins embryonnaires de plusieurs espèces. De gauche à droite, les intestins de poulet, caille, passereau (diamant mandarin) et souris ont été disséqués à un temps intermédiaire de l’organogenèse. Le poulet et la caille sont tous deux des galliformes de la même famille, et les aspects très similaires de leur intestin témoignent de cette classification. Le diamant mandarin est un passériforme dont le tube intestinal est remarquablement différent de celui des deux autres oiseaux. La souris est ici utilisée comme modèle de mammifère. L’artère mésentérique supérieure, qui traverse le mésentère pour la vascularisation de l’intestin, est visible sur ces images. Elle peut être découpée pour déployer l’enroulement, comme le montre la
Figure 2
, afin de révéler la périodicité des boucles (images modifiées à partir de [ 2]). |
|
Rôle de la croissance différentielle Afin de comprendre l’organogenèse de l’intestin, nous avons d’abord testé plusieurs hypothèses à l’aide d’embryons de poulet. En premier lieu, cet enroulement pourrait provenir des contraintes spatiales de la cavité abdominale. Nous avons cependant pu écarter cette hypothèse, car les boucles restent intactes et identiques à leur structure in ovo lorsque l’intestin est dégagé de l’abdomen par dissection. Une seconde hypothèse, empruntant des idées classiques de la biologie du développement, suppose une prolifération cellulaire inhomogène dans le tube, ou dans le mésentère, aux endroits mêmes où l’intestin se courbe. Grâce à un marqueur mitotique, nous avons cependant mesuré que la croissance cellulaire est uniforme dans le tube, le long de son axe cranio-caudal ainsi que dans ses sections latérales. Un comptage mitotique effectué séparément dans le mésentère a également révélé une prolifération cellulaire uniforme. Cette observation disqualifie donc aussi une éventuelle croissance inhomogène du mésentère qui, à la manière d’un marionnettiste, agirait pour forcer la courbure de portions spécifiques du tube. En examinant nos mesures de prolifération, il nous est toutefois apparu que le tube croît plus rapidement que le mésentère. Ceci est très clairement apparu lorsque nous avons séparé le mésentère de l’intestin le long du tube avec des ciseaux de dissection : nous avons remarqué que le mésentère se rétracte, diminuant son périmètre d’un facteur 2 ou 3. Nous avons en outre observé que le tube, une fois isolé du mésentère, se déroule de lui-même et adopte une configuration linéaire. Ces tissus manifestent donc une réponse élastique aux déformations, et à cause d’un taux de croissance différent entre le tube intestinal et le tissu mésentérique auquel il est attaché, le tube est comprimé alors que le mésentère est sous tension. Ces observations suggèrent que les forces impliquées dans l’enroulement intestinal agissent à l’échelle du tissu. |
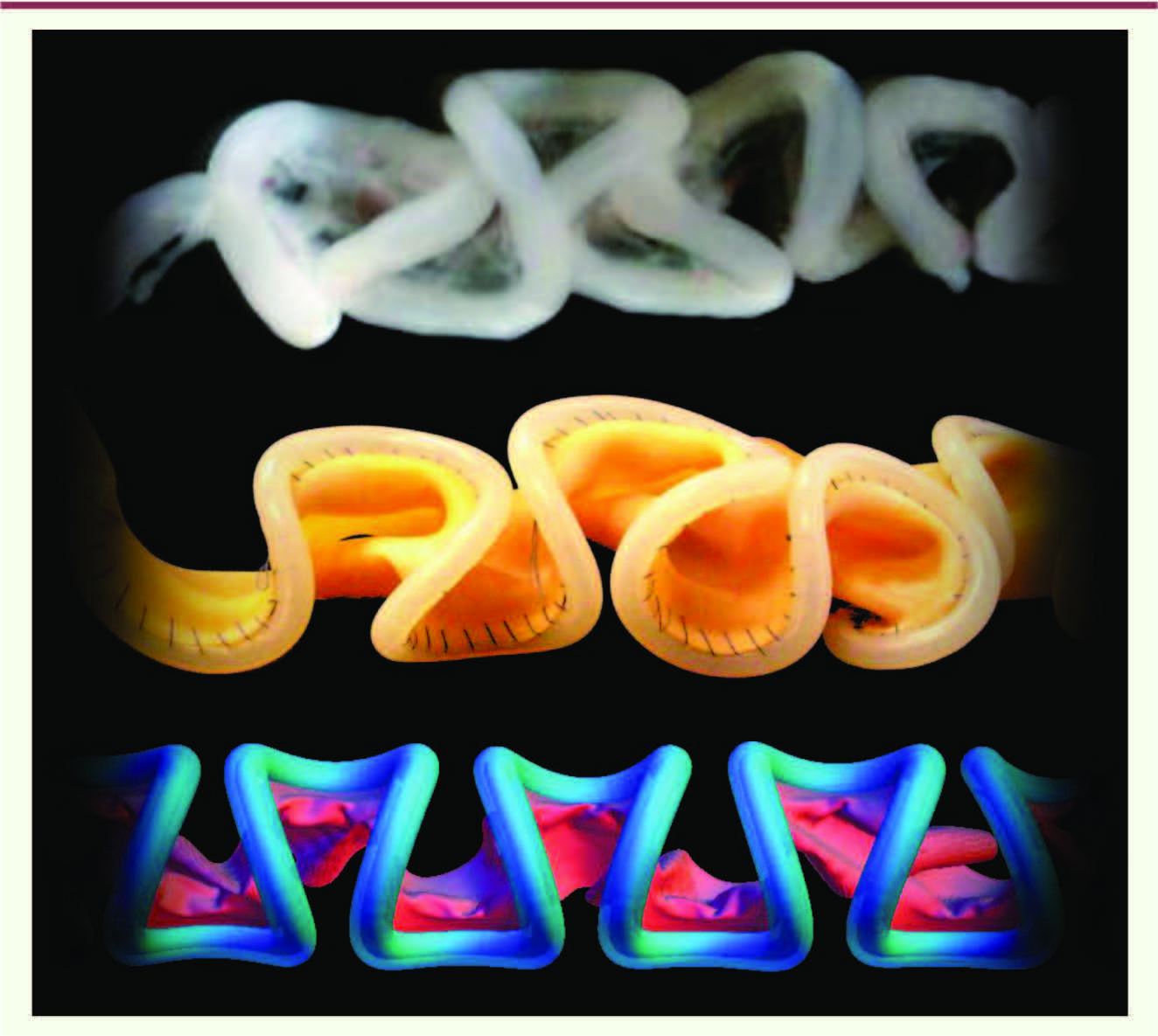
Nous avons alors créé une réplique du système composite tube-mésentère à l’aide d’une fine feuille élastique en latex et d’un tuyau flexible en silicone. Alors que la membrane était maintenue étirée jusqu’à deux fois sa longueur initiale, nous avons cousu le tuyau sur son bord. En relâchant la tension, nous avons observé la formation spontanée de boucles du tuyau se distribuant de façon régulière de part et d’autre de la membrane élastique. Comme le montre la
Figure 2
, l’apparence des boucles est de fait très similaire à celle observée dans l’intestin embryonnaire du poulet. Pour obtenir cette image de l’intestin, nous avons disséqué l’artère mésentérique supérieure, sans retirer le reste du mésentère, afin de mettre en évidence la remarquable périodicité dans l’enchaînement des boucles intestinales.
 | Figure 2.
Les différentes étapes de la modélisation de l’enroulement intestinal. La première image est celle de l’intestin de poulet, dont on a séparé l’artère mésentérique supérieure. Cette technique, qui conserve la structure des boucles (puisque le mésentère n’a pas été séparé du tube) permet de souligner la périodicité de l’enroulement. Chaque boucle a un rayon de l’ordre du millimètre. Au milieu, la réplique en latex (voir le texte) présente les mêmes formes que l’intestin, mais à des échelles 100 fois plus grandes. Cette concordance révèle le rôle essentiel des forces élastiques dans la morphogenèse de l’intestin. Enfin, le modèle numérique (en bas) nous a permis d’établir la théorie physique qui prédit la forme des boucles (dissection : A.E. Shyer ; modèle en latex : P. Florescu). |
|
D’avoir ainsi identifié le contexte mécanique pour la formation de l’enroulement nous a aidé à élaborer un modèle théorique et une simulation numérique qui prédisent la géométrie des boucles. La méthode numérique avait déjà été exploitée pour montrer comment la croissance différentielle induisait les ondulations visibles sur les bords des feuilles d’arbres ou des pétales de fleurs [
5,
6]. Grâce à notre modèle, il suffit alors de connaître les paramètres élastiques et morphologiques du tube intestinal et du mésentère (ou du tuyau et de la feuille de latex), ainsi que leurs taux de croissance relative (ou l’étirement initial de la feuille de latex), pour déterminer le rayon des boucles et leur nombre dans l’intestin. Afin de valider nos prédictions, nous avons mesuré les paramètres de notre modèle sur les tissus biologiques de poulet à plusieurs stades du développement embryonnaire. En particulier, les modules d’élasticité du tube et du mésentère ont pu être évalués à l’aide d’une nouvelle technique de « pinces magnétiques » spécialement élaborée pour ce type de biomatériaux. Nous avons alors comparé la forme, la taille et le nombre de boucles prédits par notre modèle avec des mesures directes sur l’intestin embryonnaire de poulet, à différentes étapes de son développement. Nous avons trouvé que notre modèle physique permet effectivement de décrire les diverses formes et dimensions d’enroulement adoptées par l’intestin au cours de sa genèse. Nous avons déjà mentionné que l’intestin peut différer d’une espèce à l’autre. Sur la
Figure 1
, les tubes intestinaux de poulet et de caille ont une forme semblable à des stades de développement comparables, même si leur taille diffère. En revanche, l’intestin du passereau est beaucoup plus condensé avec des boucles relativement petites, malgré un diamètre de tube similaire à celui du tube des deux autres espèces d’oiseaux. Enfin chez la souris, les boucles de l’intestin sont plus amples, mais très rapprochées. Nous avons répété nos mesures biophysiques des paramètres élastiques et morphologiques sur les tissus intestinaux de ces trois animaux supplémentaires. Nous avons alors comparé les simulations utilisant ces paramètres avec les observations expérimentales des trois animaux, pour finalement montrer que notre modèle physique explique également la diversité de la morphologie intestinale entre différentes espèces. |
Du point de vue de la physique, nous pouvons noter que le mécanisme décrit ici est particulièrement efficace pour induire le confinement de l’intestin dans l’abdomen, tout en assurant au tube une vascularisation portée par le mésentère. Mais ce mécanisme garantit aussi un enroulement régulier et continu, sans plier ou tordre (et donc obstruer) le tube lors de sa croissance. En ayant identifié et compris ce mécanisme, nous sommes plus à même de comprendre certaines anomalies congénitales, comme la malrotation intestinale qui touche près d’un nouveau-né sur cinq cents, ou de prédire l’occurrence de pathologies similaires, telles que le volvulus, qui peuvent apparaître chez l’adulte. Notre modèle montre de façon quantitative comment la modification de paramètres biophysiques, comme le taux de croissance relative ou l’élasticité des tissus, peut altérer la forme du tube intestinal. Ainsi, l’approche physique permet d’isoler un petit nombre de propriétés sur lesquelles la sélection naturelle a pu agir pour faire évoluer l’organe à travers les espèces. Des morphologies d’intestin très différentes peuvent en effet être observées dans d’autres espèces qui n’ont pas été abordées dans notre étude. Par exemple chez l’amphibien Xenopus, le tube forme une spirale d’une remarquable régularité [
7], et il semble raisonnable de penser que le mécanisme physique décrit dans notre étude s’applique également dans ce cas. En fait, il nous reste à étudier plus ouvertement toutes les morphologies possibles auxquelles peuvent conduire la croissance différentielle et autres contraintes mécaniques soulignées dans notre étude. La méthodologie employée ici s’inspire clairement de celle élaborée par D’Arcy Thompson, le célèbre biomathématicien du début du XXe siècle et auteur de l’éminent On growth and form [
8]. Ce livre sans précédent illustre le rôle prépondérant des forces mécaniques et des mathématiques dans notre compréhension de la morphogenèse des organismes vivants. Les méthodes qu’il expose, fondées sur des analogies physiques et des transformations géométriques, contrastent singulièrement avec les techniques moléculaires et génétiques prédominantes dans les études qui ont cours en biologie du développement. Pourtant, l’approche de D’Arcy Thompson est bel et bien d’actualité, et il est fort probable qu’elle ouvre la porte à une plus large compréhension de la morphogenèse d’autres organes. Un effort conjoint doit être effectué pour déterminer à la fois les propriétés biophysiques qui contrôlent la morphogenèse et la signalisation moléculaire qui régit ces propriétés au niveau cellulaire. Conflits d’intérêts
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
L’auteur remercie Jérôme Flakowski, Anne-Ruxandra Carvunis, Daphne Warlamis, Romain Koszul, Guillaume Adelmant, Monique Savin et Michel Savin pour leurs commentaires sur ce manuscrit.
|
1.
Stainier
DYR
. No organ left behin: tales of gut development and evolution . Science.
2005; ; 307 : :1902.–1904. 2.
Savin
T
,
Kurpios
NA
,
Shyer
AE
, et al.
On the growth and form of the gut . Nature.
2011; ; 476 : :57.–62. 3.
Davis
NM
,
Kurpios
NA
,
Sun
X
, et al.
The chirality of gut rotation derives from left-right asymmetric changes in the architecture of the dorsal mesentery . Dev Cell.
2008; ; 15 : :134.–145. 4.
Kurpios
NA
,
Ibañes
M
,
Davis
NM
, et al.
The direction of gut looping is established by changes in the extracellular matrix and in cell:cell adhesion . Proc Natl Acad Sci USA.
2008; ; 105 : :8499.–8506. 5.
Liang
H
,
Mahadevan
L
. The shape of a long leaf . Proc Natl Acad Sci USA.
2009; ; 106 : :22049.–22054. 6.
Liang
H
,
Mahadevan
L
. Growth, geometry and mechanics of the blooming lily . Proc Natl Acad Sci USA.
2011; ; 108 : :5516.–5521. 7.
Schreiber
AM
,
Cai
L
,
Brown
DD
. Remodeling of the intestine during metamorphosis of Xenopus laevis
. Proc Natl Acad Sci USA.
2005; ; 102 : :3720.–3725. 8.
Thompson
DW
. On growth and form . Cambridge: : Cambridge University Press; , 1917 ; :794. p. |