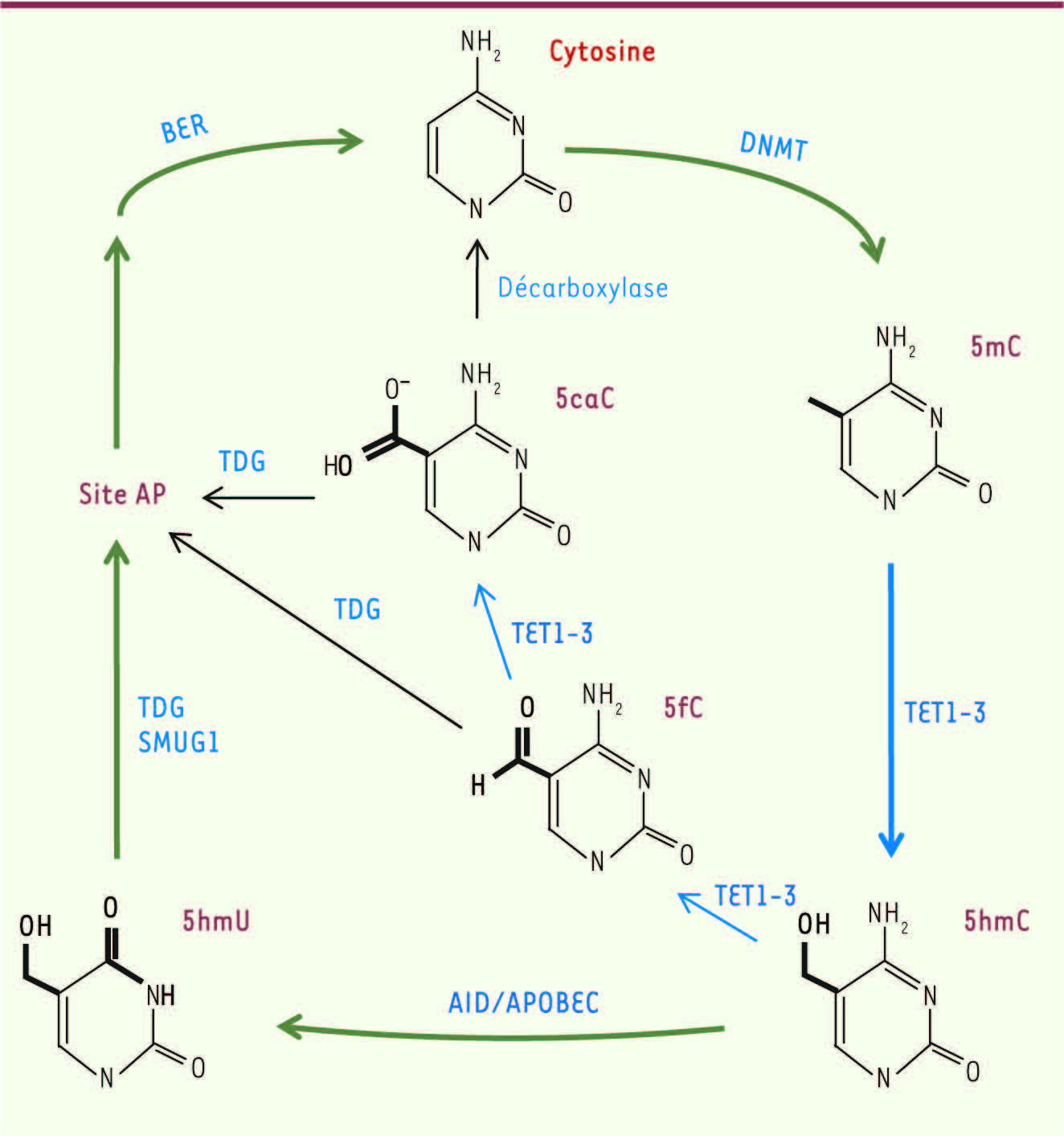
Le gène ten-eleven-translocation (TET) 2 fait partie d’une famille de trois gènes codant pour des oxygénases dépendantes du Fe++ et du 2-oxoglutarate. Les trois protéines, TET1, TET2 et TET3, sont capables d’oxyder les cytosines méthylées (5mC) en hydroxyméthylcytosines (5hmC) ainsi qu’en 5-formylcytosines (5fC) et 5-carboxylcytosines (5caC) [ 1– 4] (Figure 1). Ces cytosines modifiées peuvent à leur tour être modifiées par des glycosylases ou par des désaminases. Le système de réparation par excision de base, base excision repair (BER), interviendrait ensuite pour réintroduire une cytosine non méthylée [ 5]. L’oxydation des méthylcytosines par les facteurs TET semble donc constituer une étape vers leur déméthylation active. De plus, les 5hmC pourraient posséder une fonction propre [ 6], et TET1 elle-même pourrait réguler la transcription indépendamment des 5hmC [ 7].
| Figure 1
Mécanisme proposé de déméthylation active. La 5-hydroxyméthylcytosine (5hmC) est produite à partir de 5-méthylcytosine (5mC) par les oxygénases de la famille TET. Les 5hmC peuvent ensuite être déaminées par les enzymes de la famille AID/APOBEC (activation-induced deaminase), générant des 5-hydroxyméthyluracyl (5hmU), qui sont ensuite excisées par la thymine-DNA glycosylase (TDG) ou d’autres ADN glycosylases, telles que SMUG1 (single-strand selective monofunctional uracil DNA glycosylase). Le système de base excision repair (BER) réintroduit une cytosine non méthylée qui pourra à son tour être méthylée par les ADN méthylases de la famille DNMT. Alternativement, la réaction d’oxydation par les enzymes TET peut se poursuivre générant des 5-formylcytosines (5fC) et des 5-carboxylcytosines (5caC) qui sont alors directement reconnues par la TDG. Les 5caC pourraient être converties en cytosines par une décarboxylase restant à identifier. |
Des mutations acquises du gène TET2 ont d’abord été décrites dans les hémopathies malignes humaines de type myéloïde [ 8]. Elles sont observées dans tous ces sous-types d’hémopathies, avec une fréquence variable atteignant 50 % dans les échantillons de LMMC (leucémies myélomonocytaires chroniques). Ces mutations sont principalement des insertions ou des délétions de petite taille, entraînant des sauts de phase, et des mutations ponctuelles non-sens créant des codons stop. Des mutations faux-sens qui touchent des acides aminés conservés dans l’évolution ont également été décrites (Figure 2). Dans l’ensemble, ces résultats suggèrent que TET2 est un gène de type suppresseur de tumeurs et que les mutations observées dans les hémopathies conduisent à une perte de fonction de la protéine. La présence de deux mutations, indiquant l’atteinte des deux copies du gène TET2, n’est détectée que chez une partie des patients, suggérant un effet d’une inactivation hétérozygote (haplo-insuffisance).
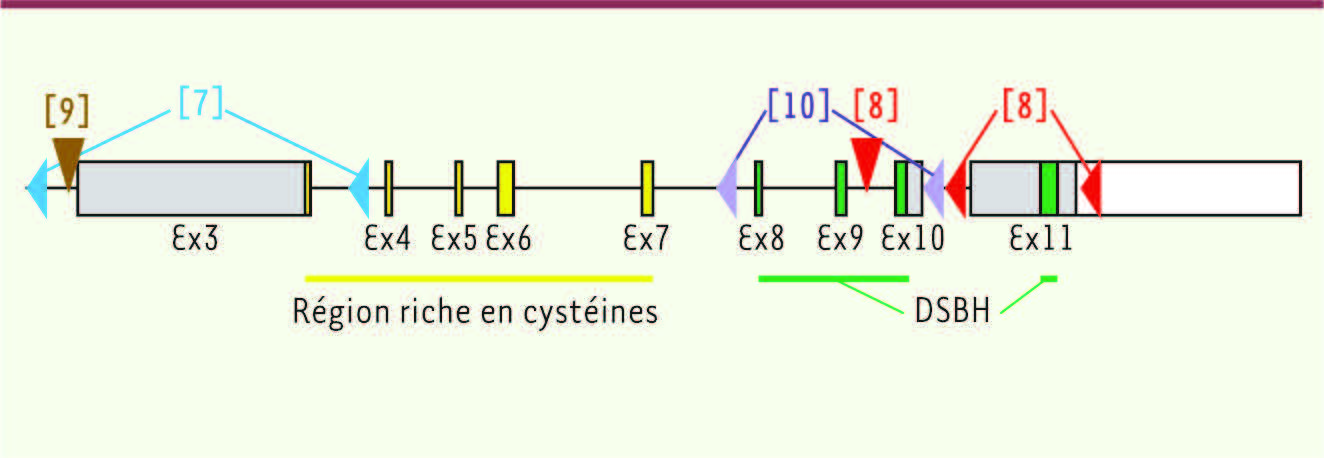
| Figure 2
Représentation de la structure du gène Tet2. Les régions ciblées dans les différents modèles d’invalidation chez la souris sont indiquées. Les têtes de flèches horizontales indiquent les sites LoxP. Les flèches verticales indiquent les sites d’insertion des cassettes gene trap. La protéine TET2 comprend deux domaines conservés dans l’évolution : une région riche en cystéines en jaune et le domaine catalytique DSBH (double strand β helix) en vert. |
Pour étudier la fonction de Tet2, quatre groupes ont généré des lignées de souris invalidées pour Tet2 chez lesquelles le gène peut être éteint de façon conditionnelle [ 9– 12]. Les souris porteuses de mutations homozygotes de Tet2 transmises de façon germinale sont viables et leur phénotype est semblable à celles qui présentent une inactivation somatique du gène. L’invalidation de Tet2 entraîne une baisse du niveau global de 5hmC dans les cellules hématopoïétiques. Toutes les publications décrivent un phénotype similaire d’amplification des populations hématopoïétiques immatures (cellules souches et progéniteurs multipotents) ainsi que des anomalies de différenciation des lignées myéloïdes, mais aussi lymphoïdes B et T. Ces anomalies sont intrinsèques puisqu’elles sont observées chez des souris sauvages syngéniques greffées avec de la moelle osseuse de souris invalidées pour Tet2, et que des anomalies de différenciation des progéniteurs sont observées également dans des tests in vitro. De plus, les cellules invalidées pour Tet2 présentent un avantage compétitif par rapport aux cellules sauvages dans des expériences de greffe de moelle, aussi bien à partir de moelle totale que de cellules médullaires immatures (isolées sur leur phénotype LSK : lineage -Sca1+ cKit+).
Dans la plupart des modèles, l’invalidation de Tet2 entraîne, chez une fraction des souris, le développement de maladies malignes ressemblant à une leucémie myélomonocytaire chronique humaine (monocytose persistante, splénomégalie, moins de 20 % de blastes dans le sang ou la moelle osseuse, dysplasie de plusieurs lignées myéloïdes). La latence du développement de ces tumeurs suggère que d’autres événements oncogéniques coopérant avec l’anomalie intiale sont nécessaires au développement tumoral.
Des anomalies équivalentes sont observées chez les souris hétérozygotes pour l’allèle Tet2 invalidé et chez des souris portant un allèle hypomorphe du gène.
L’observation d’anomalies de la différenciation lymphoïde chez les souris déficientes pour Tet2 [ 10] ainsi que la présence de lymphomes concomitants des pathologies myéloïdes chez les premiers patients chez lesquels nous avions analysés le gène TET2 [ 13] nous ont poussés à analyser la séquence de TET2 dans les proliférations lymphoïdes matures humaines. Nous avons pu observer des mutations de la séquence codante de TET2 dans 2 % des lymphomes de type B et 12 % des lymphomes de type T. La fréquence des anomalies de TET2 s’élève à 30 % dans les lymphomes angio-immunoblastiques de type T. Les types d’anomalies de TET2 observées dans les lymphomes T sont semblables à ceux qui sont observés dans les hémopathies myéloïdes. De plus, chez certains patients, les mutations observées dans les cellules lymphomateuses ont également été identifiées dans des cellules hématopoïétiques immatures, exprimant l’antigène CD34 et capables de se différencier vers les lignées myéloïdes. Ces données indiquent que les anomalies de TET2 peuvent survenir dans une cellule à potentialité lymphoïde et myéloïde, voire une cellule souche hématopoïétique, et entraîner le développement aussi bien d’hémopathies myéloïdes que lymphoïdes.
Le gène TET2 est donc bien un gène de type suppresseur de tumeur. Des variations, même faibles, de l’activité ou de l’expression de TET2 confèrent aux cellules hématopoïétiques un avantage compétitif vis-à-vis des cellules sauvages. Elles provoquent des anomalies de l’hématopoïèse mais n’entraînent pas directement la transformation cellulaire. Le développement d’hémopathies malignes myéloïdes ou lymphoïdes résulterait plutôt de la survenue d’autres mutations. Ces deux types de pathologies pourraient donc se développer à partir d’une même atteinte du compartiment des cellules souches hématopoïétiques.