| |
| Med Sci (Paris). 2011 December; 27(12): 1075–1077. Published online 2011 December 23. doi: 10.1051/medsci/20112712013.La biogenèse des autophagosomes perd de son mystère Kévin Moreau1* 1Department of Medical Genetics, Cambridge Institute for Medical Research, Wellcome Trust/MRC Building, Addenbrooke’s Hospital, Hills Road, Cambridge, CB2 2XY, Royaume-Uni MeSH keywords: Vieillissement, métabolisme, physiologie, Autophagie, Maladie, étiologie, Homéostasie, génétique, Humains, Immunité cellulaire, Modèles biologiques, Phagosomes, Vésicules de transport, Protéines du transport vésiculaire |
Autophagie : une voie de dégradation au cœur de l’homéostasie intracellulaire Si vous avez déjà participé à des conférences sur l’autophagie ou si vous êtes intéressé par cette voie intracellulaire, vous vous êtes certainement posé ces deux questions :
-
D’où viennent les membranes nécessaires à la formation des autophagosomes ?
-
Comment les « précurseurs autophagiques » génèrent-ils des autophagosomes ?
Avant de répondre à ces deux questions, il est nécessaire de faire un petit retour en arrière. L’autophagie, du grec αυτο (soi-même) et φαγειν (manger), est un processus de dégradation de matériel intracellulaire (cytoplasme et organites principalement) qui existe dans les cellules eucaryotes et est activé en réponse à différentes conditions de stress [
1]. Identifié il y a plus de 40 ans par Christian de Duve lors de la découverte des lysosomes qui lui vaudra le prix Nobel de médecine (1974), ce phénomène a été nommé « autophagie » à la suite d’observations obtenues en microscopie électronique : des vésicules, les autophagosomes, formées de une ou deux membranes renfermant une partie du cytoplasme et/ou des organites intracellulaires en voie de dégradation [
2]. De nombreuses études ont maintenant mis en évidence un rôle important de l’autophagie en pathologie humaine, dans certaines maladies neurodégénératives (Alzheimer, Parkinson, chorée de Huntington) [
3], certains cancers ou encore des infections [
4,
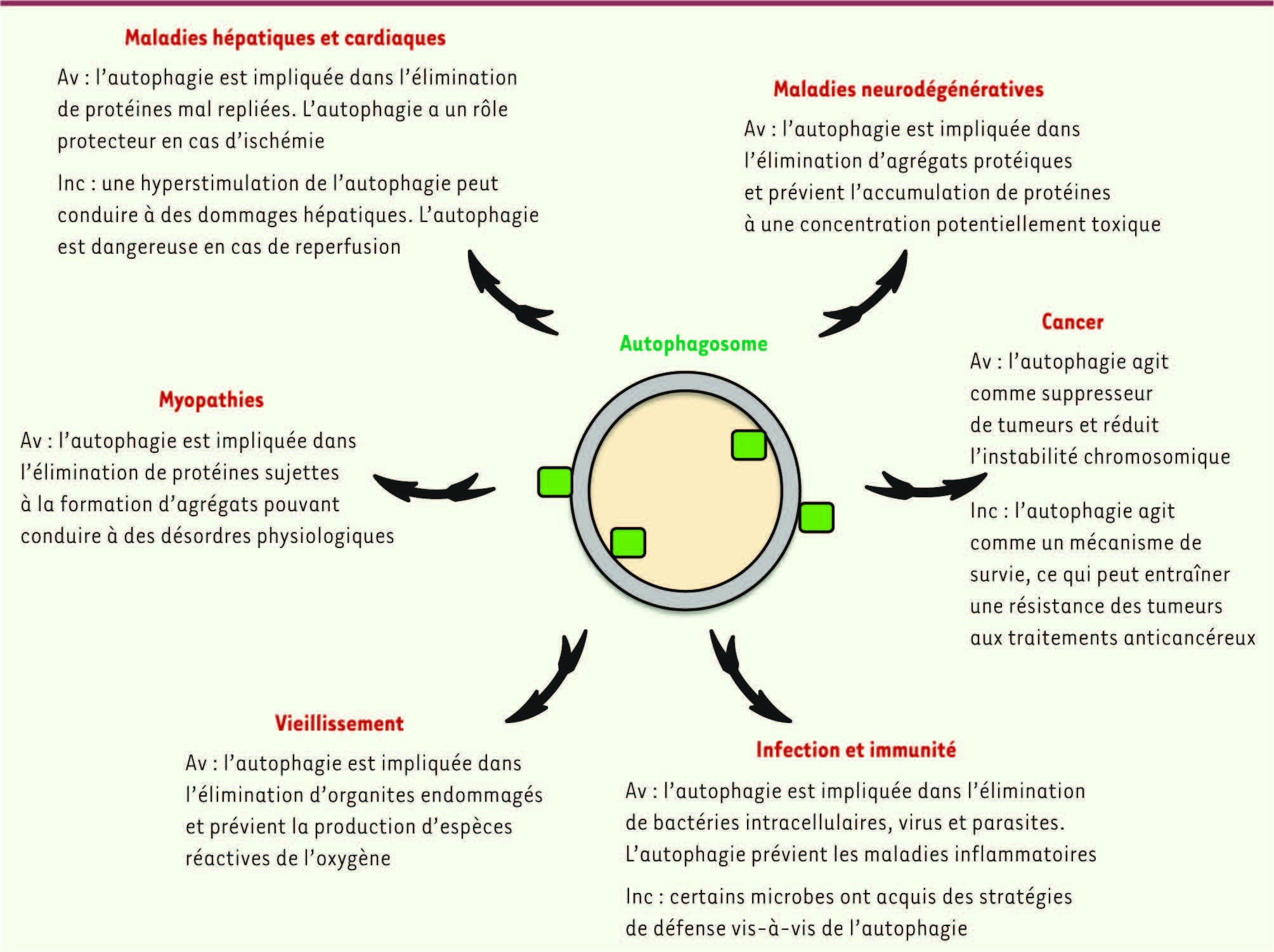
5], des myopathies, des maladies cardiaques et hépatiques, ainsi qu’au cours du vieillissement (Figure 1) [
6].
 | Figure 1
Implication de processus d’autophagie au cours des pathologies humaines. Av : avantages ; Inc : inconvénients. |
|
Le ballet bien orchestré des protéines Atg L’analyse de l’autophagie chez la levure a permis une avancée considérable dans la compréhension des mécanismes moléculaires mis en jeu dans la formation des autophagosomes en identifiant les gènes ATG (autophagy related genes) [
7]. La découverte de ces gènes dans les années 1990 a été le point de départ d’un nombre important de recherches sur la formation des autophagosomes. La première étape de la formation des autophagosomes se déroule au niveau d’une structure préautophagosomale (PAS) encore appelée phagophore [6]. L’élongation du phagophore permet la formation d’un autophagosome complet. Ce mécanisme fait intervenir deux systèmes de conjugaison similaires à celui de l’ubiquitinylation. Le premier système aboutit à la conjugaison de l’Atg12 à l’Atg5, puis à leur association à l’Atg16L1 dans un complexe macromoléculaire. Le deuxième système aboutit à la conjugaison de la phosphatidyléthalonamine (PE) à l’Atg8 (LC3-I). Le complexe Atg12-Atg5-Atg16L1 est associé au phagophore, auquel s’associe par la suite la protéine LC3. Le complexe Atg12-Atg5-Atg16L1 se dissocie ensuite de l’autophagosome ainsi formé tandis que la protéine LC3 conjuguée au PE (LC3-II) reste associée à l’autophagosome. Ceci explique que cette protéine soit un excellent marqueur de cette structure [6]. |
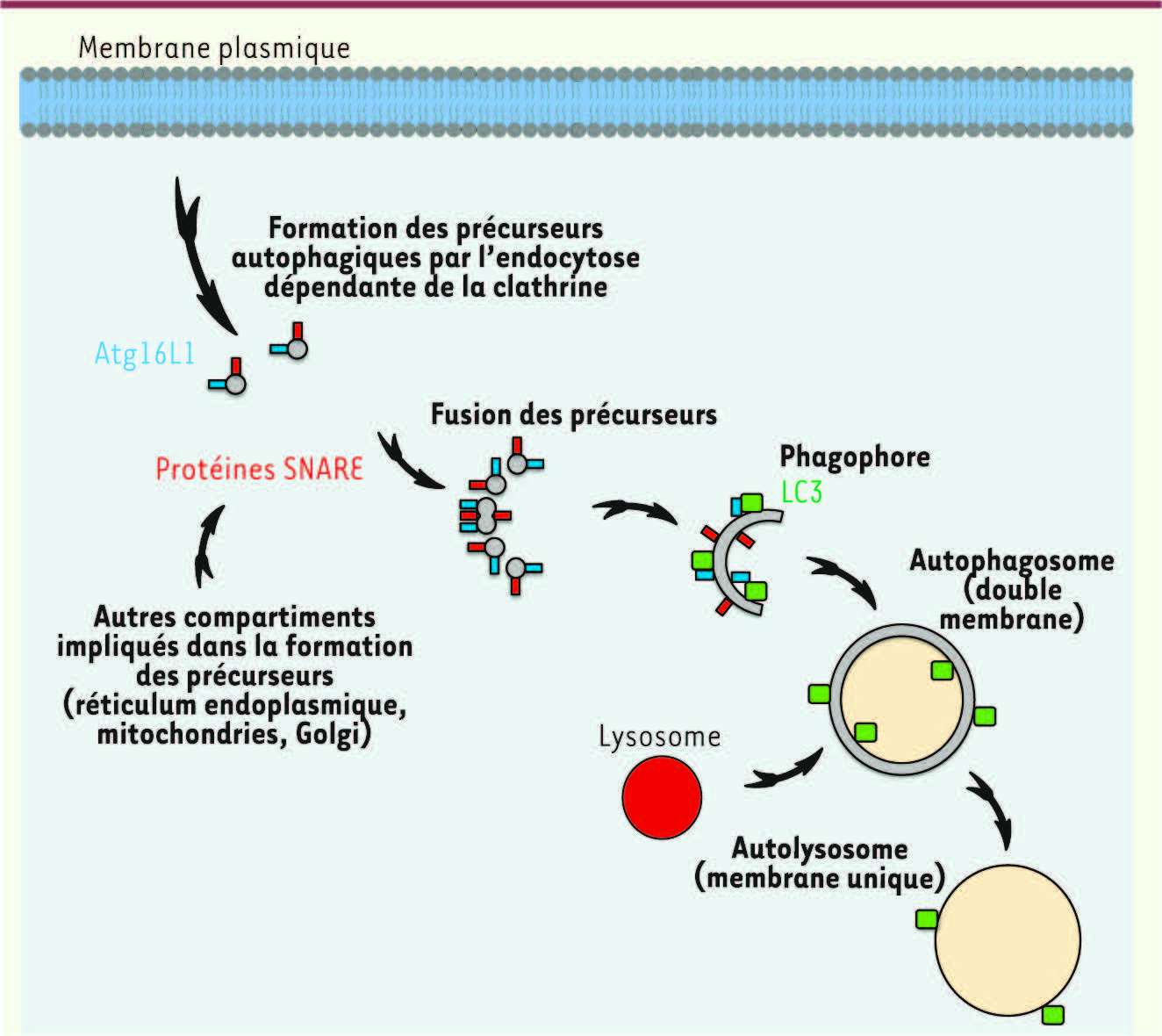
L’origine mystérieuse du phagophore L’origine du phagophore est l’objet d’intenses débats depuis de nombreuses années dans la communauté des scientifiques s’intéressant à l’autophagie. Plusieurs théories ont été avancées, de la formation de novo à partir de lipides jusqu’à l’hypothèse de l’existence d’organites donneurs de membranes nécessaires à la formation et à l’élongation du phagophore. Les années 2009 et 2010 ont été marquées par la publication de nombreux articles relatifs à ce sujet. Plusieurs groupes ont démontré un rôle du réticulum endoplasmique, de l’appareil de Golgi et des mitochondries dans la formation des autophagosomes [
8–
12], et nous avons identifié la membrane plasmique comme une source de membrane nécessaire à la formation du phagophore [
13]. Ce mécanisme fait intervenir l’endocytose dépendante de la clathrine et l’interaction de la protéine Atg16L1 avec la clathrine, conduisant à la formation d’une vésicule que nous avons appelée « précurseur autophagique » parce qu’elle précède la formation du phagophore (Figure 2) [13]. Il est possible que différents compartiments participent à la formation des autophagosomes en fonction des stimulus appliqués. Lorsque les cellules sont soumises à des conditions de carence en nutriments, la formation des autophagosomes peut se faire à partir de membranes provenant des mitochondries et du réticulum endoplasmique. Dans d’autres conditions (carence en nutriments, certains traitements par des drogues) et en conditions normales (absence de carence), la membrane plasmique peut participer à la formation des autophagosomes.
 | Figure 2
Modèle de formation des autophagosomes. La fusion des précurseurs autophagiques provenant de la membrane plasmique ou d’autres compartiments intracellulaires conduit à la formation du phagophore suite à l’acquisition de la protéine LC3, et à la formation d’un autophagosome lorsque l’Atg16L1 se dissocie de cette vésicule. L’autophagosome fusionne ensuite avec un lysosome pour former un autolysosome, une vésicule à une seule membrane dans laquelle le contenu est dégradé. |
|
Le phagophore qui veut se faire aussi gros que l’autophagosome À la suite de cette première publication, nous nous sommes intéressés à la deuxième question : comment le phagophore devientil un autophagosome sachant que sa taille est environ dix fois inférieure à celle d’un autophagosome (environ 1 μm) ? Nous avons fait l’hypothèse d’un rôle des protéines SNARE (soluble N-ethylmaleimide-sensitive factor attachment protein receptor) - impliquées dans la fusion membranaire - dans la maturation du phagophore. Nous avons observé que les précurseurs autophagiques sont capables de fusionner entre eux in vitro et in vivo [
14]. La fusion homotypique des précurseurs permet leur croissance et l’acquisition de la protéine LC3, formant ainsi le phagophore puis un autophagosome (Figure 2). Ce mécanisme fait intervenir en particulier les protéines SNARE suivantes : VAMP7 (vesicle-associated membrane protein 7 ou synaptobrevin-like gene 1 protein), syntaxine 7 et syntaxine 8. VAMP7 provient en partie de la membrane plasmique, car l’inhibition de l’endocytose de VAMP7 par la déplétion de son adaptateur spécifique à la membrane plasmique, Hrb (human immunodeficiency virus Rev binding protein), inhibe la maturation des précurseurs autophagiques vers le phagophore. Dans le même numéro de Cell paraît un article de U. Nair et al. qui ont également identifié un rôle des protéines SNARE dans la formation des autophagosomes mais cette fois chez la levure [
15]. Les auteurs ont observé un rôle des SNARE dans le trafic intracellulaire de la protéine Atg9, importante pour l’autophagie mais dont le rôle spécifique reste encore flou. Il a été avancé que Atg9 servirait de transporteur de lipides nécessaire à la formation des autophagosomes. Ces articles récents ont permis de mieux comprendre la formation des autophagosomes grâce à l’étude de leurs précurseurs qui reste aujourd’hui encore peu explorée. En effet, le groupe de D.J. Klionsky a récemment pointé le besoin urgent d’une telle étude. Les articles parus au cours de ces 20 dernières années sur l’autophagie étaient consacrés pour la plupart à l’étude de la protéine LC3. Or cette protéine n’est présente qu’aux étapes finales de la formation des autophagosomes. La découverte des précurseurs autophagiques et le processus de leur maturation marquent une nouvelle étape dans la compréhension des mécanismes de formation des autophagosomes. Lorsque l’on veut définir le rôle d’une protéine dans l’autophagie, il est maintenant nécessaire de l’étudier à toutes les étapes nécessaires à la création d’un autophagosome. Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Mizushima
N
,
Levine
B
,
Cuervo
AM
,
Klionsky
DJ
. Autophagy fights disease through cellular selfdigestion . Nature.
2008; ; 451 : :1069.–1075. 2.
De Duve
C
,
Wattiaux
R
. Functions of lysosomes . Annu Rev Physiol.
1966; ; 28 : :435.–492. 3.
Puyal
J
,
Ginet
V
,
Vaslin
A
, et al.
Les deux visages de l’autophagie dans le système nerveux . Med Sci (Paris).
2009; ; 25 : :383.–390. 4.
Joubert
PE
,
Pombo Grégoire
I
,
Meiffren
G
, et al.
Autophagie et pathogènes : Bon appétit Messieurs ! . Med Sci (Paris).
2011; ; 27 : :41.–47. 5.
Le Roux
D
,
Niedergang
F
. Autophagie et microorganismes . Med Sci (Paris).
2010; ; 26 : :534.–537. 6.
Ravikumar
B
,
Sarkar
S
,
Davies
JE
, et al.
Regulation of mammalian autophagy in physiology and pathophysiology . Physiol Rev.
2010; ; 90 : :1383.–1435. 7.
Codogno
P
. Les gènes ATG et la macro-autophagie . Med Sci (Paris).
2004; ; 20 : :734.–736. 8.
Yla-Anttila
P
,
Vihinen
H
,
Jokitalo
E
,
Eskelinen
EL
. 3D tomography reveals connections between the phagophore and endoplasmic reticulum . Autophagy.
2009; ; 5 : :1180.–1185. 9.
Yen
WL
,
Shintani
T
,
Nair
U
, et al.
The conserved oligomeric Golgi complex is involved in doublemembrane vesicle formation during autophagy . J Cell Biol.
2010; ; 188 : :101.–114. 10.
Van der Vaart
A
,
Griffith
J
,
Reggiori
F
. Exit from the Golgi is required for the expansion of the autophagosomal phagophore in yeast.
Saccharomyces cerevisiae. Mol Biol Cell.
2010; ; 21 : :2270.–2284. 11.
Hayashi-Nishino
M
,
Fujita
N
,
Noda
T
, et al.
Electron tomography reveals the endoplasmic reticulum as a membrane source for autophagosome formation . Autophagy.
2009; ; 6 : :301.–303. 12.
Hailey
DW
,
Rambold
AS
,
Satpute-Krishnan
P
, et al.
Mitochondria supply membranes for autophagosome biogenesis during starvation . Cell.
2010; ; 141 : :656.–667. 13.
Ravikumar
B
,
Moreau
K
,
Jahreiss
L
, et al.
Plasma membrane contributes to the formation of preautophagosomal structures . Nat Cell Biol.
2010; ; 12 : :747.–757. 14.
Moreau
K
,
Ravikumar
B
,
Renna
M
, et al.
Autophagosome precursor maturation requires homotypic fusion . Cell.
2011; ; 146 : :303.–317. 15.
Nair
U
,
Jotwani
A
,
Geng
J
, et al.
SNARE proteins are required for macroautophagy . Cell.
2011; ; 146 : :290.–302. |