| |
| Med Sci (Paris). 2011 August; 27(8-9): 698–700. Published online 2011 August 31. doi: 10.1051/medsci/2011278007.Quand TIF1γ devient chef d’orchestre de l’hématopoïèse adulte Sophie Kusy1 and Paul-Henri Roméo2* 1Department of Pediatrics, Stanford University School of Medecine, Stanford, CA, États-Unis 2Institut de radiobiologie cellulaire et moléculaire, UMR967 Inserm/Université Paris 7 et Paris 11, CEA, 18, route du Panorama, 92260Fontenay-aux-Roses, France MeSH keywords: Animaux, Lignée cellulaire, Lignage cellulaire, Régulation de l'expression des gènes au cours du développement, génétique, physiologie, Hématopoïèse, Cellules souches hématopoïétiques, classification, métabolisme, Humains, Souris, Modèles biologiques, Facteurs de transcription, déficit, Transcription génétique, Danio zébré, embryologie, Protéines de poisson-zèbre |
L’hématopoïèse est initiée à partir de cellules souches hématopoïétiques (CSH) présentes dans la moelle osseuse et aboutit à la production continue et finement régulée des cellules sanguines érythroïdes, plaquettaires, myéloïdes et lymphoïdes. Les CSH restent quiescentes, meurent, s’autorenouvellent et/ou se déterminent dans des structures spécialisées de la moelle osseuse, appelées niches. Ces destins sont régulés par des facteurs intracellulaires (essentiellement des facteurs de transcription) et/ou extracellulaires (molécules d’adhésion et facteurs solubles). La plupart des voies de signalisation activées par les facteurs extracellulaires aboutissent à la translocation de facteurs de transcription dans le noyau de la cellule. Ces facteurs de transcription interagissent alors avec d’autres régulateurs de la transcription, ubiquistes ou spécifiques de l’hématopoïèse, assurant ainsi le devenir des CSH. Les processus qui permettent l’engagement des CSH vers une voie de maturation ou vers une autre, en fonction des besoins de l’organisme, commencent à être identifiés et de nombreux travaux ont pour objectif d’identifier les facteurs de transcription nécessaires à l’homéostasie de l’hématopoïèse.
 | Figure 1.
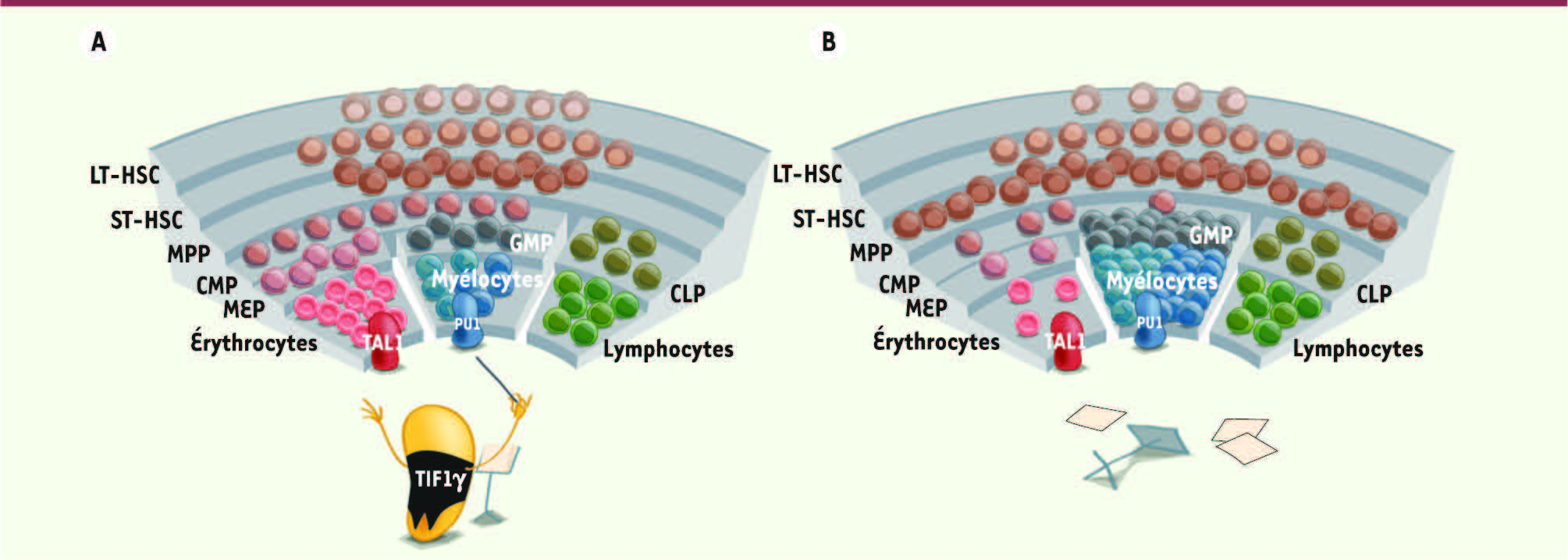
Schématisation de la fonction de TIF1γ dans l’hématopoïèse. Durant l’hématopoïèse, TIF1γ joue un rôle de chef d’orchestre en coordonnant le maintien et l’équilibre des différentes populations de cellules souches, érythroïdes et myéloïdes. Il régule les activités des facteurs de transcription TAL1 et PU.1, orientant ainsi un processus de différenciation des stades de CSH jusqu’aux cellules hématopoïétiques matures (A). En l’absence de TIF1γ (B), les activités transcriptionnelles de TAL1 et PU.1 ne sont plus régulées et l’homéostasie du système hématopoïétique est perdue. Il en résulte une absence de régulation de la production des différentes populations hématopoïétiques, caractérisée par une diminution du nombre de CSH et une augmentation du nombre de cellules myéloïdes au détriment des cellules érythroïdes. LT-HSC : long-term hematopoietic stem cell ; ST-HSC : short-term hematopoietic stem cell ; MPP : multipotent progenitor ; CMP : common myeloid progenitor ; CLP : common lymphoid progenitor ; GMP : granulocyte-monocyte progenitor. MEP : megakaryocyte-erythroid progenitor (illustration réalisée par Antoine Deschamps, PDI, 1800 Seaport Boulevard, Redwood City, CA, 94063 USA, aaaak-tonio@hotmail.com). |
|
TIF1γ, TGF-β, transcription et hématopoïèse Le mutant moonshine du poisson zèbre se caractérise par une absence complète de globules rouges circulants chez l’embryon, conséquence d’une apoptose des progéniteurs érythroïdes. Cela indique que le produit du gène moonshine est requis pour le développement normal et la survie des progéniteurs érythroïdes. Chez le poisson zèbre adulte, cette mutation entraîne un blocage de la différenciation des progéniteurs hématopoïétiques au stade proérythroblaste et une expansion du compartiment myéloïde [
1]. Ces résultats indiquaient une fonction majeure du produit du gène moonshine dans l’érythropoïèse et la myélopoïèse. Le clonage positionnel du gène associé au phénotype moonshine a montré qu’il s’agit de l’orthologue du gène TIF1γ des mammifères, indiquant que ce régulateur de la transcription est un facteur essentiel de l’érythropoïèse primitive et définitive ainsi que de la myélopoïèse chez le poisson zèbre [
2]. Cette même accumulation de proérythroblastes est retrouvée dans un modèle in vitro de différenciation érythrocytaire à partir de cellules CD34+ humaines dans lesquelles TIF1γ a été inhibé par une stratégie d’interférence ARN [
3,
4]. Les fonctions moléculaires de TIF1γ restent controversées. TIF1γ est un membre d’une famille de corépresseurs transcriptionnels caractérisée par différents domaines permettant une activité au niveau de la chromatine et possédant une activité E3 ubiquitine ligase [
5–
7]. TIF1γ est le seul membre de cette famille qui est un composant de la voie de signalisation du TGF-β (transforming growth factor β) : il interagit avec le complexe Smad2/3 en compétition avec Smad4 [4], et/ou en ubiquitinylant Smad4 entraînant sa dégradation [5,
8,
9]. Ainsi, en réponse au TGF-β, le complexe TIF1γ/Smad2/3 stimule la différenciation érythrocytaire, alors que le complexe Smad4/Smad2/3 entraîne une inhibition de la prolifération des cellules érythroïdes [3, 4]. Enfin, une étude récente basée sur une complémentation du mutant moonshine et une étude biochimique a montré que TIF1γ contrôle également le devenir des cellules érythroïdes en régulant l’élongation de la transcription de gènes spécifiques, cibles d’un complexe transcriptionnel contenant le facteur TAL1 [3]. |
De nouvelles fonctions de TIF1γ dans l’hématopoïèse adulte En utilisant le système d’inactivation conditionnelle loxP/Mx-Cre dans un modèle de souris, nous avons éteint l’expression de TIF1γ dans toutes les cellules hématopoïétiques adultes. Cette inactivation entraîne une diminution du nombre de cellules souches hématopoïétiques associée à un défaut de la capacité de reconstitution hématopoïétique à long terme de ces CSH, les transplantations en série de cellules de la moelle osseuse de souris n’exprimant pas TIF1γ aboutissent à une aplasie médullaire et à la mort de souris létalement irradiées et greffées avec ces cellules. Enfin, les CSH déficientes en TIF1γ circulent en grand nombre dans la circulation sanguine ce qui témoigne donc d’un défaut de leur rétention dans la moelle osseuse. Ce phénotype est lié à une diminution d’expression de la protéine CXCR4 - récepteur de la chimiokine CXCL12 - essentielle aux mécanismes de nichage/rétention. Ces résultats montrent que TIF1γ régule la biologie des cellules souches hématopoïétiques adultes à de multiples niveaux [
10]. L’étude de l’hématopoïèse adulte des souris n’exprimant pas TIF1γ a également mis en évidence le rôle central de TIF1γ dans la détermination des CSH vers les compartiments érythroïde et myéloïde (→) [
11]). TAL1 et PU.1 sont deux protéines connues pour réguler l’expression de gènes dans les CSH et assurer leur détermination vers les compartiments érythro/mégacaryocytaires ou myéloïdes. TIF1γ assure les activités coordonnées de TAL1 et PU.1 et régule leurs activités transcriptionnelles en interagissant physiquement avec ces deux protéines. Enfin, TIF1γ peut s’associer à TAL1 et PU.1 fixées sur des séquences régulatrices et peut ainsi réprimer la transcription de certains de leurs gènes cibles impliqués dans les différenciations érythroïde ou myéloïde. Phénotypiquement, la perte de TIF1γ se traduit par une augmentation du nombre de cellules myéloïdes au détriment des cellules érythroïdes. (→) Voir l’article de R. Aucagne et al., page 696 de ce numéro |
TIF1γ apparaît donc comme un chef d’orchestre chargé de coordonner le maintien et l’équilibre des différentes populations de progéniteurs hématopoïétiques souches, érythroïdes et myéloïdes. En rendant cohérent le jeu des facteurs de transcription TAL1 et PU.1, il oriente un processus de différenciation qui s’étend des CSH jusqu’aux cellules hématopoïétiques matures. Ces résultats clarifient le mystère entourant l’équilibre de production entre globules rouges et cellules immunitaires. La découverte des fonctions de TIF1γ dans l’hématopoïèse adulte ouvre également de nouvelles voies dans la recherche médicale. En effet, de nombreuses maladies sont associées à l’altération de ces populations matures, comme par exemple les anémies ou aplasies. TIF1γ se révèle donc être une cible potentielle qui pourrait être manipulée pour induire la production sélective de ces différents types cellulaires en fonction des besoins de l’organisme. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Monteiro
R
,
Pouget
C
,
Patient
R
. The gata1/pu.1 lineage fate paradigm varies between blood populations and is modulated by tif1gamma . EMBO J.
2011; ; 30 : :1093.-1103. 2.
Ransom
DG
,
Bahary
N
,
Niss
K
, et al.
The zebrafish moonshine gene encodes transcriptional intermediary factor 1gamma, an essential regulator of hematopoiesis . PLoS Biol.
2004; ; 2 : :E237.. 3.
Bai
X
,
Kim
J
,
Yang
Z
, et al.
TIF1gamma controls erythroid cell fate by regulating transcription elongation . Cell.
2010; ; 142 : :133.-143. 4.
He
W
,
Dorn
DC
,
Erdjument-Bromage
H
, et al.
Hematopoiesis controlled by distinct TIF1gamma and Smad4 branches of the TGFbeta pathway . Cell.
2006; ; 125 : :929.-941. 5.
Dupont
S
,
Zacchigna
L
,
Cordenonsi
M
, et al.
Germ-layer specification and control of cell growth by Ectodermin, a Smad4 ubiquitin ligase . Cell.
2005; ; 121 : :87.-99. 6.
Venturini
L
,
You
J
,
Stadler
M
, et al.
TIF1gamma, a novel member of the transcriptional intermediary factor 1 family . Oncogene.
1999; ; 18 : :1209.-1217. 7.
Yan
KP
,
Dollé
P
,
Mark
M
, et al.
Molecular cloning, genomic structure, and expression analysis of the mouse transcriptional intermediary factor 1 gamma gene . Gene.
2004; ; 334 : :3.-13. 8.
Dupont
S
,
Mamidi
A
,
Cordenonsi
M
, et al.
FAM/USP9x, a deubiquitinating enzyme essential for TGFbeta. Signaling, controls Smad4 monoubiquitination . Cell.
2009; ; 136 : :123.-135. 9.
Morsut
L
,
Yan
KP
,
Enzo
E
, et al.
Negative control of Smad activity by ectodermin/Tif1gamma patterns the mammalian embryo . Development.
2010; ; 137 : :2571.-2578. 10.
Kusy
S
,
Gault
N
,
Ferri
F
, et al.
Adult hematopoiesis is regulated by TIF1gamma, a repressor of TAL1 and PU.1 transcriptional activity . Cell Stem Cell.
2011; ; 8 : :412.-425. 11.
Aucagne
R
,
Droin
N
,
Solary
E
, et al.
TIF1γ : un gène suppresseur de tumeur dans la leucémie myélomonocytaire chronique . Med Sci (Paris).
2011; ; 27 : :696.-698. |