| |
| Med Sci (Paris). 2011 August; 27(8-9): 737–745. Published online 2011 August 31. doi: 10.1051/medsci/2011278016.Immunodéficiences et pathologies associées aux mutations dans STIM/ORAI Un complexe membranaire au cœur de la signalisation calcique Françoise Le Deist1,2* and Thierry Capiod3,4** 1Département de microbiologie et d’immunologie et centre de recherche, CHU Sainte-Justine, 3175, côte Sainte-Catherine, Montréal, Canada (Québec) 2Département de microbiologie et d’immunologie, Université de Montréal (Québec), QC H3T1C5Canada 3Inserm U807, Faculté de médecine ; Université Paris Descartes, 156, rue de Vaugirard, 75015Paris 4IFR 94-IRNEM (IFR Necker-Enfants malades), Tour Lavoisier 7, Hôpital Necker-Enfants malades, 149, rue de Sèvres, 75015Paris, France |
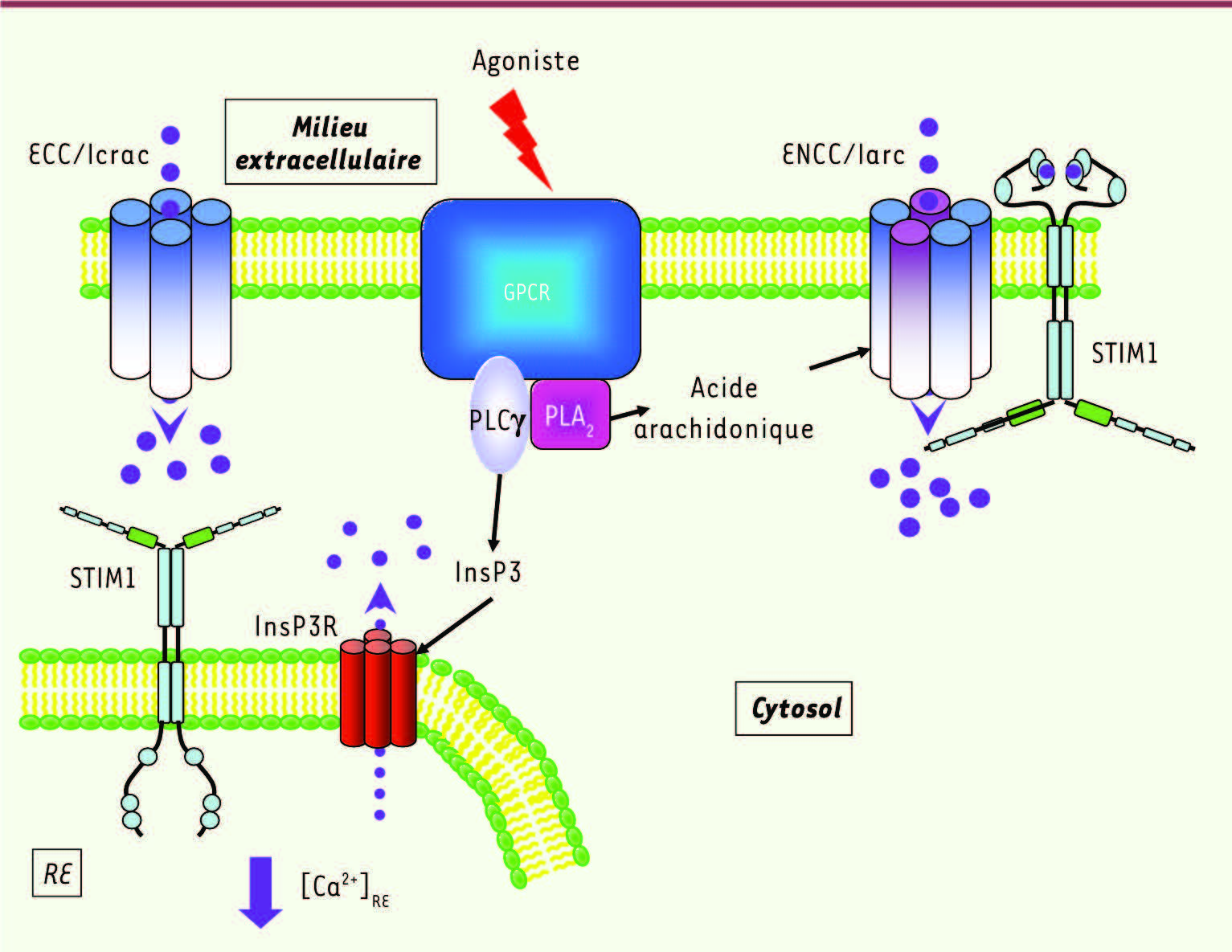
Voies capacitative et non capacitative d’entrée du Ca2+ L’entrée capacitative du Ca2+ (ECC ou SOCE, store-operated Ca2+ entry) dépend des canaux Icrac (Ca2+release activated Ca2+channels) activés par la déplétion calcique du réticulum endoplasmique (RE) [
1]. Une autre voie, dite non capacitative (ENCC, entrée non capacitative du Ca2+), utilise des canaux Iarc (arachidonic acid regulated Ca2+channels) et est activée indépendamment de la vidange en Ca2+du RE (Figure 1). Les protéines STIM (stromal interacting molecule) et ORAI1 (ou CRAC modulator) sont, après plus de deux décennies de recherche, désormais reconnues pour être la base moléculaire des canaux calciques impliqués dans l’ECC lors de la stimulation de récepteurs métabotropiques membranaires. Les deux types d’entrées de Ca2+, capacitative et non capacitative, retrouvés dans la majeure partie des cellules, jouent un rôle primordial dans de nombreuses réponses cellulaires et leurs anomalies sont impliquées dans plusieurs pathologies [
2,
3]. De récents travaux ont permis d’établir le rôle important de ces protéines et laissent penser qu’elles ont un domaine d’implication plus large que celui initialement soupçonné.
 | Figure 1.
Activation des entrées ECC et ENCC. La stimulation des récepteurs membranaires couplés aux protéines G (GPCR) induit l’activation des phospholipases Cγ (PLCγ) et A2 (PLA2) et la production des seconds messagers intracellulaires InsP3 (inositol 1,4,5 trisphosphate) et acide arachidonique (AA). L’InsP3 entraîne la vidange en Ca2+ (cercles violets) du RE après ouverture des canaux InsP3R situés sur la membrane du RE. Cette vidange provoque l’ouverture de canaux homotétramériques ORAI1 appelés ECC/Icrac, sur la membrane plasmique (voir texte). L’AA, indépendamment de la vidange calcique du RE, active directement un canal pentamérique constitué de 2 sous-unités ORAI3 (violet) et de 3 sous-unités ORAI1 (bleu), distribuées avec une stœchiométrie 31311 ou 31113 pour donner naissance au courant calcique ENCC/Iarc. Il a été suggéré que ce canal ENCC serait associé aux STIM1 présentes dans la membrane plasmique. |
|
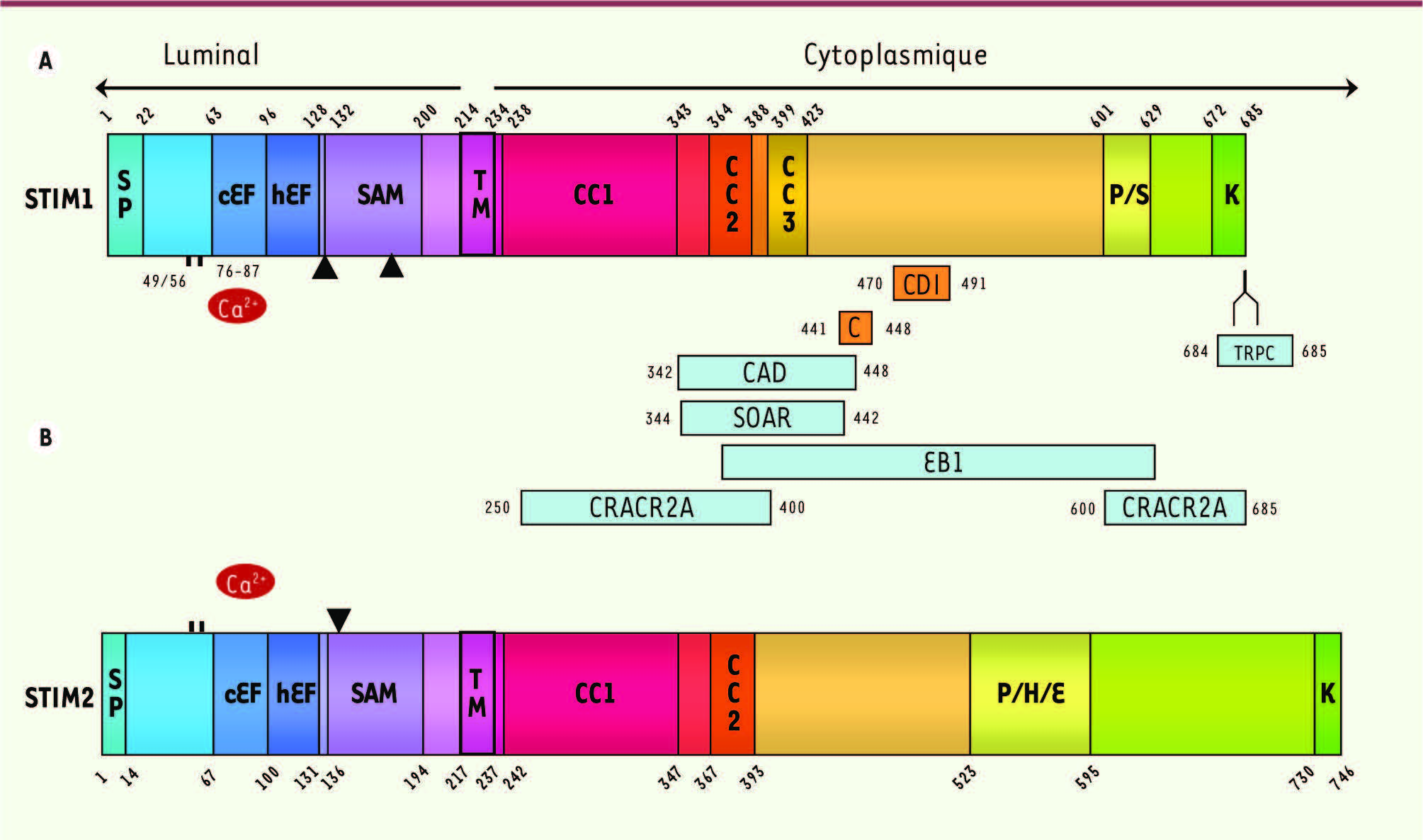
STIM1 et STIM2 Les protéines STIM ont été identifiées en 1996 [
4] et leur rôle dans les entrées de Ca 2+n’a que récemment été démontré [
5]. La première forme caractérisée, STIM1, est une protéine avec un segment transmembranaire unique. Une étude (controversée) a montré qu’environ 25 % de la protéine est localisé à la membrane plasmique et 75 % à la membrane endoplasmique [
6]. STIM1 possède deux domaines EF- hand
2 adjacents agissant ensemble avec un domaine SAM ( sterile a -motif) contigu et formant un complexe stable en présence de Ca 2+
(Figure 2). Lorsque la concentration en Ca 2+ luminal baisse dans le RE [
7], le Ca 2+ se dissocie de ce complexe provoquant ainsi l’exposition de résidus hydrophobes des domaines EF -hand et SAM et donc l’oligomérisation des régions EF et SAM de STIM1. L’étape suivante de l’agrégation implique les régions coiled-coil
3 situées sur l’extrémité carboxy-terminale de STIM1. Ces réactions sont bien entendu réversibles, une augmentation de la concentration en Ca 2+ provoquant la formation de monomères stables. STIM1 a un Kd pour le Ca 2+ de l’ordre de 200 µM [
8].
 | Figure 2.
Structures des monomères STIM1 (A) et STIM2 (B). Il existe des sites de glycosylation intraluminaux en position 131 et 171 sur STIM1, et 135 sur STIM2. Des cystéines sont conservées en position 49 et 56 sur STIM1 et 53 et 60 sur STIM2. Les sites de liaison pour le Ca2+ situés à l’intérieur du RE permettant l’oligomérisation des STIM se trouvent sur le domaine cEF en position 76-87 et 80-91 respectivement pour STIM1 et STIM2. En (A) : sites de liaison sur STIM1 des protéines de la signalisation calcique : CDI, domaine d’inactivation dépendante du Ca2+ de Icrac contenant un cluster de 7 acides aminés (aa) entre les positions 475 et 483 modulant positivement et négativement le degré d’inactivation. S/P peptide signal ; cEF et hEF, motifs permettant la liaison du Ca2+ ; SAM, sterile alpha-motif ; TM, segment transmembranaire ; CC1, CC2 et CC3, domaines coiled-coil ; P/S, domaine riche en proline et sérine et P/H/E, riche en proline et histidine ; K domaine riche en acides aminés polybasiques. C, canaux calciques dépendants du potentiel Cav1.2 ; CAD, domaine d’activation du Icrac ; SOAR (STIM-ORAI activation region), région de couplage STIM1-ORAI1 ; EB1 (microtubule plus end tracking protein) ; CRACR2A (CRAC regulator 2A) ; canaux TRPC (transient receptor potential canonical) 1, 3, 4, 5 et 6. Les SERCA se disposent autour de STIM1 après vidange calcique du RE, mais il n’y a pas d’interactions visibles entre ces deux protéines. |
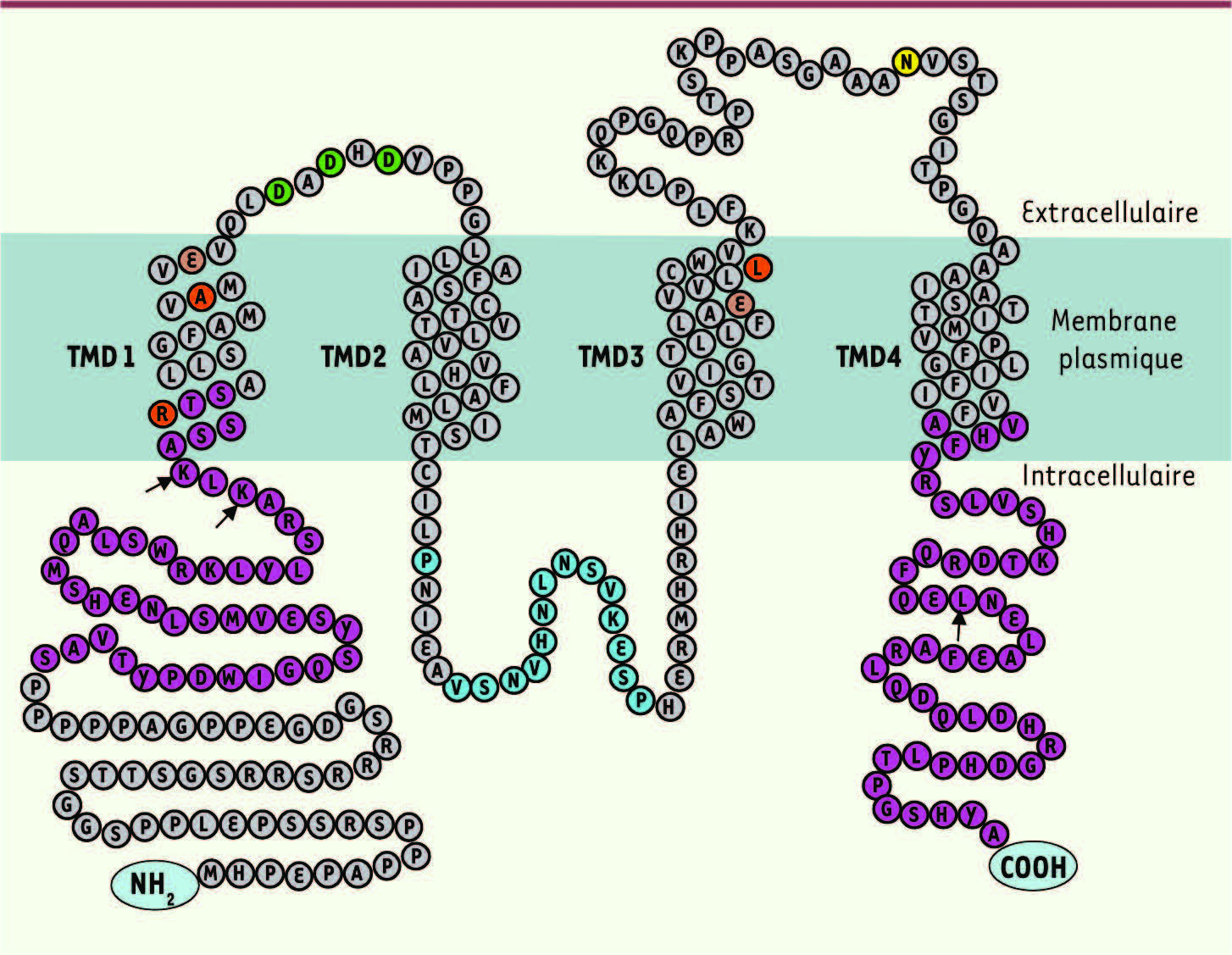
STIM2, dont l’expression est uniquement intracellulaire, a une structure très proche de celle de STIM1 (Figure 2) et possède les mêmes propriétés vis-à-vis du Ca2+ [
9]. STIM2 a un Kd pour le Ca2+ d’environ 400 µM [8] et est par conséquent activée pour des vidanges calciques d’amplitudes plus faibles que celles nécessaires à l’activation de STIM1. Ces données sont à rapprocher de celles concernant la quantité de Ca2+ libre dans la lumière du RE. En effet, quoiqu’aussi très variable selon la méthode de mesure utilisée, cette quantité semble s’établir aux environs de 500 µM (de 5 µM à 5 mM [
10]), une valeur consensuelle proche des Kd de STIM1 et STIM2. ORAI1, ORAI2 et ORAI3 Les trois protéines ORAI possèdent quatre domaines transmembranaires à la membrane plasmique et leurs extrémités amino- et carboxy-terminales sont tournées vers le cytoplasme (Figure 3). Ces protéines ont une structure moléculaire proche et un poids moléculaire de 33 kDa environ. Un site de glycosylation situé sur la seconde boucle extracellulaire a été mis en évidence uniquement sur ORAI1 [ 9]. Deux de ces protéines constituent la base de deux voies d’entrée du Ca 2+retrouvées sur la majeure partie des cellules humaines. Les deux voies d’entrées Icrac et Iarc impliquent deux canaux aux structures plutôt différentes. Icrac est constitué d’un homotétramère ORAI1 alors qu’un hétéropentamère constitué de sous-unités ORAI1 et ORAI3 (selon des stœchiométries particulières conduisant aux deux complexes 31311 et 31113 [
11]) donne naissance aux Iarc [ 9].
 | Figure 3.
Structure du canal ORAI1. ORAI1 est une protéine de 301 aa (33 kDa) constituée de quatre domaines transmembranaires (TMD) dont les extrémités amino- et carboxy-terminales sont cytoplasmiques. ORAI2 et ORAI3 ont une taille respective de 254 et 295 aa avec une partie amino-terminale réduite respectivement de 26 (25-51) et 25 aa (26-51) par rapport à ORAI1. La boucle extracellulaire entre les domaines transmembranaires 3 et 4 est plus longue de 34 aa pour ORAI3 et plus courte de 13 aa pour ORAI2. ORAI1 possède des séquences spécifiques pour son association avec STIM1, SPCA2 et CRACR2A, ainsi que des séquences jouant un rôle primordial dans l’activité du canal calcique. Violet : séquence aminoterminale (48-93) couvrant les sites de fixation pour SPCA2 (48-91), CRACR2A (64-93) où la substitution des lysines (K) 85 et 87 par des alanines (indiqués par une flèche) diminue significativement l’interaction entre les deux protéines, STIM1 (70-91), et séquence carboxy-terminale couvrant les sites de fixation pour STIM1 (254-301) et CRACR2A (la mutation L273S, flèche, qui perturbe le domaine coiled-coil provoque aussi une forte réduction de l’association entre les deux protéines). La région 64-93 étant bien conservée, CRACR2A se lie aussi avec ORAI2 et ORAI3. Orange : mutations associées à une déficience immunitaire R89W, A109E et L194P. Rouge : filtre de sélectivité du canal ionique porté par les résidus E106 et E190. Vert : trois sites extracellulaires de fixation du Ca2+ en D110, D112, D114. Cyan : séquence intracellulaire sur la boucle entre les domaines transmembranaires 2 et 3 permettant l’inactivation dépendante du Ca2+ du canal calcique. Jaune : N223 site de glycosylation. Il n’existe pas de sites connus de glycosylation sur ORAI2 et ORAI3. |
D’après ces résultats, l’extinction d’ORAI1 provoquerait une inhibition des deux courants Icrac et Iarc tandis que l’extinction d’ORAI3 ne devrait toucher que Iarc. Néanmoins, une étude récente a démontré qu’ORAI3 est un composant majeur de l’ECC dans une lignée de cellules cancéreuses du sein (MCF-7) [
12]. Il est surprenant de noter que l’extinction d’ORAI1 ou ORAI2 n’a aucun effet sur l’ECC dans ces cellules, ce qui suggère qu’un homomère ORAI3 formerait le canal calcique dans ces cellules. L’hypothèse selon laquelle ce schéma serait spécifique aux cellules cancéreuses du sein doit être maintenant étendue à d’autres cellules que les MCF-7. Il existe peu de données concernant ORAI2 mais le fait que cette protéine, pourtant fortement exprimée, ne puisse pas rétablir l’ECC dans les cellules T ORAI1-/-
démontre que la présence d’ORAI1 est indispensable pour l’ECC dans les cellules T [9]. Cependant, il a été très récemment suggéré qu’ORAI2 pourrait s’associer avec STIM2 pour permettre l’activation de l’ECC dans les cellules dendritiques [
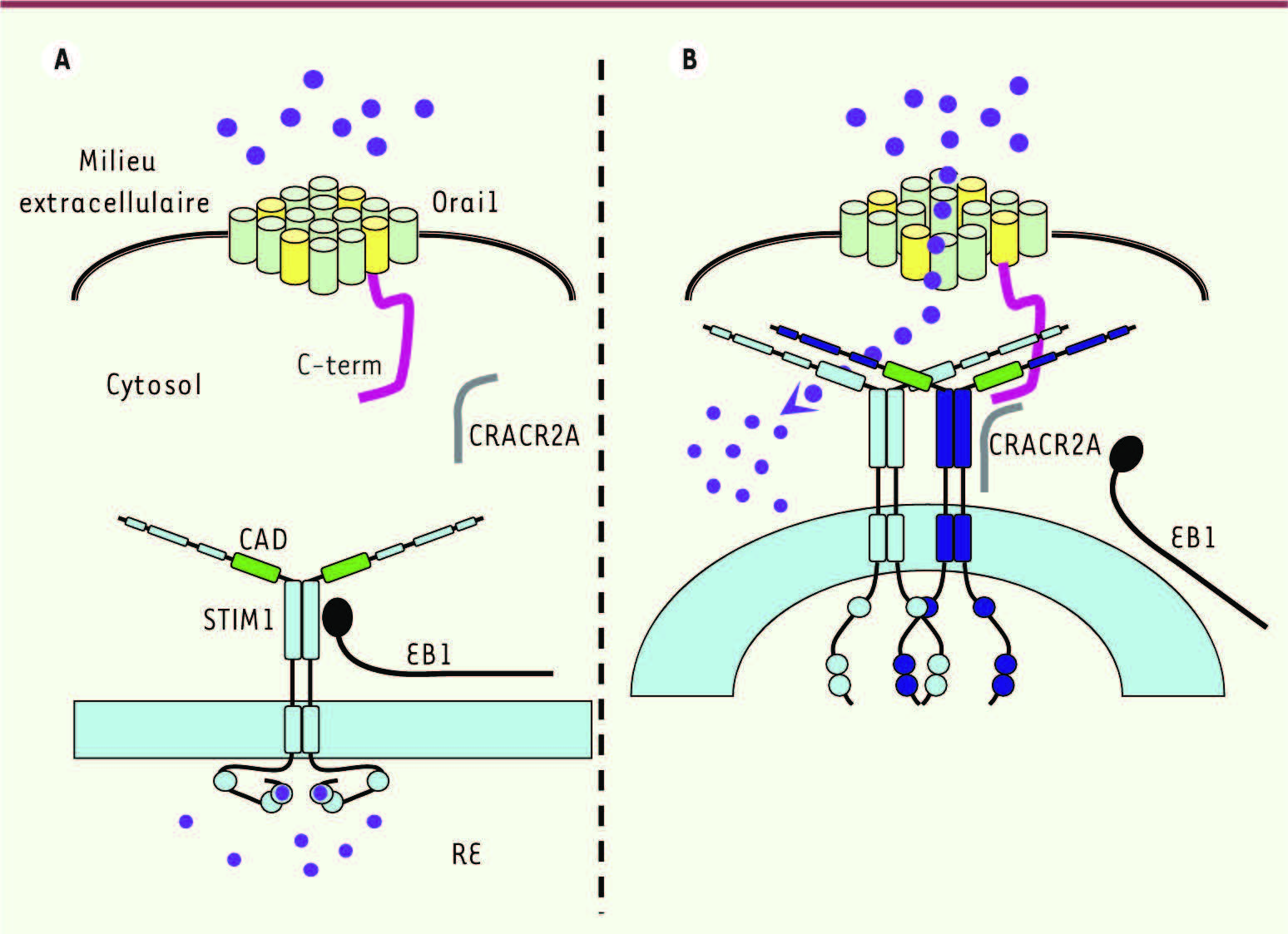
13]. Ce travail devra néanmoins être confirmé par des enregistrements de l’entrée calcique par des mesures de fluorescence ou en électrophysiologie. Interactions STIM-ORAI Les deux types de courants calciques, Icrac et Iarc, correspondent à deux types d’interactions entre STIM et ORAI (Figures 2 et 3). La vidange calcique du RE provoque successivement la multimérisation de STIM1, sa translocation au sein de la membrane du réticulum vers des zones d’apposition avec la membrane plasmique et son association avec ORAI1 pour permettre l’ECC (Figure 4). Cette association semble faire intervenir deux domaines coiled-coil de STIM1 et probablement les terminaisons carboxy- et amino-terminales d’ORAI1. Huit molécules de STIM1 peuvent potentiellement s’associer au tétramère d’ORAI1, mais il semblerait qu’un minimum de deux soit nécessaire pour activer ce canal [ 9]. L’ENCC implique le complexe pentamérique ORAI1-ORAI3 et les STIM1 de la membrane plasmique. Néanmoins, le mécanisme d’action par lequel STIM1 pourrait activer ce canal n’est pas encore clairement élucidé [ 11].
 | Figure 4.
Le complexe STIM1/ORAI au cœur de la signalisation calcique. A. Cellule non stimulée : le Ca2+ (boules violettes) est fixé sur STIM1 dans la lumière du RE et la protéine EB1 ancre STIM1 au cytosquelette. Le canal ECC formé de quatre sous-unités d’ORAI1 possédant chacune quatre domaines transmembranaires est fermé. Le quatrième domaine transmembranaire (en jaune) d’ORAI1 est relié à l’extrémité carboxy-terminale (trait mauve). B. Cellule stimulée (voir Figure 1), le Ca2+ baisse dans le RE (voir texte), entraînant un déplacement de STIM1 vers la membrane plasmique, une dissociation d’EB1, une association entre le domaine CAD (en vert) de STIM1 et l’extrémité carboxy-terminale (C-term) d’ORAI, la liaison de CRACR2A avec STIM1 et ORAI pour consolider cette association et l’ouverture du canal. Ce schéma ne présage en rien du nombre de STIM1 nécessaire pour activer le complexe ORAI, ni de liaison de CRACR2A et ORAI sur le même domaine CAD. Les canaux Cav1.3 (non représentés ici) entrent en compétition avec ce même domaine CAD. Cette configuration suggère que l’association STIM/ORAI pourrait ne pas empêcher l’établissement d’une liaison des TRPC avec l’extrémité de STIM1. |
Le rôle de STIM2 dans l’ECC est controversé : l’expression isolée de STIM2 inhibe l’ECC, alors que sa coexpression avec ORAI1 en induit l’activation [9]. De plus, Stim2 peut prendre la place de Stim1 chez les mutants Stim1-/-
ou remplacer des protéines Stim1 mutées et non fonctionnelles (voir plus bas). Ceci suggère qu’en conditions normales, le couplage STIM2-ORAI1 est masqué du fait de la plus faible expression de STIM2 par rapport à STIM1. En effet, dans les cellules T, STIM2 ne représente que 5 % des STIM totales [9]. Cependant, comme il possède un Kd pour le Ca2+légèrement plus élevé que celui de STIM1 et qu’il est probablement associé avec ORAI1, il a été suggéré que STIM2 pouvait être impliquée dans une entrée constitutive de Ca2+dans les cellules. Le caractère général de cette observation reste à établir. Néanmoins, il est envisageable qu’en fonction du niveau d’expression de STIM2 selon le tissu ou bien d’une condition pathologique ou non, l’entrée basale de Ca2+puisse moduler l’activité des voies de transduction dépendantes du Ca2+avec des conséquences néfastes sur la physiologie cellulaire. Ce point est très important puisqu’il ne s’agirait plus ici d’entrée stimulée mais d’entrée constitutive de Ca2+. En effet, bien qu’ils soient de plus en plus étudiés depuis plus de vingt ans, les mécanismes qui permettent l’activation soutenue de l’ECC dans la majeure partie des cellules, excepté peut-être dans celles du système immunitaire, restent à démontrer in vivo. Interactions avec les autres protéines de la signalisation calcique En dehors de leurs interactions entre elles, les deux familles de protéines STIM et ORAI peuvent aussi s’associer (Figures 2, 3 et 4) avec d’autres protéines de la signalisation calcique, comme plusieurs membres de la famille de canaux calciques TRPC ( transient receptor potential channels [
14]), Cav1.2 (un canal calcique dépendant du potentiel), SERCA ( sarco/endoplasmic reticulum Ca2+-ATPase), SPCA2 ( secretory pathway Ca2+-ATPase 2), CRACR2A ( CRAC regulator 2A), calmoduline, EB1 ( end binding 1) [
15-
18]. Il y a un recouvrement des régions d’interactions entre ces protéines et la partie cytosolique de STIM1, ce qui suggère l’existence d’une compétition pour ces sites entre les diverses protéines de la signalisation calcique (Figure 2). Ces données indiquent que les effets de STIM et ORAI ne se résument plus exclusivement à un contrôle de l’amplitude d’un type de courant calcique. Il convient donc maintenant d’interpréter les nombreux résultats de la littérature en fonction de ces interactions multiples. |
STIM/ORAI et déficit immunitaire Des anomalies touchant soit ORAI1 soit STIM1 qui entraînent un défaut d’ECC ont été identifiées chez des patients [
19]. Ces patients présentent un déficit immunitaire héréditaire de transmission autosomique récessive associé, dans certains cas, à un syndrome lymphoprolifératif avec auto-immunité et à des manifestations extra-hématopoïétiques. Ce phénotype clinicobiologique est décrit ci-dessous et comparé aux modèles murins rapportés dans la littérature. Mutations dans ORAI1 À ce jour, des mutations dans le gène ORAI1 ont été identifiées chez six patients issus de trois familles non apparentées [
20,
21]. Dans une famille, une mutation non sens (A88fsX25) résulte de l’insertion d’une adénine (258-259insA). Cette mutation retrouvée à l’état homozygote chez le patient conduit à l’absence d’expression de la protéine ORAI1. Des mutations faux sens ont été trouvées dans les deux autres familles. Dans un cas, la mutation R91W entraîne la substitution d’une arginine par un résidu tryptophane dans le premier domaine transmembranaire sans altérer l’expression de la protéine. Cette protéine anormale exerce un effet transdominant négatif comme en témoigne un défaut partiel d’ECC détecté dans les cellules hétérozygotes pour cette mutation [ 20]. Les deux autres mutations faux sens A103E et L194P, qui touchent respectivement le deuxième et le troisième domaine transmembranaire, ont été retrouvées dans la troisième famille à l’état double hétérozygote chez le patient étudié. Malgré un niveau d’ARNm normal dans les fibroblastes de ce patient, la protéine n’est pas exprimée. Ceci suggère que ces deux mutations déstabilisent les domaines transmembranaires où elles sont localisées. Mutations dans STIM1 Deux mutations dans STIM1 ont été identifiées dans deux familles non apparentées et ces mutations existaient à l’état homozygote chez les patients. Dans une famille, la mutation retrouvée consiste en une insertion (380-381insA) qui conduit à un codon stop prématuré (E136X) et à l’absence de la protéine [
22]. La mutation qui touche la deuxième famille altère un site accepteur d’épissage à la position -1 de l’exon 8 et entraîne l’absence de transcrit normal et de protéine STIM1 [
23]. Défaut d’ECC et déficit immunitaire Les mutations dans les gènes ORAI1 et STIM1 entraînent un défaut d’ECC. Chez les patients qui présentent des mutations dans ORAI1 ou dans STIM1, le défaut d’ECC est observé dans toutes les cellules hématopoïétiques testées, c’est-à-dire les lymphocytes T et B, les polynucléaires et les plaquettes, mais aussi dans des cellules non hématopoïétiques tels les fibroblastes. L’existence d’un déficit immunitaire est illustrée par dix patients chez lesquels les mutations ont été trouvées ou leur fratrie décédée en raison de manifestations compatibles avec ce type de déficit. À l’exception d’un patient qui a présenté un sarcome de Kaposi lié au HHV8 (human herpes virus 8) à l’âge de 2 ans [23], tous les patients ont présenté des manifestations infectieuses avant l’âge de 3 mois [19,
24]. Six patients sont décédés avant l’âge de 3 ans. La greffe de cellules souches hématopoïétiques, pratiquée chez quatre enfants, a corrigé le déficit immunitaire chez trois d’entre eux, actuellement âgés de 16, 16 et 6 ans. Un enfant est décédé tôt après la greffe. Ces infections, en raison de leur gravité et de leur caractère opportuniste, sont semblables à celles observées chez les patients atteints de déficit immunitaire combiné sévère avec absence de lymphocytes T. Cependant, contrairement aux patients atteints d’un déficit immunitaire combiné sévère, ces patients ne présentent pas de lymphopénie ni d’anomalie de différenciation des lymphocytes T, B et NK (natural killer) [21]. De même, chez les souris chimères dont les cellules souches hématopoïétiques présentent un défaut complet en Orai1 (Orai1-/-
) ou en Stim1 et Stim2 (Stim1-/-Stim2-/-
), la différenciation des lymphocytes T, B et NK est normale bien que les thymocytes présentent un défaut d’ECC [
25]. Ceci suggère que le Ca2+nécessaire à la différenciation lymphocytaire vient soit de libérations calciques du RE, soit d’influx calcique qui dépend de mécanismes différents d’ECC. Le déficit immunitaire est principalement lié au défaut d’activation des lymphocytes T. En effet, la réponse des lymphocytes T de ces patients aux stimulations ciblant le TcR (récepteur des cellules T) en termes de prolifération et de synthèse de lymphokines (IL [interleukine]-2, IL-4, IL-10, IFNγ [interféron γ] et TNFα [tumor necrosis factor α]) est réduite voire absente [19, 24,
26]. Ceci illustre le rôle primordial de l’ECC dans l’activation des lymphocytes T et le caractère crucial du Ca2+ intracytoplasmique dans la translocation nucléaire du facteur de transcription NF-AT (Figure 5) [19, 24, 26].
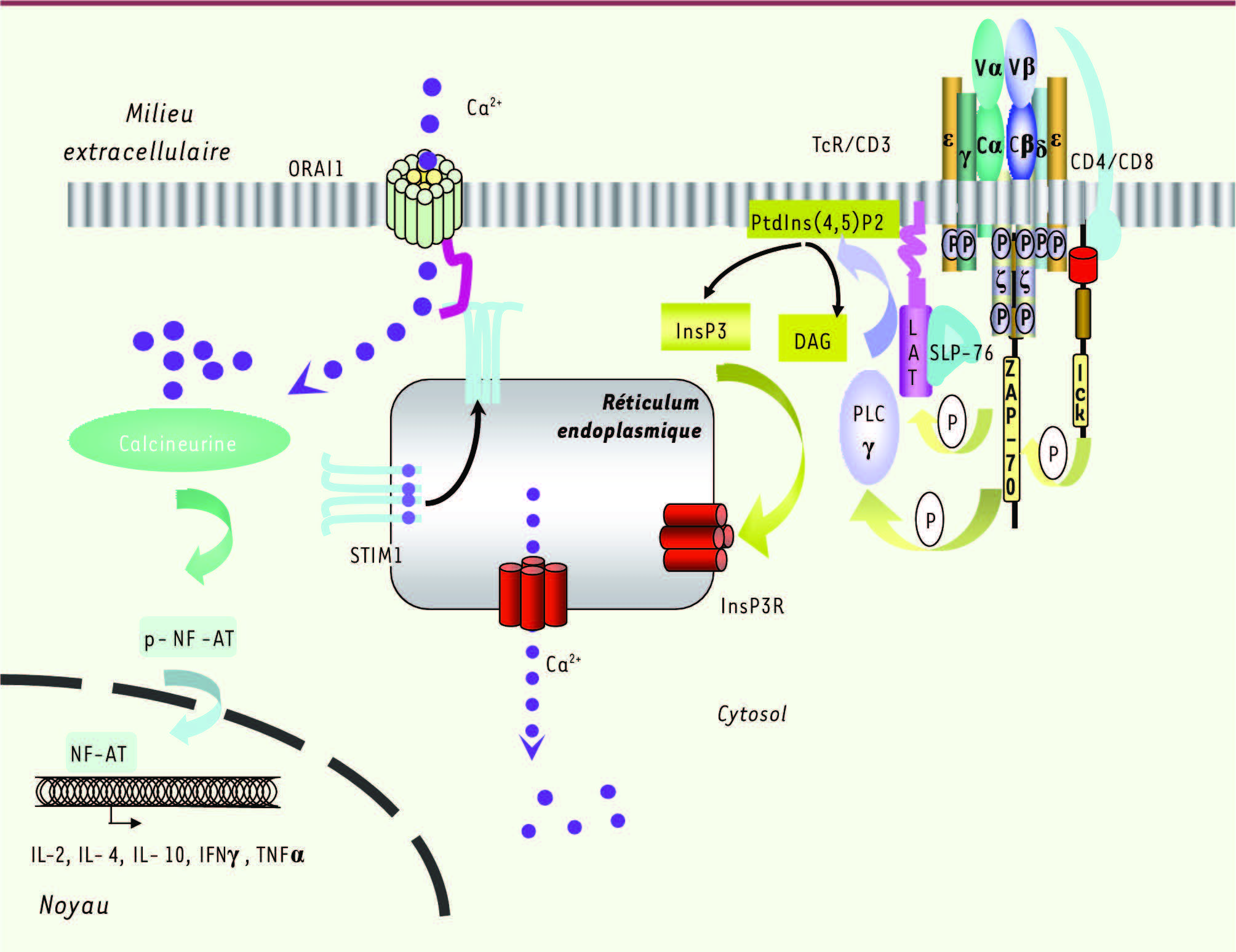
 | Figure 5.
Rôles de STIM1 et d’ORAI1 dans l’activation des lymphocytes T. La reconnaissance de l’antigène par le TcR α/β entraîne grâce au CD3 (γ, δ, ε, ε, ζ, ζ), l’activation des tyrosine kinases ZAP-70 (x chain associated protein de 70 kDa) et lck qui phosphorylent les protéines intermédiaires SLP-76 (SH2 domain containing leukocyte protein de poids moléculaire 76 kDa) et LAT (linker for activation of T cells) et la PLCγ (phospholipase Cγ). La PLCγ, ainsi activée, hydrolyse le phospholipide membranaire PtdIns(4,5)P2 (phosphatidylinositol-4-5 bisphosphate) en InsP3 (inositol-1,4,5 trisphosphate) et DAG (diacyglycérol). L’InsP3 se lie et ouvre les récepteurs à l’InsP3 (InsP3R) à la membrane du réticulum endoplasmique (RE) entraînant la libération du Ca2+à partir du RE. En conséquence, les protéines STIM1 se redistribuent à la surface du RE et forment un oligomère qui interagit avec ORA1 permettant ainsi l’influx calcique à partir du milieu extracellulaire. L’augmentation du Ca2+intracytoplasmique active des enzymes dépendantes du Ca2+ telle la calcineurine, phosphatase qui déphosphoryle le facteur de transcription NF-AT (nuclear factor of activated T cells). Après translocation dans le noyau, NF-AT induit la transcription de gènes cibles tels les gènes codant l’IL-2, l’IL-4, l’IL-10, l’IFNγ et le TNFα. |
Malgré la présence normale de lymphocytes B et d’immunoglobulines sériques, les réponses anticorps spécifiques après vaccination sont absentes. Ce défaut de production d’anticorps est plus probablement secondaire au défaut d’activation des lymphocytes T qu’à une anomalie intrinsèque des lymphocytes B. En effet, les lymphocytes B de patients porteurs de mutations dans ORAI1 (A103E/L194P) sont capables de proliférer en présence d’un activateur du récepteur B de l’antigène, et ceci malgré l’absence d’ECC détectable. Les cellules NK dépourvues d’ORAI1 ne sont pas fonctionnelles comme en témoigne leur incapacité de dégranulation et de synthèse d’IFNγ [
27]. Le déficit immunitaire peut donc être aggravé par un défaut fonctionnel d’autres cellules du système immunitaire comme les cellules dendritiques et les monocytes/macrophages. Cependant, certaines cellules hématopoïétiques, par exemple les lymphocytes B, les plaquettes et les polynucléaires, bien que dépourvues d’ECC, exercent normalement leurs fonctions telles qu’elles sont testées in vitro. Défaut de SOCE et syndrome lymphoprolifératif avec auto-immunité Seul un des six patients porteurs d’une mutation dans ORAI1 (mutation A88fsX25) présente une neutropénie et une thrombopénie auto-immunes, complications fréquemment observées au cours des déficits immunitaires [ 21]. Au contraire, tous les patients mutés pour STIM1 (4/4) développent des manifestations auto-immunes qui touchent des lignées hématopoïétiques (thrombopénie [4/4], anémie hémolytique [3/4]) et un syndrome lymphoprolifératif constitué d’une hépatosplénomégalie et de polyadénopathies [ 22]. Ce tableau est fort probablement lié à l’absence presque totale de lymphocytes T CD4 régulateurs (Treg) qui a été observée chez le seul patient étudié pour ce paramètre et chez les souris Stim1
-/-
Stim2
-/- [
28]. En effet, ces souris présentent un syndrome lymphoprolifératif qui peut être prévenu par l’injection de Treg normaux. Les Treg sont définis par l’expression du facteur de transcription FoxP3 dont la synthèse résulte de l’activation de NF-AT, dépendante d’ECC [
29]. Nous ignorons si les Treg sont présents ou non chez les patients porteurs de mutations dans ORAI1. Cependant, la présence normale de Treg chez les souris Orai1-/-
et l’absence d’auto-immunité et de syndrome lymphoprolifératif chez ces patients suggère qu’un certain degré d’ECC résiduel en absence d’ORAI1 est suffisant pour permettre la différenciation des lymphocytes Treg chez l’homme comme chez la souris [ 25]. Défaut de SOCE et manifestations extra-hématopoïétiques Une myopathie et une dysplasie ectodermique sont observées chez la majorité des patients en âge d’être évalués, qu’ils présentent une mutation dans STIM1 ou ORAI1. La myopathie est caractérisée par une atrophie des fibres musculaires de type II. Elle conduit à une hypotonie musculaire généralisée avec retard à la marche et, chez les enfants plus âgés ayant reçu une greffe de cellules souches hématopoïétiques, à une insuffisance respiratoire. Chez les patients déficients en STIM1, cette myopathie est associée à une hypoplasie irienne partielle. Cette myopathie qui affecte les patients et le déficit musculaire observé chez les souris Stim1-/-
ou Orai1-/-
suggèrent que l’ECC dépendante de STIM1 et d’ORAI1 est cruciale pour le développement et/ou la fonction des fibres musculaires striées. La dysplasie ectodermique est caractérisée par une amélogenèse imparfaite associée, chez les patients déficients en ORAI1, à une anhydrose cutanée. Ces observations suggèrent que le transport calcique dans l’améloblaste et l’activité sécrétoire des glandes sudoripares dépendent de l’ECC [26]. Bien que STIM1 et ORAI1 soient exprimées dans tous les types cellulaires, l’expression limitée de la maladie liée à des mutations dans STIM1 ou ORAI1 montre que dans certains tissus, ORAI1 pourrait être remplacé par ORAI3, et STIM1 par STIM2, ou que l’influx calcique pourrait provenir d’un phénomène différent de l’ECC. |
STIM-ORAI et prolifération cellulaire Bien avant la mise en évidence de son rôle dans l’ECC, STIM1 était nommée GOK et reconnue pour être une protéine impliquée dans la suppression de tumeurs et la mort cellulaire [6]. Paradoxalement, depuis qu’elle a été trouvée associée à ORAI1, c’est un rôle dans la prolifération cellulaire qui lui a été attribué. En effet, comme l’ECC est reliée à la prolifération cellulaire d’une part et implique ORAI1 et STIM1 d’autre part, il a été tentant de procéder à ce raccourci dans l’interprétation des résultats concernant STIM1. Cependant, les récentes données portant sur le rôle de STIM1 dans la prolifération cellulaire conduisent à des conclusions opposées. Un ARN interférent (siARN) dirigé contre STIM1 soit est sans effet, soit inhibe complètement la prolifération en fonction du type cellulaire [
30,
31]. En revanche, il y a un consensus à l’heure actuelle pour admettre qu’il existe une inhibition de la prolifération cellulaire en présence des siARN contre STIM2 [31], ORAI1 [31] et ORAI3 [
32]. Certains de ces effets des STIM et ORAI passent probablement par une activation des complexes cyclines-cdk (cyclin-dependent kinase) contrôlant la progression dans le cycle cellulaire [31-
33]. La multiplicité des associations entre STIM1 et les autres protéines de la signalisation calcique, le fait que la plupart de ces associations ont lieu dans une région bien définie dans la partie cytosolique (Figure 2) et sa localisation membranaire et réticulaire compliquent l’interprétation des données qui résultent de la manipulation du niveau de l’expression de cette protéine. De toute évidence, il n’est maintenant plus possible d’interpréter ces données exclusivement en termes d’effets sur l’ECC, à plus forte raison lorsqu’une réponse physiologique à long terme est étudiée. La manipulation de l’expression des ORAI1, ORAI3, STIM1 et STIM2 a des conséquences variées sur la charge calcique du RE. Il n’y a pas de consensus clair mais une tendance qui indique qu’une extinction de l’expression des ORAI1, STIM1 et STIM2 va, à de très rares exceptions près, n’induire qu’une légère ou aucune diminution de la quantité de Ca2+ dans la lumière du RE. |
La caractérisation des entrées calciques dépendantes ou non de la vidange du réticulum endoplasmique a considérablement avancé durant ces deux dernières années. Néanmoins, il reste encore de nombreux points à éclaircir avec, entre autres, la mise en évidence de bloqueurs spécifiques de ces canaux et des liens entre pathologies et mutations des protéines qui constituent les complexes membranaires. Il est néanmoins clair que les protéines STIM et ORAI ne sont désormais plus cantonnées à un strict contrôle d’une unique entrée calcique mais jouent un rôle plus complexe dans la régulation de l’homéostasie calcique cellulaire. Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1.
Smyth
JT
,
Hwang
SY
,
Tomita
T
, et al.
Activation and regulation of store-operated calcium entry . J Cell Mol Med.
2010; ; 14 : :2337.-2349. 2.
Johnstone
LS
,
Graham
SJ
,
Dziadek
MA
. STIM proteins: integrators of signalling pathways in development, differentiation and disease . J Cell Mol Med.
2010; ; 14 : :1890.-1903. 3.
Roberts-Thomson
SJ
,
Peters
AA
,
Grice
DM
,
Monteith
GR
. ORAI-mediated calcium entry: mechanism and roles, diseases and pharmacology . Pharmacol Ther.
2010; ; 127 : :121.-130. 4.
Oritani
K
,
Kincade
PW
. Identification of stromal cell products that interact with pre-B cells . J Cell Biol.
1996; ; 134 : :771.-782. 5.
Roos
J
,
DiGregorio
PJ
,
Yeromin
AV
, et al.
STIM1, an essential and conserved component of store-operated Ca2+ channel function . J Cell Biol.
2005; ; 169 : :435.-445. 6.
Manji
SS
,
Parker
NJ
,
Williams
RT
, et al.
STIM1: a novel phosphoprotein located at the cell surface . Biochim Biophys Acta.
2000; ; 1481 : :147.-155. 7.
Stathopulos
PB
,
Li
GY
,
Plevin
MJ
, et al.
Stored Ca2+ depletion-induced oligomerization of stromal interaction molecule 1 (STIM1) via the EF-SAM region: an initiation mechanism for capacitive Ca2+ entry . J Biol Chem.
2006; ; 281 : :35855.-35862. 8.
Brandman
O
,
Liou
J
,
Park
WS
,
Meyer
T
. STIM2 is a feedback regulator that stabilizes basal cytosolic and endoplasmic reticulum Ca2+ levels . Cell.
2007; ; 131 : :1327.-1339. 9.
Hogan
PG
,
Lewis
RS
,
Rao
A
. Molecular basis of calcium signaling in lymphocytes: STIM and ORAI . Annu Rev Immunol.
2010; ; 28 : :491.-533. 10.
Meldolesi
J
,
Pozzan
T
. The endoplasmic reticulum Ca2+ store: a view from the lumen . Trends Biochem Sci.
1998; ; 23 : :10.-14. 11.
Mignen
O
,
Thompson
JL
,
Shuttleworth
TJ
. The molecular architecture of the arachidonate-regulated Ca2+-selective ARC channel is a pentameric assembly of Orai1 and Orai3 subunits . J Physiol.
2009; ; 587 : :4181.-4197. 12.
Motiani
RK
,
Abdullaev
IF
,
Trebak
M
. A novel native store-operated calcium channel encoded by Orai3: selective requirement of Orai3 versus Orai1 in estrogen receptor-positive versus estrogen receptor-negative breast cancer cells . J Biol Chem.
2010; ; 285 : :19173.-19183. 13.
Bandyopadhyay
BC
,
Pingle
SC
,
Ahern
GP
. Store-operated Ca2+ signaling in dendritic cells occurs independently of STIM1 . J Leukoc Biol.
2011; ; 89 : :57.-62. 14.
Vassort
G
,
Fauconnier
J
. Les canaux TRP (transient receptor potential) : une nouvelle famille de canaux à expression variée . Med Sci (Paris).
2008; ; 24 : :163.-168. 15.
Cahalan
MD
. Cell biology. How to STIMulate calcium channels . Science.
2010; ; 330 : :43.-4. 16.
Feng
M
,
Grice
DM
,
Faddy
HM
, et al.
Store-independent activation of Orai1 by SPCA2 in mammary tumors . Cell.
2010; ; 143 : :84.-98. 17.
Srikanth
S
,
Jung
HJ
,
Kim
KD
, et al.
A novel EF-hand protein, CRACR2A, is a cytosolic Ca2+ sensor that stabilizes CRAC channels in T cells . Nat Cell Biol.
2010; ; 12 : :436.-446. 18.
Vaca
L
. SOCIC: the store-operated calcium influx complex . Cell Calcium.
2010; ; 47 : :199.-209. 19.
Le Deist
F
,
Hivroz
C
,
Partiseti
M
, et al.
A primary T-cell immunodeficiency associated with defective transmembrane calcium influx . Blood.
1995; ; 85 : :1053.-1062. 20.
Feske
S
,
Gwack
Y
,
Prakriya
M
, et al.
A mutation in Orai1 causes immune deficiency by abrogating CRAC channel function . Nature.
2006; ; 441 : :179.-185. 21.
McCarl
CA
,
Picard
C
,
Khalil
S
, et al.
ORAI1 deficiency and lack of store-operated Ca2+ entry cause immunodeficiency, myopathy, and ectodermal dysplasia . J Allergy Clin Immunol.
2009; ; 124 : :1311.-1318. 22.
Picard
C
,
McCarl
CA
,
Papolos
A
, et al.
STIM1 mutation associated with a syndrome of immunodeficiency and autoimmunity . N Engl J Med.
2009; ; 360 : :1971.-1980. 23.
Byun
M
,
Abhyankar
A
,
Lelarge
V
, et al.
Whole-exome sequencing-based discovery of STIM1 deficiency in a child with fatal classic Kaposi sarcoma . J Exp Med.
2010; ; 207 : :2307.-12. 24.
Feske
S
,
Muller
JM
,
Graf
D
, et al.
Severe combined immunodeficiency due to defective binding of the nuclear factor of activated T cells in T lymphocytes of two male siblings . Eur J Immunol.
1996; ; 26 : :2119.-2126. 25.
Gwack
Y
,
Srikanth
S
,
Oh-Hora
M
, et al.
Hair loss and defective T- and B-cell function in mice lacking ORAI1 . Mol Cell Biol.
2008; ; 28 : :5209.-5222. 26.
Feske
S
,
Picard
C
,
Fischer
A
. Immunodeficiency due to mutations in ORAI1 and STIM1 . Clin Immunol.
2010; ; 135 : :169.-182. 27.
Maul-Pavicic
A
,
Chiang
SC
,
Rensing-Ehl
A
, et al.
ORAI1-mediated calcium influx is required for human cytotoxic lymphocyte degranulation and target cell lysis . Proc Natl Acad Sci USA.
2011; ; 108 : :3324.-3329. 28.
Oh-Hora
M
,
Yamashita
M
,
Hogan
PG
, et al.
Dual functions for the endoplasmic reticulum calcium sensors STIM1 and STIM2 in T cell activation and tolerance . Nat Immunol.
2008; ; 9 : :432.-443. 29.
Tone
Y
,
Furuuchi
K
,
Kojima
Y
, et al.
Smad3 and NFAT cooperate to induce Foxp3 expression through its enhancer . Nat Immunol.
2008; ; 9 : :194.-202. 30.
Aubart
FC
,
Sassi
Y
,
Coulombe
A
, et al.
RNA interference targeting STIM1 suppresses vascular smooth muscle cell proliferation and neointima formation in the rat . Mol Ther.
2009; ; 17 : :455.-462. 31.
El Boustany
C
,
Katsogiannou
M
,
Delcourt
P
, et al.
Differential roles of STIM1, STIM2 and Orai1 in the control of cell proliferation and SOCE amplitude in HEK293 cells . Cell Calcium.
2010; ; 47 : :350.-359. 32.
Faouzi
M
,
Hague
F
,
Potier
M
, et al.
Down-regulation of Orai3 arrests cell-cycle progression and induces apoptosis in breast cancer cells but not in normal breast epithelial cells . J Cell Physiol.
2011; ; 226 : :542.-551. 33.
El Boustany
C
,
Bidaux
G
,
Enfissi
A
, et al.
Capacitative calcium entry and transient receptor potential canonical 6 expression control human hepatoma cell proliferation . Hepatology.
2008; ; 47 : :2068.-2077. |