| |
| Med Sci (Paris). 2011 August; 27(8-9): 763–770. Published online 2011 August 31. doi: 10.1051/medsci/2011278019.Imagerie et cognition (6) - Neuro-imagerie et neuroscience des émotions Swann Pichon1,2* and Patrik Vuilleumier1,2** 1Laboratoire de neurologie du comportement et de neuro-imagerie cognitive, département de neurosciences, Faculté de médecine, Université de Genève, Suisse 2Département de neurologie, hôpital universitaire de Genève ; Centre national suisse de sciences affectives, Université de Genève, Suisse |
L’essor des techniques de neuro-imagerie fonctionnelle (NiF, c’est-à-dire IRMf, EEG, MEG, PET1) [
1] a permis d’étudier l’organisation cérébrale de fonctions longtemps méconnues. Ces progrès ont notamment favorisé un développement majeur dans l’étude des émotions et du comportement social humain, autrefois considérés comme hors de portée des investigations scientifiques car étroitement liés aux aspects les plus privés et subjectifs du fonctionnement mental. Ces développements ont conduit à l’émergence de nouvelles disciplines regroupées sous les étiquettes de « neurosciences affectives » et « neurosciences sociales ». Celles-ci impliquent une approche résolument intégrative dont l’enjeu est de comprendre comment les facteurs biologiques (des gènes jusqu’aux circuits cérébraux) interagissent avec l’environnement et contribuent au développement de compétences émotionnelles, aux niveaux individuel et interpersonnel. Ces recherches offrent également un nouvel éclairage sur les mécanismes de la prise de décision, ainsi que sur les conséquences de leur altération dans certaines pathologies neuropsychiatriques. Mais comment définit-on une émotion et combien en existe-t-il ? Le cerveau, à l’instar des autres organes du corps, est un produit de l’évolution. Son développement a permis l’émergence de compétences de plus en plus élaborées, améliorant l’adaptation de l’espèce à son environnement, tant physique que social. Au niveau de l’individu, les fonctions affectives, qui prennent racine dans des systèmes motivationnels plus élémentaires (par exemple la faim, la douleur), peuvent être considérées comme des modes de l’action permettant une adaptation efficace face aux demandes changeantes de l’environnement [1]. Au niveau du groupe, les signaux affectifs sont un vecteur important de communication non verbale et participent à la régulation des interactions interindividuelles. Toutefois, les théories contemporaines divergent encore sur la nature exacte des émotions, par rapport à d’autres états mentaux. Une définition relativement générale [
2] propose que « les émotions sont le résultat d’interactions entre facteurs subjectifs et objectifs, réalisées au sein de systèmes neuronaux ou endocriniens, qui peuvent : (a) induire des expériences telles que des sentiments de plaisir ou de déplaisir ; (b) influencer des processus cognitifs tels que mémoire, niveaux d’attention, évaluations, ou catégorisations ; (c) causer des ajustements physiologiques globaux ; (d) induire des comportements qui sont, le plus souvent, expressifs et adaptatifs ». De nombreux modèles psychologiques ont tenté de formaliser une description exhaustive des affects. Dans la lignée des travaux de Darwin, Paul Ekman a montré que certaines expressions du visage sont exprimées universellement (joie, colère, tristesse, dégoût, peur, surprise). S’il existe bien entendu des différences interculturelles et interindividuelles importantes, l’idée que les émotions sont déterminées biologiquement et modulées par l’expérience et la culture est aujourd’hui largement acceptée [
3]. Certaines théories dimensionnelles conceptualisent l’organisation des différentes émotions comme le reflet d’un continuum qui serait défini par un nombre limité de dimensions tel le degré d’éveil (excité versus calme) ou la valence (positif versus négatif). Les théories catégorielles en revanche envisagent les émotions comme des phénomènes discrets. Elles distinguent les émotions primaires ou fondamentales des émotions secondaires attribuées à des combinaisons d’émotions de base. Ces modèles restent néanmoins vagues quant à la manière dont ces catégories ou ces dimensions s’organisent sur le plan cérébral. Le développement de la NiF, a grandement contribué à compléter, voire transformer, ces modèles traditionnels en affinant les connaissances neuroanatomiques associées aux différentes émotions. |
À la découverte de l’anatomie cérébrale des fonctions affectives L’approche neurobiologique des fonctions affectives remonte aux travaux des physiologistes Walter Cannon et Philipp Bard qui ont montré l’influence de l’hypothalamus sur les comportements de peur et d’agressivité chez l’animal. À leur suite, le début du xx
e siècle a vu naître la définition de circuits cérébraux spécifiquement impliqués dans l’expression des émotions mais aussi l’apprentissage, souvent centrés sur des régions sous-corticales ou corticales médiales (correspondant au système limbique de Broca et Papez) et supposément partagées avec d’autres espèces plus primitives (MacLean). Plus récemment, en parallèle avec les théories postulant l’existence d’un nombre limité d’émotions primaires, certains chercheurs comme Jaak Panksepp [
4] ont décrit sept circuits fonctionnels distincts : quatre seraient pré-mammaliens (peur, rage, recherche et désir) et trois autres seraient liés à l’expansion des régions limbiques des mammifères (maternance, jeu, panique). Ces travaux ont instauré les premiers fondements empiriques de certains modèles actuels selon lesquels chaque émotion dépendrait de modules neuronaux spécifiques, potentiellement communs aux mammifères. L’avènement de la NiF chez l’homme a, dans une première phase, fortement contribué à renforcer ces modèles en montrant l’activation sélective de certaines structures en relation avec des catégories primaires d’émotion : c’est le cas de l’amygdale pour la peur et du striatum ventral pour le plaisir, de l’insula pour le dégoût et du cortex cingulaire antérieur pour la tristesse [
5]. Toutefois, les données récentes ont permis d’établir que la plupart des régions impliquées dans les processus affectifs tendent à participer à plusieurs catégories d’émotions, suggérant qu’elles codent pour des composantes plus élémentaires dont la combinaison flexible sous-tend les évaluations, expériences et comportements associés aux différentes émotions définies au niveau psychologique [
6]. Ainsi, un apport important de la recherche actuelle en Nif est précisément de permettre de mieux caractériser les propriétés fonctionnelles des différentes régions cérébrales concernées, en testant par exemple si leur degré d’activation dépend du type de valence ou d’éveil associé à une émotion particulière. Nous présentons ci-après un bref aperçu des approches expérimentales utilisées en NiF. Nous exposons ensuite un résumé succinct des régions cérébrales le plus souvent impliquées (Figure 1), en soulignant leur rôle présumé et en discutant comment elles interviennent dans différentes situations émotionnelles. Ce résumé n’est pas exhaustif, mais essentiellement illustratif. Du reste, bien qu’il soit encore courant de distinguer des régions cérébrales « émotionnelles » et d’autres plutôt « cognitives », cette vision dichotomique est relativement schématique. En effet, l’un des apports de la NiF a été de montrer l’importance des interactions entre régions néocorticales traditionnellement associées aux fonctions cognitives et régions dites « limbiques » associées aux émotions, dont certaines (comme l’amygdale) entretiennent des relations directes avec l’ensemble du cerveau, y compris les cortex sensoriels et moteurs.
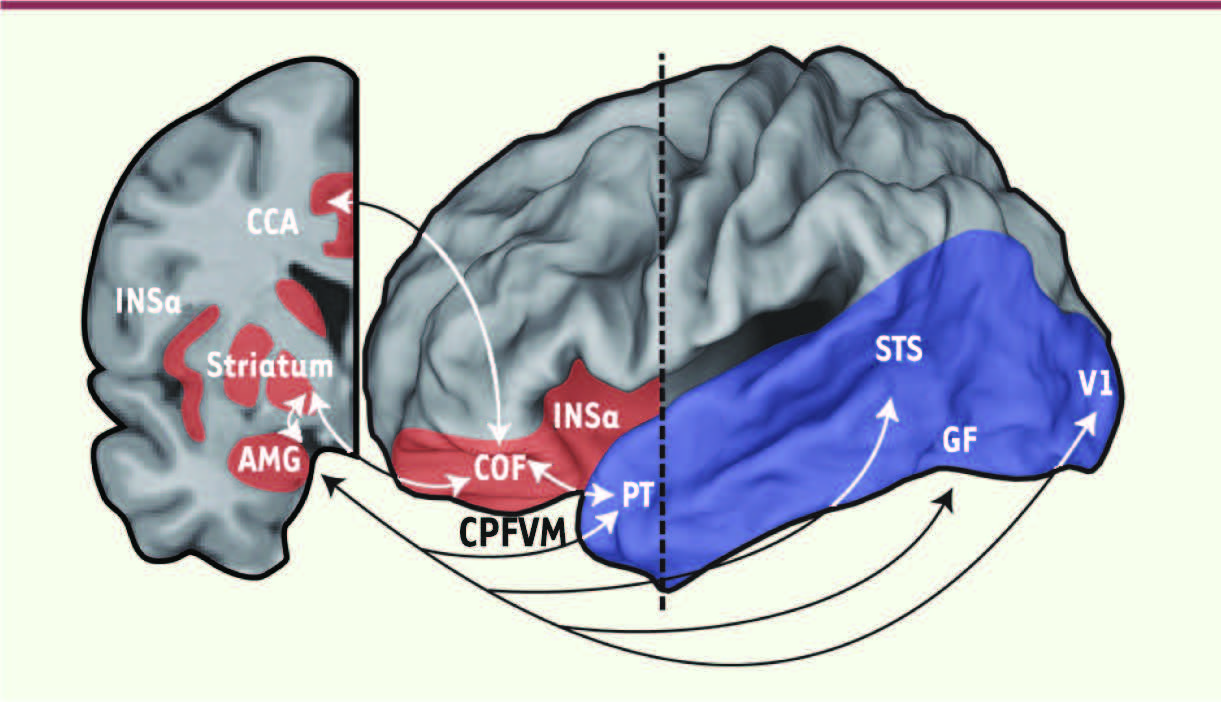
 | Figure 1.
Principales structures cérébrales impliquées dans les processus affectifs (en rouge). Chacune de ces régions contribue par des aspects distincts à l’évaluation affective des signaux sensoriels ainsi qu’à la régulation émotionnelle. L’amygdale (AMG) reçoit des projections des aires corticales sensorielles (visuelles, auditives, etc.) de haut niveau et projette à son tour sur l’ensemble du lobe temporal et occipital (en bleu). Ces projections contribuent à favoriser l’interaction entre les processus affectifs et perceptifs. COF : cortex orbitofrontal, CPFVM : cortex préfrontal ventromédial (non visible), INSa : insula antérieure, CCA : cortex cingulaire antérieur, PT : pôle temporal, STS : sulcus temporal supérieur, GF : gyrus fusiforme (non visible), V1 : aire visuelle V1. |
|
La plupart des recherches en NiF étudient la perception d’informations émotionnelles au moyen de stimulus visuels (photos d’expressions faciales ou corporelles, scènes ou films), auditifs (voix, musique) et plus rarement dans d’autres modalités (olfaction, douleur). Elles emploient aussi des protocoles de conditionnement ou de renforcement comparables à ceux qui sont utilisés chez l’animal. Différents facteurs expérimentaux peuvent être manipulés afin de définir quel type d’information ou de traitement affecte l’activité d’une région cérébrale donnée : par exemple le type de tâche (traitement explicite versus implicite), d’attention (focalisée versus détournée), le degré de traitement (conscient versus subliminal), ou encore le contenu émotionnel et physique du stimulus (expression faciale versus corporelle, faible versus intense) [
7]. Certaines études s’intéressent également à l’expérience des émotions et corrèlent généralement l’activité cérébrale avec des évaluations subjectives ou des tâches de régulation qui demandent au sujet d’amplifier, d’inhiber, ou de transformer les sentiments évoqués expérimentalement. Enfin, une approche qui tend à se développer consiste à réaliser ces corrélations avec des caractéristiques individuelles comme la personnalité, certains traits génétiques, ou l’administration de substances psychotropes. Au cours des vingt dernières années, la convergence de ces différents paradigmes a transformé nos connaissances sur le rôle des régions cérébrales impliquées dans les processus affectifs et permet progressivement de traduire, ou parfois de remplacer, les modèles psychologiques par des modèles biologiques fonctionnels, dynamiques et distribués. |
Plusieurs régions cérébrales sont systématiquement impliquées dans différentes émotions ou situations expérimentales (Figure 1). Nous résumerons brièvement l’état actuel des connaissances concernant leurs rôles respectifs. Amygdale, menace et attention Logée dans la partie antéromédiale du lobe temporal, l’amygdale (AMG) est fortement impliquée dans la peur et l’anxiété. Elle est indispensable au conditionnement aversif [
8]. Sa lésion perturbe l’évaluation du danger et l’apprentissage d’une réponse de peur adaptée au contexte [
9]. Chez l’homme, l’amygdale est habituellement activée par la perception d’expressions faciales ou vocales de peur [ 7]. Elle est aussi associée à l’aversion d’une perte monétaire, la confiance accordée à un inconnu, ou encore la régulation de l’espace interpersonnel. Ces résultats montrent comment l’évolution semble avoir intégré des fonctions élémentaires (peur et conditionnement) au profit de fonctions plus élaborées (comportement social et prise de décision). Toutefois, le rôle de l’AMG ne se limite pas aux émotions négatives. Celle-ci répond également à des stimulus appétitifs [
10] ou à l’humour [
11]. Ainsi, les résultats de NiF ont conduit à proposer que l’AMG contribue à représenter de manière flexible la valeur d’un stimulus, et en particulier son importance ( relevance) pour les besoins de l’organisme [
12]. L’AMG, par ses projections, influence un grand nombre de systèmes cérébraux : cortex sensoriels pour la perception, hippocampe pour la mémoire, noyaux adrénergiques pour l’éveil, hypothalamus pour les hormones de stress (par exemple le cortisol). À ce titre, elle est impliquée dans les processus d’orientation attentionnelle involontaires [7]. Une fonction cardinale de l’attention est d’augmenter (volontairement ou non) la « saillance » d’un percept afin de maximiser son traitement et de minimiser l’interférence par des informations non pertinentes. Face à un stimulus émotionnel, en particulier négatif, un effet attentionnel similaire résulte de l’activation de l’AMG. C’est le cas par exemple des stimulus phobiques, des visages exprimant la peur, ou des gestes signalant la colère. On considère souvent que la réponse de l’AMG est rapide et en partie automatique grâce à l’existence de deux voies afférentes distinctes, l’une sous-corticale rapide, l’autre corticale plus lente. Ces réponses rapides permettent à l’AMG d’augmenter l’activité des régions sensorielles (par exemple visuelles) impliquées dans la perception du stimulus, grâce à ses projections en retour sur l’ensemble du lobe temporal et occipital. Elle accroît ainsi la « saillance » du stimulus et favorise l’orientation de l’attention vers la source du danger. L’IRMf a montré que des patients ayant une lésion de l’amygdale, à l’inverse de ceux qui ont une lésion de l’hippocampe, ne montrent plus cette modulation [7]. Par ses effets sur le cortex et l’hippocampe, l’AMG influence aussi la mémorisation. Le complexe amygdalo-hippocampique est en effet densément interconnecté, facilitant ainsi l’encodage des événements émotionnels. La NiF a ainsi permis de montrer que l’hyperréactivité de l’AMG (et d’autres régions frontales) est associée à la physiopathologie des troubles anxieux [
13] (Figure 2).
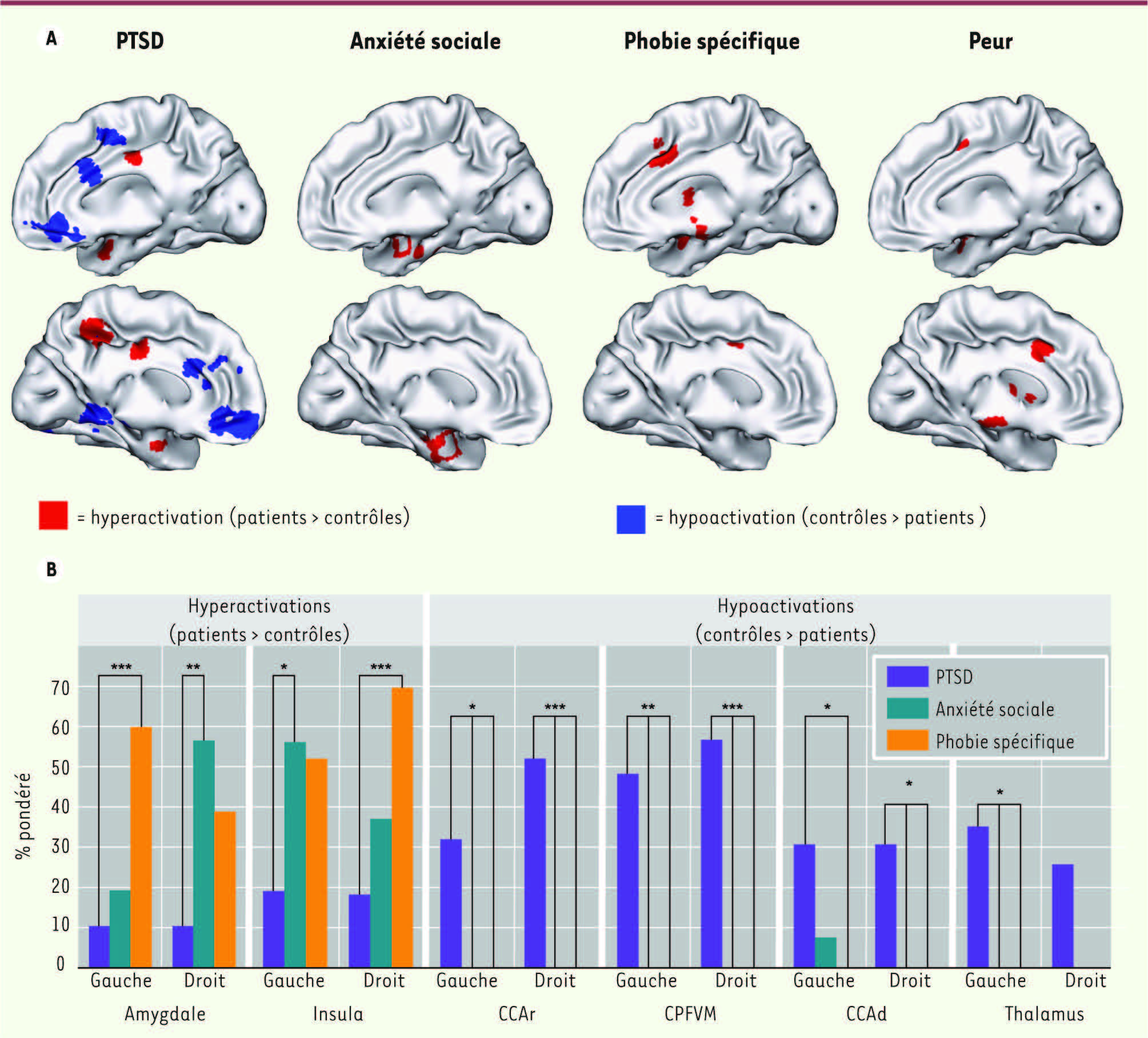
 | Figure 2.
Différents réseaux des troubles anxieux. A. Des hypo et hyperactivations distinctes sont présentes dans les régions amygdaliennes (AMG), les cortex préfrontal ventromédial (CPFVM) et cingulaire antérieur dorsal et rostral (CCAd et CCAr) chez des patients atteints de différents troubles anxieux : stress post-traumatique (PTSD), anxiété sociale ou phobie spécifique (serpents, araignées). Ces changements sont partiellement similaires aux activations observées chez des sujets sains recevant un conditionnement aversif (peur). B. Comparés aux sujets sains, les sujets souffrant d’anxiété sociale ou de phobie spécifique présentent plus fréquemment des hyperactivations de l’amygdale et de l’insula (à gauche ou à droite). À l’inverse, les patients PTSD présentent une hypoactivation du CPFVM et du CCA bilatéralement (adapté de [ 13] avec la permission de l’ American Journal of Psychiatry). |
Striatum, dopamine et émotions positives À l’inverse, le striatum ventral (STV) et les afférences dopaminergiques qu’il reçoit de l’aire tegmentale ventrale (ATV) du mésencéphale constituent un circuit sous-cortical étroitement lié au plaisir et à la récompense [
14]. La neurophysiologie chez le singe et la NiF chez l’homme ont révélé que les signaux dopaminergiques phasiques au sein du STV reflètent en fait une erreur de prédiction : ce signal est marqué lorsqu’une récompense inattendue survient, mais s’amenuise puis disparaît à mesure que sa prédictibilité s’accroît [
15]. À l’inverse, cette activité est inhibée lorsqu’une récompense attendue manque. Les neurones dopaminergiques de l’ATV (comme le striatum et les autres ganglions de la base) projettent aussi directement sur l’ensemble du cortex préfrontal, l’informant d’évènements motivationnels et modulant son activité. Ces signaux jouent un rôle important dans l’apprentissage et la prise de décision, notamment lorsqu’un choix (par exemple économique) doit être fait en fonction de récompenses possibles. Les voies ATV-STV sont également activées par l’écoute d’une musique plaisante, le visage d’une personne aimée ou attirante, ou encore par une décision altruiste ou charitable. Ces observations montrent ainsi que des expériences positives de natures très différentes recrutent ces structures de façon similaire. On notera que le striatum est également impliqué dans certains apprentissages aversifs et la colère. Des anomalies au sein de ces voies ont également été associées aux addictions et à la dépression. Cortex orbitofrontal (COF), préfrontal ventromédial (CPFVM) et régulation émotionnelle Le COF est fortement connecté avec l’ensemble des cortex sensoriels, le lobe temporal et des structures sous-corticales comme l’AMG et le STV. C’est un acteur essentiel permettant l’intégration de la valeur affective des informations sensorielles. Il est au cœur des processus décisionnels. Si le COF répond aux signaux de récompense comme les voies STV-ATV, son activité est plus sensible à la valeur relative de la récompense lorsqu’une décision confronte par exemple deux choix récompensés. Le COF joue par conséquent un rôle important dans la régulation des affects et des conduites sociales [
16,
17], notamment en anticipant les émotions associées à différentes actions potentielles. Le COF latéral et le gyrus frontal inférieur participent également à l’inhibition et à la modification des réponses comportementales lorsque celles-ci cessent d’être récompensées, expliquant l’impulsivité et la « sociopathie » observées lors de telles lésions [ 17]. Ces régions répondent aussi à des signaux sociaux négatifs : la colère d’autrui, la violation de normes, ou encore la culpabilité [ 17-
19]. D’autres aires voisines du CMF exercent un contrôle inhibiteur direct sur l’activité de l’AMG, critique pour l’extinction des peurs conditionnées [
20]. Les connexions du CPFVM avec l’hypothalamus et la substance grise périaqueducale en font aussi un centre majeur du contrôle de l’humeur et des réactions viscéro-motrices. Avec le cortex cingulaire antérieur (CCA), il contribue à la régulation affective [
21] et à l’adaptation à des situations stressantes [
22]. Par exemple, à la suite du visionnage de films négatifs, la connectivité de ces circuits est altérée chez des individus sains [
23]. Des altérations semblables sont observables au repos chez des sujets anxieux ou déprimés [21]. Insula, intéroception et états affectifs L’insula joue un rôle-clé dans la représentation corticale des informations intéroceptives (c’est-à-dire viscérales, thermiques, nociceptives, etc.). Son activité prédit par exemple l’acuité avec laquelle un individu rapporte sa fréquence cardiaque [
24]. Tandis que sa partie postérieure code l’aspect sensoriel d’une stimulation thermique (par exemple en degrés), sa partie antérieure représente davantage l’évaluation subjective de la douleur [
25]. L’insula antérieure est également activée par l’observation de la douleur d’autrui, suggérant un lien avec l’empathie [
26]. De même, elle répond à l’évocation du dégoût par des stimulus déplaisants ou l’observation du dégoût d’autrui, et sa destruction cause une perte du dégoût. Toutefois, les études récentes de NiF suggèrent que l’insula antérieure est associée à un spectre d’états émotionnels subjectifs plus large, y compris la tristesse, l’observation de stimulus érotiques, les choix en situation incertaine ou le fait de commettre des erreurs lors de tâches cognitives. Ces résultats ont amené à reconcevoir la fonction de l’insula antérieure comme un site impliqué dans la représentation des états émotionnels, dans leur prédiction, et qui serait à la base de l’expérience consciente des sentiments subjectifs [
27]. |
Implications pour la recherche et les applications cliniques en psychiatrie La pathogenèse de nombreux troubles mentaux comme la dépression, la schizophrénie, l’autisme ou l’anxiété implique au moins en partie une altération des fonctions émotionnelles et sociales [21,
28-
30]. Si l’identification d’anomalies cérébrales commence seulement, le développement de notre connaissance des circuits fonctionnels permet d’envisager une description neurobiologique beaucoup plus élaborée des dysfonctions psychiques que ce qui est actuellement possible, sur la base des symptômes cliniques et des observations histopathologiques post-mortem. Par exemple, les études de NiF chez des patients dépressifs ont révélé des anomalies systématiques dans le CPFVM et l’amygdale [21], sous forme d’une hyperactivité (au repos ou en réponse à des stimulus émotionnels) par rapport aux sujets sains ou aux phases de rémission. Ces anomalies correspondent au biais émotionnel négatif de ces patients quand ils réalisent des tâches perceptives et mnésiques. Ces observations ont motivé l’implantation d’électrodes pour moduler l’activité du CPFVM ventral chez des déprimés sévères, avec un succès remarquable [
31]. De même, la comparaison des activations cérébrales lors de différents troubles anxieux permet de suggérer des mécanismes distincts à l’origine des symptômes [13] (Figure 2) : les phobies impliqueraient une hyperréactivité de l’AMG et de l’insula, tandis que le syndrome de stress post-traumatique impliquerait davantage un déficit de régulation des expériences négatives dû à une hypo-activation du CPFVM. Une modulation des réponses des structures impliquées dans la peur ou la récompense est également observable chez des sujets sains selon leurs traits de personnalité (par exemple l’extraversion) ou des dispositions affectives particulières (impulsivité, attachement ; voir
Figure 3
).
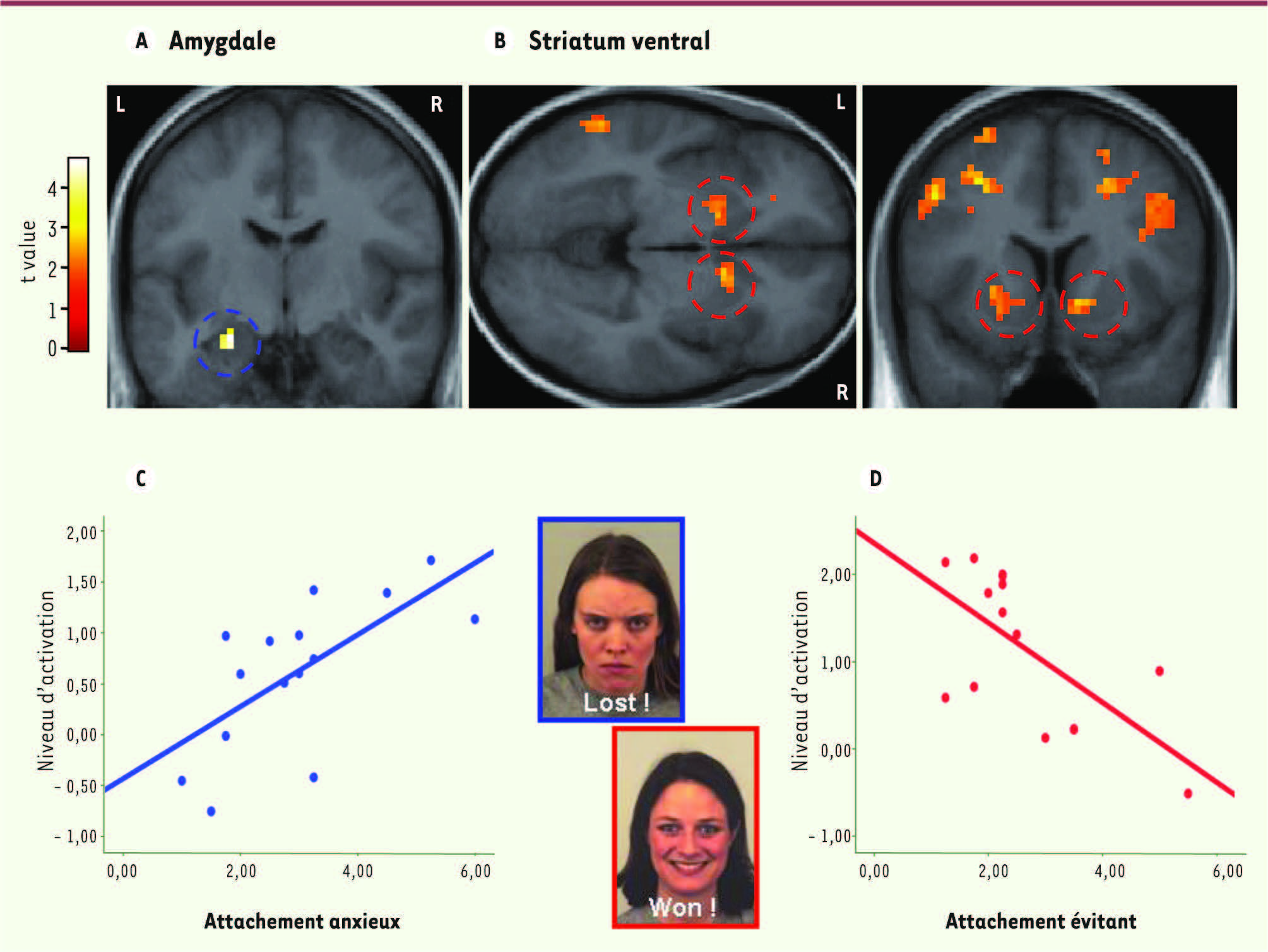
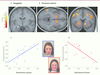 | Figure 3.
Effets de traits de personnalité chez des sujets sains. A. Activation de l’amygdale lorsque des visages exprimant la colère sont présentés suite à une erreur lors d’une tâche cognitive, et (B) du striatum ventral lorsque des visages exprimant la joie sont présentés suite à une performance correcte, reflétant la réponse affective du sujet à des signaux sociaux de sanction ou de récompense. C. L’intensité de l’activation de l’amygdale est proportionnelle à une mesure d’anxiété sociale correspondant à un style d’attachement anxieux et une peur de rejet social. D. À l’inverse, l’activation du striatum est réduite lorsque la personnalité du sujet est caractérisée par un style d’attachement évitant, qui implique un retrait social et une défiance d’autrui (adapté de [
36]). |
La NiF offre ainsi la possibilité de détecter des anomalies ou des variations de réponses cérébrales associées à des états précliniques ou même génétiques qui pourraient traduire des risques augmentés de pathologie. Par exemple, l’activité de l’AMG et du CPFVM est accrue chez des sujets porteurs de gènes qui modifient la concentration synaptique de sérotonine et augmentent le risque de troubles anxiodépressifs [
32]. La NiF est donc certainement appelée à jouer un rôle grandissant dans l’évaluation de biomarqueurs de certaines maladies ou de leur traitement. Des progrès sont aussi possibles dans les méthodes d’analyse : dans le domaine de la classification automatisée d’images par exemple, qui a déjà montré une fiabilité de diagnostic supérieure à l’humain (maladie d’Alzheimer [
33]) et qui permet d’identifier des symptômes précliniques de neuro-dégénération (maladie de Huntington [
34]). À l’avenir, il est envisageable que certains marqueurs fonctionnels soient utilisés non seulement comme aide au diagnostic, mais aussi pour le suivi thérapeutique, l’évaluation de l’efficacité des psychothérapies ou le pronostic de la réponse à un traitement pharmacologique [
35]. De plus, les techniques de NiF permettent d’envisager une modulation cérébrale locale au moyen de neurofeedback, c’est-à-dire en donnant au sujet (ou au patient) la possibilité de visualiser et de contrôler en temps réel l’activité d’une région donnée. Cette approche pourrait avoir un rôle utile pour influencer la plasticité de régions cibles. |
La NiF permet non seulement d’établir une cartographie de plus en plus détaillée des circuits cérébraux impliqués dans les émotions, mais aussi de mieux définir la contribution de chaque région, leur modulation par des facteurs expérimentaux ou cliniques, et leur corrélation avec les différences interindividuelles liées au comportement ou à la personnalité. Il devient envisageable que ces données puissent aussi avoir des implications nosologiques en questionnant les catégories nosographiques actuelles et en contribuant à identifier des corrélats cérébraux plus spécifiques des symptômes psychiatriques chez des patients différents. Enfin, en permettant des comparaisons avec les données neurobiologiques chez l’animal en termes neuroanatomiques plutôt que strictement comportementaux ou symptomatiques, la neuro-imagerie offre un outil précieux pour faciliter la recherche translationnelle. Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1.
Levenson
RW
. The intrapersonal functions of emotion . Cogn Emot.
1999; ; 13 : :481.-504. 2.
Kleinginna
PR
,
Kleinginna
AM
. A categorized list of emotion definitions, with suggestions for a consensual definition . Motiv Emot.
1981; ; 5 : :345.-379. 3.
Kuppens
P
,
Ceulemans
E
,
Timmerman
ME
, et al.
Universal intracultural and intercultural dimensions of the recalled frequency of emotional experience . J Cross Cult Psychol.
2006; ; 37 : :491.-515. 4.
Panksepp
J
. Affective neuroscience: the foundation of human and animal emotions.
1998 ; New York: : Oxford University Press; . 5.
Calder
AJ
,
Lawrence
AD
,
Young
AW
. Neuropsychology of fear and loathing . Nat Rev Neurosci.
2001; ; 2 : :352.-363. 6.
Scherer
KR
. On the nature and function of emotion: a component process approach . In :
Scherer
KR
,
Ekman
P
, eds.
Approaches to emotion . Hillsdale: : Lawrence Erlbaum; , 1984 : :293.-317. 7.
Vuilleumier
P
,
Schwartz
S
,
Duhoux
S
, et al.
Selective attention modulates neural substrates of repetition priming and implicit visual memory: suppressions and enhancements revealed by FMRI . J Cogn Neurosci.
2005; ; 17 : :1245.-1260. 8.
LeDoux
JE
,
Cicchetti
P
,
Xagoraris
A
,
Romanski
LM
. The lateral amygdaloid nucleus: sensory interface of the amygdala in fear conditioning . J Neurosci.
1990; ; 10 : :1062.-1069. 9.
Phelps
EA
,
LeDoux
JE
. Contributions of the amygdala to emotion processing: from animal models to human behavior . Neuron.
2005; ; 48 : :175.-187. 10.
Sergerie
K
,
Chochol
C
,
Armony
JL
. The role of the amygdala in emotional processing: A quantitative meta-analysis of functional neuroimaging studies . Neurosci Biobehav Rev.
2008; ; 32 : :811.-830. 11.
Schwartz
S
,
Ponz
A
,
Poryazova
R
, et al.
Abnormal activity in hypothalamus and amygdala during humour processing in human narcolepsy with cataplexy . Brain.
2008; ; 131 : :514.-522. 12.
Sander
D
,
Grafman
J
,
Zalla
T
. The human amygdala: an evolved system for relevance detection . Rev Neurosci.
2003; ; 14 : :303.-316. 13.
Etkin
A
,
Wager
TD
. Functional neuroimaging of anxiety: a meta-analysis of emotional processing in PTSD, social anxiety disorder, and specific phobia . Am J Psychiatry.
2007; ; 164 : :1476.-1488. 14.
Kringelbach
ML
,
Berridge
KC
. Towards a functional neuroanatomy of pleasure and happiness . Trends Cogn Sci.
2009; ; 13 : :479.-487. 15.
Schultz
W
. Getting formal with dopamine and reward . Neuron.
2002; ; 36 : :241.-263. 16.
Damasio
AR
. Descartes’ error: emotion, rationality and the human brain . New York: : Grosset/Putnam; , 1994. 17.
Blair
RJR
. The roles of orbital frontal cortex in the modulation of antisocial behavior . Brain Cogn.
2004; ; 55 : :198.-208. 18.
Berthoz
S
,
Armony
JL
,
Blair
RJ
,
Dolan
RJ
. An fMRI study of intentional and unintentional (embarrassing) violations of social norms . Brain.
2002; ; 125 : :1696.-1708. 19.
Pichon
S
,
de Gelder
B
,
Grèzes
J
. Threat prompts defensive brain responses independently of attentional control . Cereb Cortex.
2011 ( sous presse.). 20.
Quirk
GJ
,
Beer
JS
. Prefrontal involvement in the regulation of emotion: convergence of rat and human studies . Curr Opin Neurobiol.
2006; ; 16 : :723.-727. 21.
Drevets
WC
,
Price
JL
,
Furey
ML
. Brain structural and functional abnormalities in mood disorders: implications for neurocircuitry models of depression . Brain Struct Funct.
2008; ; 213 : :93.-118. 22.
Bishop
SJ
. Neural mechanisms underlying selective attention to threat . Ann NY Acad Sci.
2008; ; 1129 : :141.-152. 23.
Eryilmaz
H
,
Van De Ville
D
,
Schwartz
S
,
Vuilleumier
P
. Impact of transient emotions on functional connectivity during subsequent resting state: A wavelet correlation approach . NeuroImage.
2011; ; 54 : :2481.-2491. 24.
Critchley
HD
,
Wiens
S
,
Rotshtein
P
, et al.
Neural systems supporting interoceptive awareness . Nat Neurosci.
2004; ; 7 : :189.-195. 25.
Craig
AD
,
Chen
K
,
Bandy
D
,
Reiman
EM
. Thermosensory activation of insular cortex . Nat Neurosci.
2000; ; 3, :184.-190. 26.
Gallese
V
,
Keysers
C
,
Rizzolatti
G
. A unifying view of the basis of social cognition . Trends Cogn Sci.
2004; ; 8 : :396.-403. 27.
Singer
T
,
Critchley
HD
,
Preuschoff
K
. A common role of insula in feelings, empathy and uncertainty . Trends Cogn Sci.
2009; ; 13 : :334.-340. 28.
Davidson
RJ
,
Lewis
DA
,
Alloy
LB
, et al.
Neural and behavioral substrates of mood and mood regulation . Biol Psychiatry.
2002; ; 52 : :478.-502. 29.
Zilbovicius
M
,
Meresse
I
,
Chabane
N
, et al.
Autism, the superior temporal sulcus and social perception . Trends Neurosci.
2006; ; 29 : :359.-366. 30.
Uhlhaas
PJ
,
Singer
W
. Abnormal neural oscillations and synchrony in schizophrenia . Nat Rev Neurosci.
2010; ; 11 : :100.-113. 31.
Ressler
KJ
,
Mayberg
HS
. Targeting abnormal neural circuits in mood and anxiety disorders: from the laboratory to the clinic . Nat Neurosci.
2007; ; 10 : :1116.-1124. 32.
Pezawas
L
,
Meyer-Lindenberg
A
,
Drabant
EM
, et al.
5-HTTLPR polymorphism impacts human cingulate-amygdala interactions: a genetic susceptibility mechanism for depression . Nat Neurosci.
2005; ; 8 : :828.-834. 33.
Klöppel
S
,
Stonnington
CM
,
Barnes
J
, et al.
Accuracy of dementia diagnosis: a direct comparison between radiologists and a computerized method . Brain.
2008; ; 131 : :2969.-2974. 34.
Klöppel
S
,
Chu
C
,
Tan
GC
, et al.
Automatic detection of preclinical neurodegeneration: presymptomatic Huntington disease . Neurology.
2009; ; 72 : :426.-431. 35.
Desseilles
M
. Méthodes d’évaluation de l’efficacité des psychothérapies: impact de la neuroimagerie fonctionnelle . Neurone.
2010; ; 15 : :1.-4. 36.
Vrticka
P
,
Andersson
F
,
Grandjean
D
, et al.
Individual attachment style modulates human amygdala, striatum activation during social appraisal . PLoS One.
2008; ; 3 : :e2868.. |