| |
| Med Sci (Paris). 2012 January; 28(1): 11–13. Published online 2012 January 27. doi: 10.1051/medsci/2012281003.Immunothérapie et anticorps monoclonaux Quand les récepteurs Fc s’emmêlent Jean-Luc Teillaud1* 1Inserm U872, centre de recherche des Cordeliers, université Pierre et Marie Curie - Paris 6, université Paris-Descartes, UMRS 872, Paris, 75006France MeSH keywords: Animaux, Anticorps monoclonaux, immunologie, usage thérapeutique, Antigènes CD40, Antigènes néoplasiques, Lymphocytes T CD8+, Cellules dendritiques, Gènes d'immunoglobuline, Humains, Immunothérapie, Activation des lymphocytes, Mélanome expérimental, thérapie, Souris, Souris knockout, Modèles immunologiques, Tumeurs, Récepteur Fc, Récepteurs du fragment Fc des IgG, déficit, génétique |
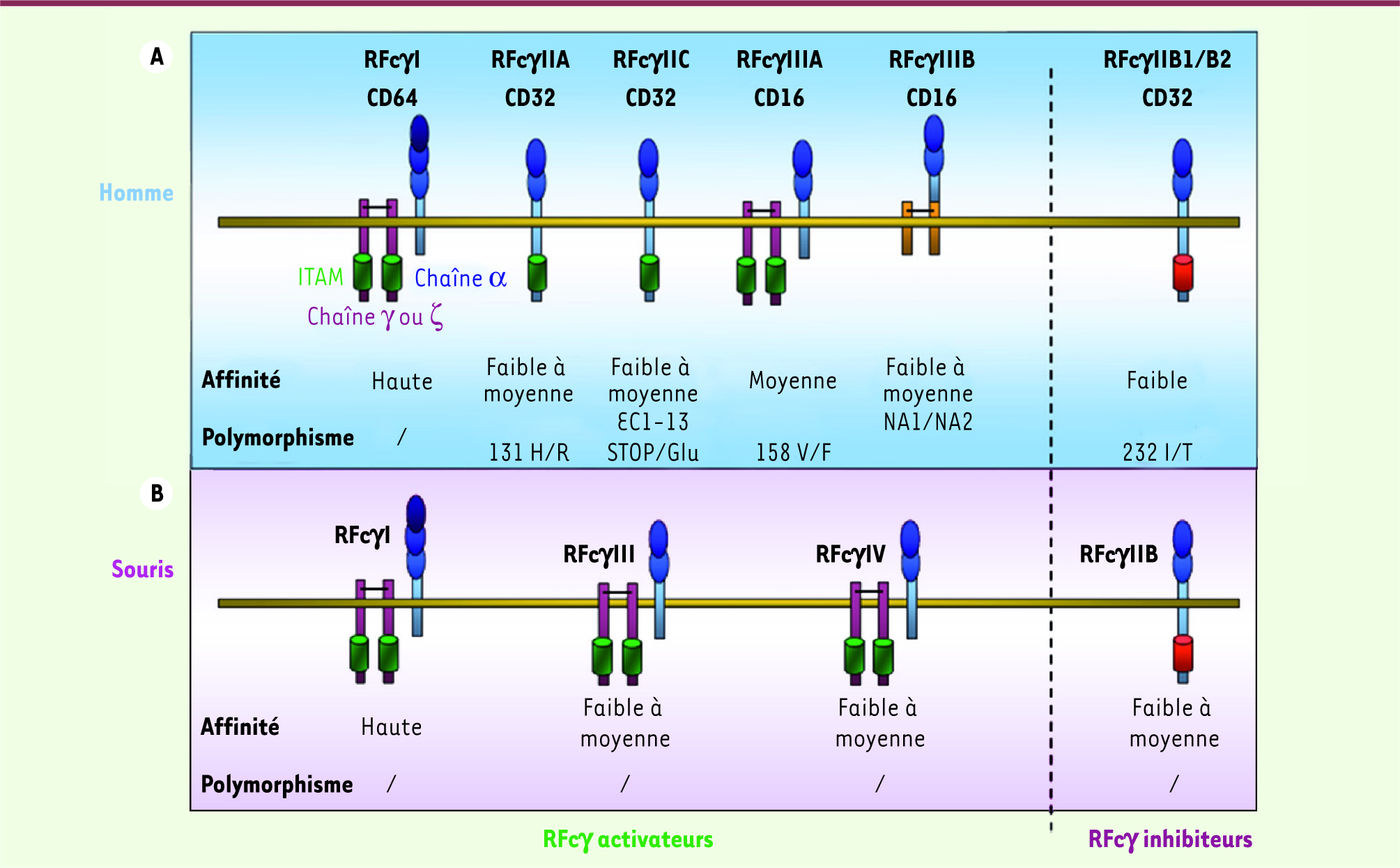
Les récepteurs pour la région Fc des immunoglobulines Les récepteurs pour la région Fc des immunoglobulines (Ig) G - ou RFcγ − représentent une famille de glycoprotéines membranaires principalement exprimées par des cellules du système immunitaire. Les RFcγ partagent de nombreuses fonctions qui ont permis au début des années 1990 de les classer en deux catégories. Les récepteurs activateurs se caractérisent par la présence d’un motif ITAM (immunoreceptor tyrosine-based activation motif ) dans le domaine intracellulaire de l’une des chaînes les composant. On distingue chez l’homme : RFcγI/CD64, RFcγIIA/CD32a et RFcγIIIA/CD16a chez l’homme ; chez la souris RFcγI, RFcγIII et RFcγIV. Les récepteurs inhibiteurs - RFcγIIB chez l’homme et RFcγII chez la souris - comprennent, eux, un motif ITIM (immunoreceptor tyrosine-based inhibitory motif) [
1,
2] (Figure 1). De nombreuses études ont montré que l’engagement conjoint de ce récepteur RFcγIIB avec un récepteur activateur à la surface d’une même cellule (par exemple avec le récepteur de l’antigène, BcR, d’un lymphocyte B) conduisait à l’inhibition du signal d’activation par l’intermédiaire de l’activation d’une phosphatase, SHIP (Src homology 2 domain-containing inositol phosphatase) [
3]. Cette caractéristique a conduit à développer des stratégies de ciblage de ce récepteur RFcγIIB pour obtenir soit son activation (ce qui pourrait être utile dans le cadre de l’hypersensibilité immédiate par exemple, car le RFcγIIB est présent à la surface des mastocytes et des basophiles, et peut inhiber le signal d’activation induit par l’engagement des récepteurs des Fc des IgE), soit son inhibition. Dans ce dernier cas, il s’agit de bloquer son action inhibitrice, ce qui peut faciliter l’activité antitumorale induite par des anticorps (Ac) dirigés contre les tumeurs [
4]. Cependant, quelle que soit la stratégie choisie, celle-ci se fondait sur l’interférence - positive ou négative - avec la fonction inhibitrice du RFcγIIB.
 | Figure 1.
Récepteurs de la région Fc des immunoglobulines chez l’homme. A. Il existe six RFcγ chez l’homme (cinq activateurs et un inhibiteur). Le RFcγI est le seul récepteur de haute affinité chez l’homme et la souris, les autres étant d’affinité moyenne ou faible. Hormis le RFcγIIIB, qui est fixé à la membrane des cellules l’exprimant par une ancre glypiée (GPI), l’ensemble de ces récepteurs sont transmembranaires. Les RFcγI et RFcγIIIA induisent une activation cellulaire grâce à des chaînes associées de signalisation contenant un motif ITAM responsable d’une signalisation activatrice. Parmi les RFcγII, les RFcγIIA et IIC induisent, suite à leur engagement, une signalisation activatrice grâce au motif ITAM contenu dans leur région intracytoplasmique. Les RFcγIIB sont les seuls RFcγ capable d’induire l’inhibition de l’activation cellulaire, et ce, grâce à leur motif ITIM. Chez l’homme, il existe trois isoformes du RFcγIIB, qui sont des variants d’épissages du gène FCGR2B. B. Chez la souris, il existe trois types de RFcγ activateurs, RFcγI, RFcγIII et RFcγIV. Le gène codant le RFcγIV est homologue au gène humain FCGR3A. De même, le seul gène identifié codant le RFcγII est homologue au gène humain FCGR2B (repris de R. Abès, Thèse de doctorat [
14] et adapté de [
15,
16]). |
|
L’effet adjuvant d’un RFcγ inhibiteur dans la réponse immunitaire Un article récent publié dans Science par F. Li et J.V. Ravetch [
5] nous rappelle qu’il ne faut jamais négliger les plasticités fonctionnelles cellulaires et moléculaires, qui peuvent offrir des opportunités inattendues dans le champ d’utilisation d’Ac monoclonaux à usage thérapeutique [
6]. Ces auteurs montrent que le ciblage de cellules dendritiques par un Ac dirigé contre DEC-205, une molécule de surface de ces cellules, et fusionné à l’ovalbumine (OVA), permet de générer des lymphocytes T CD8+ spécifiques de peptides dérivés de l’OVA et producteurs d’interféron-γ (IFN-γ). Les cellules dendritiques, situées au cœur du dispositif et qui permettent l’élaboration d’une réponse immune adaptative grâce au recrutement de lymphocytes T spécifiques [
7], endocytosent l’Ac anti-DEC-205-OVA et apprêtent les peptides issus de l’OVA. Mais pour recruter des lymphocytes T CD8+, ces cellules dendritiques requièrent un signal accessoire. Celui-ci est donné par l’injection conjointe d’un autre Ac monoclonal, dirigé contre la molécule CD40 exprimée comme DEC-205 à la surface de ces cellules. La fixation de cet anti-CD40 à sa cible induit l’expression accrue de molécules costimulatrices, CD80 et CD86, à la surface des cellules dendritiques. Cela conduit au recrutement et à une forte activation des lymphocytes T CD8+ spécifiques de l’OVA. Après avoir observé que l’induction de lymphocytes T CD8+ ne se produisait pas chez des souris n’exprimant plus aucun des RFcγ (RFcγ−/−), Li et Ravetch se sont posé la question du rôle de ces récepteurs. Ils n’interviennent pas dans la génération de lymphocytes T CD8+ spécifiques de l’OVA, puisque ceux-ci sont produits même si l’on utilise un Ac anti-DEC-205-OVA muté, incapable de lier les RFcγ. En revanche, l’interaction de l’Ac anti-CD40 avec les RFcγ des cellules dendritiques est essentielle à cette induction de lymphocytes T CD8+. En effet l’utilisation d’un Ac déglycosylé, incapable de fixer les RFcγ, ou celle de fragments F(ab)’2 dépourvus de région Fc, abolit la génération de lymphocytes T CD8+ . F. Li et J.V. Ravetch ont alors tenté de définir le(s)quel(s) parmi les quatre récepteurs RFcγ présents chez la souris, était essentiel à l’action de la molécule CD40. Pour abolir l’expression des trois RFcγ activateurs (I, III, IV), ils ont tiré parti d’une propriété commune à ces récepteurs : tous trois requièrent la présence d’une chaîne associée (chaîne γ) pour s’exprimer à la surface des cellules et induire un signal d’activation. Des souris, dont le gène codant la chaîne γ a été invalidé, n’expriment donc plus de RFcγ activateurs ; mais cette absence d’expression n’affecte en rien la génération de lymphocytes T CD8+ spécifiques de l’OVA obtenue dans les conditions décrites précédemment. En revanche, les souris dépourvues du RFcγIIB (Fcγr2b−/−
) en sont incapables. L’interaction de l’Ac anti-CD40 avec le RFcγIIB inhibiteur est donc essentielle à l’induction de l’effet « adjuvant » de cet Ac. A.L. White et al. sont parvenus à cette même conclusion dans un article paru quelques semaines avant celui de F. Li et J.V. Ravetch : la fixation au RFcγIIB en trans permet à un Ac anti-CD40 de stimuler des réponses humorales et cellulaires anti-OVA, sans impliquer les RFcγ activateurs [
8]. Cependant, ces auteurs considèrent que le rôle du RFcγIIB se limite à assurer un pontage efficace de l’Ac anti-CD40, sans pour autant déclencher une signalisation [8]. |
Comment intégrer ces observations pour une meilleure utilisation thérapeutique des anticorps ? Cet effet adjuvant peut-il être modulé ? Pour répondre à cette question, F. Li et J.V. Ravetch ont alors testé - dans le protocole décrit ci-dessus générant des lymphocytes T CD8+ antitumoraux - une série d’Ac anti-CD40 ayant des affinités différentes pour le RFcγIIB ou pour les RFcγ activateurs chez des souris porteuses de tumeurs exprimant ou non le CD40. Ils ont alors pu montrer que cet effet adjuvant sur la diminution des tumeurs et la survie était fonction de l’affinité de l’Ac pour le RFcγIIB dans ces différents modèles tumoraux. Ils ont notamment observé qu’un Ac anti-CD40 liant fortement le RFcγIIB (une IgG1 de souris) permettait d’obtenir une survie de toutes les souris porteuses de tumeurs CD40+ ; au contraire, un Ac anti-CD40 ayant une forte capacité cytotoxique (une IgG2a de souris ou un Ac chimérique porteur d’une région Fc d’IgG1 humaine, et se fixant fortement aux RFcγ activateurs) mais ayant une faible affinité pour le RFcγIIB inhibiteur, ne protégeait aucune de ces souris. Cette dernière observation est cependant étonnante pour deux raisons : (1) la même équipe avait démontré antérieurement qu’un Ac dirigé contre la molécule gp75 exprimée à la surface de cellules de mélanome n’induisait une protection antitumorale que lorsque les souris exprimaient des RFcγ activateurs, les souris dont le gène codant la chaîne γ avait été invalidé n’étant plus du tout protégées par le traitement par cet Ac [
9]. (2) Le rôle positif du RFcγIIB exprimé à la surface des cellules dendritiques dans le recrutement de lymphocytes T CD8+ spécifiques à la suite de son engagement par l’Ac anti-CD40 est également surprenant : en effet, ces mêmes auteurs ont décrit que l’engagement de ce récepteur par des complexes immuns conduit à une inhibition de la maturation des cellules dendritiques et à une diminution de leur capacité de présentation et d’activation de lymphocytes T CD8+ antitumoraux [
10]. Ces résultats, et d’autres rapportés au fil des années par l’équipe de J.V. Ravetch, posent désormais une importante question en ce qui concerne les Ac monoclonaux à usage thérapeutique de « seconde génération » en oncologie, où ces Ac semblent agir à la fois en activant des mécanismes effecteurs de l’immunité innée mais aussi en induisant une immunité adaptative faisant sans doute intervenir les cellules dendritiques [
11,
12] : optimiser les interactions des régions Fc avec les RFcγ, certes, mais lesquels ? [
13]. |
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Amigorena
S
,
Bonnerot
C
,
Drake
JR
, et al.
Cytoplasmic domain heterogeneity and functions of IgG Fc receptors in B lymphocytes . Science.
1992; ; 256 : :1808.–1812. 2.
Amigorena
S
,
Salamero
J
,
Davoust
J
,
Fridman
WH
,
Bonnerot
C
. Tyrosine-containing motif that transduces cell activation signals also determines internalization and antigen presentation via type III receptors for IgG . Nature.
1992; ; 358 : :337.–341. 3.
Daëron
M
,
Latour
S
,
Malbec
O
, et al.
The same tyrosine-based inhibition motif, in the intracytoplasmic domain of Fc gamma RIIB, regulates negatively BCR-, TCR-, and FcR-dependent cell activation . Immunity.
1995; ; 3 : :635.–646. 4.
Clynes
RA
,
Towers
TL
,
Presta
LG
,
Ravetch
JV
. Inhibitory Fc receptors modulate in vivo cytoxicity against tumor targets . Nat Med.
2000; ; 6 : :443.–446. 5.
Li
F
,
Ravetch
JV
. Inhibitory Fcγ receptor engagement drives adjuvant and anti-tumor activities of agonistic CD40 antibodies . Science.
2011; ; 333 : :1030.–1034. 6.
Les anticorps monoclonaux en thérapeutique . Med Sci (Paris).
2009; ; 25 : :997.–1195 ( numéro thématique.). 7.
Zitvogel
L
,
Amigorena
S
,
Teillaud
JL
. À propos de Ralph Steinman et des cellules dendritiques . Med Sci (Paris).
2011; ; 27 : :1028.–1034. 8.
White
AL
,
Chan
HT
,
Roghanian
A
, et al.
Interaction with FcγRIIB is critical for the agonistic activity of anti-CD40 monoclonal antibody . J Immunol.
2011; ; 187 : :1754.–1763. 9.
Clynes
R
,
Takechi
Y
,
Moroi
Y
,
Houghton
A
,
Ravetch
JV
. Fc receptors are required in passive and active immunity to melanoma . Proc Natl Acad Sci USA.
1998; ; 95 : :652.–656. 10.
Kalergis
AM
,
Ravetch
JV
. Inducing tumor immunity through the selective engagement of activating Fcgamma receptors on dendritic cells . J Exp Med.
2002; ; 195 : :1653.–1659. 11.
Abes
R
,
Gélizé
E
,
Fridman
WH
,
Teillaud
JL
. Long-lasting anti-tumor protection by anti-CD20 antibody through cellular immune response . Blood.
2010; ; 116 : :926.–934.
Park
S
,
Jiang
Z
,
Mortenson
ED
, et al.
The therapeutic effect of anti-HER2/neu antibody depends on both innate and adaptive immunity . Cancer Cell.
2010; ; 18 : :160.–170. 13.
Abes
R
,
Dutertre
CA
,
Teillaud
JL
. Les anticorps : mieux les connaître pour mieux s’en servir . Med Sci (Paris).
2009; ; 27 : :1011.–1020. 14.
Abes
R
. Induction de réponses immunes anti-tumorales in vivo à la suite du traitement par anticorps anti-CD20 : existence d’un effet « vaccinal » des anticorps anti-tumoraux ?
(École doctorale B2M-biochimie et biologie moléculaire. Thèse de Doctorat de l’université Paris 6-Pierre et Marie Curie)., 2010. 15.
Nimmerjahn
F
,
Ravetch
JV
. Fcgamma receptors as regulators of immune responses . Nat Rev Immunol.
2008; ; 8 : :34.–47. 16.
Tedder
TF
,
Baras
A
,
Xiu
Y
. Fcgamma receptor-dependent effector mechanisms regulate CD19 and CD20 antibody immunotherapies for B lymphocyte malignancies and autoimmunity . Semin Immunopathol.
2006; ; 28 : :351.–364. |