| |
| Med Sci (Paris). 2012 January; 28(1): 16–18. Published online 2012 January 27. doi: 10.1051/medsci/2012281005.DC-SIGN, un récepteur des phlébovirus Dynamique des interactions virus-récepteur Roger Meier,1* Ari Helenius,1** and Pierre-Yves Lozach1*** 1Institut de biochimie, ETH Zurich, Schafmattstrasse 18, 8093Zürich, Suisse MeSH keywords: Animaux, Molécules d'adhérence cellulaire, physiologie, Cellules dendritiques, virologie, Endocytose, Endosomes, Interactions hôte-pathogène, Humains, Concentration en ions d'hydrogène, Lectines de type C, Modèles biologiques, Phlebovirus, Récepteurs de surface cellulaire, Récepteurs viraux, Peau, cytologie, Attachement viral, Pénétration virale |
Les Bunyaviridae, une large famille de virus Les Bunyaviridae forment une large famille de virus enveloppés à ARN simple brin de polarité négative, comprenant plus de 350 membres répartis en cinq genres : Hantavirus, Nairovirus, Orthobunyavirus, Phlebovirus et Tospovirus [
1]. À l’exception des hantavirus, les bunyavirus sont des arbovirus majoritairement transmis par des moustiques, des phlébotomes et des tiques. Ils causent chez l’homme différentes pathologies allant de la fièvre bénigne aux fièvres hémorragiques mortelles, et représentent une sérieuse menace pour la santé publique [
2]. Leur distribution mondiale en extension et l’accélération de la fréquence des épidémies en font des agents potentiels de maladies émergentes [2]. Le phlébovirus de la fièvre de la vallée du Rift en est un bon exemple. Il n’existe actuellement aucune mesure préventive ou thérapeutique contre ces virus. Les particules de bunyavirus sont sphériques, avec un diamètre d’environ 100 nm. À leur surface, deux glycoprotéines, ancrées dans l’enveloppe virale, forment des spicules responsables de l’attachement aux cellules hôtes. À l’exclusion des hantavirus, pour lesquels les intégrines β1 et β3 jouent un rôle dans l’infection des cellules endothéliales [1], les récepteurs des bunyavirus demeurent largement inconnus. |
Les cellules dendritiques, un portail d’accès pour bunyavirus La transmission des bunyavirus à l’homme s’effectue dans le derme, suite au repas sanguin d’arthropodes infectés (Figure 1). Localisées au site anatomique de l’infection initiale, les cellules dendritiques sont parmi les premières cellules de l’hôte à rencontrer les particules virales. Elles expriment à leur surface la molécule DC-SIGN (dendritic cell-specific intercellular adhesion molecule-3-grabbing non-integrin), une lectine de type C (dépendante du calcium) spécialisée dans la capture et la présentation d’antigènes étrangers [
3].
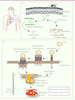 | Figure 1.
Dynamique de DC-SIGN durant la transmission et l’entrée infectieuse des phlébovirus dans les cellules dendritiques. Les phlébovirus sont introduits dans le derme de la peau pendant le repas sanguin d’arthropodes infectés. Les cellules dendritiques (CD) dermiques sont parmi les premières cellules de l’hôte à rencontrer ces virus. Elles expriment à leur surface la lectine de type C DC-SIGN. Les phlébovirus lient DC-SIGN via les sucres hautement mannosylés présents sur leurs glycoprotéines. L’attachement des virus induit un regroupement rapide des récepteurs autour des particules virales, et est suivi de l’internalisation des virus par endocytose. L’activité de DC-SIGN comme récepteur des phlébovirus est étroitement liée à sa capacité à internaliser les particules virales, et donc à sa fonction de récepteur endocytique. L’acidité environnante dans les endosomes précoces interfère avec la formation des tétramères de DC-SIGN et provoque la libération des virus dans l’espace luminal. Alors que la lectine est probablement recyclée vers la surface, le virus poursuit sa route vers les endosomes tardifs. La diminution du pH dans ces compartiments permet la fusion membranaire du virus (optimum de fusion à pH environ 5,4). Il en résulte la relâche du génome et des protéines virales dans le cytosol menant à l’infection. En infectant les CD dermiques, les phlébovirus seraient en mesure de tirer profit de la mobilité de ces cellules pour assurer leur dissémination chez l’hôte. CD, cellule dendritique ; EP, endosome précoce ; ET, endosome tardif ; MP, membrane plasmique. |
DC-SIGN est une protéine transmembranaire de type II qui lie les sucres riches en résidus mannose ou fucose, grâce à son domaine carboxy-terminal de reconnaissance des carbohydrates [3–
5]. La lectine est présente à la membrane plasmique dans différents états d’oligomérisation, la forme tétramérique ayant la plus haute avidité pour ses substrats. Plusieurs études ont rapporté des interactions entre DC-SIGN et divers pathogènes, dont des bactéries, des champignons et des virus [3]. Les interactions avec les arbovirus, comme le virus de la dengue (Flaviviridae), apparaissent particulièrement pertinentes, étant donné que les glycoprotéines de ces virus, produites chez des insectes, sont hautement mannosylées [
6]. |
DC-SIGN, la clé de l’entrée des phlébovirus Notre laboratoire vient de démontrer que DC-SIGN est un récepteur d’entrée des phlébovirus dans les cellules dendritiques [
7]. Ce travail, basé notamment sur des approches de microscopie en cellules vivantes, a permis de visualiser la dynamique de l’interaction virus-récepteur, de l’attachement à l’internalisation des particules virales dans les endosomes (Figure 1). Notre étude inclut divers phlébovirus, dont le virus de la fièvre de la vallée du Rift et son homologue non pathogène, le virus Uukuniemi (VUUK). L’utilisation d’anticorps bloquant la lectine a confirmé la spécificité de l’interaction entre ces virus et DC-SIGN : la liaison et l’infection étaient abrogées dans différents modèles cellulaires, incluant des lignées et des cellules dendritiques primaires. L’infection de lignées, initialement non susceptibles à de fortes doses de virus, est rendue possible par l’expression ectopique de la lectine. Il semble donc que l’expression de DC-SIGN soit, par elle-même, suffisante pour permettre l’infection. Bien que les phlébovirus utilisés dans cette étude soient produits dans des cellules de mammifère, la présence quasi-exclusive de résidus mannose sur leurs glycoprotéines permet leur liaison à DC-SIGN. Ce profil de glycosylation, proche de celui des glycoprotéines produites dans des insectes, est inattendu. Cette propriété suggère que les bunyavirus produits par les cellules dendritiques après l’infection initiale peuvent encore utiliser DC-SIGN pour leur propagation chez l’hôte. Cela contraste avec le virus de la dengue, qui, lorsqu’il est produit en cellules de mammifère, acquiert une glycosylation inadéquate à sa reconnaissance par cette lectine [
8]. Il est même envisageable que les phlébovirus poursuivent leur dissémination chez l’hôte en utilisant d’autres lectines de type C capables d’interagir avec des glycoprotéines hautement mannosylées, comme L-SIGN, exprimées à la surface des cellules endothéliales du foie. |
La microscopie à fluorescence par réflexion totale interne1 en cellules vivantes nous a permis de démontrer que les phlébovirus interagissent directement avec la lectine. Nous avons observé, dans plusieurs cas, le recrutement du récepteur vers le site de liaison du virus à la membrane plasmique. Cet enrichissement des récepteurs, qui forment des microdomaines autour des particules virales, est rapide (cinq min ou moins). Certaines propriétés de ces microdomaines, telles que leur composition lipidique et protéique, ainsi que leur courbure membranaire, influencent sûrement les étapes suivantes de l’entrée virale, comme la signalisation et l’endocytose. Il est donc envisageable que l’accumulation de DC-SIGN autour des phlébovirus participe à la stabilisation et au renforcement de l’interaction, puis au déclenchement de l’endocytose du complexe dans les cellules dendritiques (Figure 1). Une fois les particules virales attachées aux cellules dendritiques, la majorité d’entre elles sont internalisées en moins de 15 min. L’activité endocytique de DC-SIGN est liée à un motif di-leucine dans son domaine cytoplasmique [3]. Une question récurrente de ces dernières années concerne le rôle joué par DC-SIGN dans l’endocytose des virus. Une implication directe de la lectine dans l’internalisation de particules virales menant à l’infection n’a jamais été rapportée. La mutation de ce motif ne modifie pas, par exemple, l’entrée infectieuse du virus de la dengue [
9]. En revanche, bien que le mutant di-leucine puisse capturer VUUK, nous avons montré qu’il n’est pas en mesure d’assurer l’endocytose du virus conduisant à l’infection des cellules. Nous avons finalement établi que les phlébovirus endocytés par DC-SIGN sont ensuite libérés dans le lumen des endosomes précoces, en réponse probablement à l’acidité environnante (pH d’environ 6,0-6,5) [
10], 10 à 20 min après leur internalisation (Figure 1). À ces valeurs, l’acidité provoque la dissociation des tétramères de DC-SIGN en monomères qui ont une faible affinité pour leurs substrats [
11]. Alors que la lectine est probablement recyclée vers la surface, les virus poursuivent leur route vers les endosomes tardifs où le pH (5,0-6,0) permet la fusion membranaire des particules virales (Figure 1) [10,
12]. |
Bien qu’ils doivent être confirmés dans un contexte naturel, nos travaux suggèrent que les phlébovirus utilisent DC-SIGN pour cibler et infecter les cellules dendritiques dans le derme de l’hôte, à la suite d’une piqûre d’arthropodes infectés. En tirant profit de la mobilité des cellules dendritiques, ces virus assureraient leur dissémination chez l’hôte (Figure 1). Comme ces virus infectent un large spectre de tissus, dont la plupart n’expriment pas DC-SIGN, il est évident que les bunyavirus utilisent d’autres récepteurs dans un second cycle d’infection. L’identification de ces récepteurs reste un objectif important. Cette étude soulève de nouvelles questions. Etant donné son importance dans l’établissement de la réponse immunitaire, il sera important de déterminer si la signalisation conduisant à la maturation des cellules dendritiques est altérée après une infection par les phlébovirus. Quels sont les mécanismes et facteurs cellulaires impliqués dans l’endocytose de DC-SIGN ? Qu’en-est-il des autres bunyavirus ? Une meilleure compréhension du fonctionnement cellulaire de DC-SIGN aidera à développer de nouvelles approches préventives et thérapeutiques, non seulement contre les infections à phlébovirus, mais aussi contre tous les virus utilisant cette lectine. À cette fin, les phlébovirus, comme VUUK, s’avèrent être, en tant que modèles, de précieux outils. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1.
Blakqori
G
,
Bouloy
M
,
Bridgen
A
, et al.
Bunyaviridae: molecular and cellular biology . In :
Plyusnin
A
,
Elliott
RM
, eds. Norwich: : Caister Academic Press; , 2011. 2.
Soldan
SS
,
Gonzalez-Scarano
F
. Emerging infectious diseases: the Bunyaviridae . J Neurovirol.
2005; ; 11 : :412.–423. 3.
Svajger
U
,
Anderluh
M
,
Jeras
M
,
Obermajer
N
. C-type lectin DC-SIGN: an adhesion, signalling and antigen-uptake molecule that guides dendritic cells in immunity . Cell Signal.
2010; ; 22 : :1397.–1405. 4.
Quintana-Murci
L
. Immunité innée et sélection naturelles : le paradigme de la région génomique DC-SIGN/L-SIGN . Med Sci (Paris).
2006; ; 22 : :29.–32. 5.
Desprès
P
,
Sakuntabhai
A
,
Julier
C
. Association d’un variant génétique du récepteur d’attachement DC-SIGN (CD 209) à la gravité de la dengue . Med Sci (Paris).
2005; ; 21 : :905.–906. 6.
Fernandez-Garcia
MD
,
Mazzon
M
,
Jacobs
M
,
Amara
A
. Pathogenesis of flavivirus infections: using and abusing the host cell . Cell Host Microbe.
2009; ; 5 : :318.–328. 7.
Lozach
PY
,
Kuhbacher
A
,
Meier
R
, et al.
DC-SIGN as a receptor for phleboviruses . Cell Host Microbe.
2011; ; 10 : :75.–88. 8.
Dejnirattisai
W
,
Webb
AI
,
Chan
V
, et al.
Lectin switching during dengue virus infection . J Infect Dis.
2011; ; 203 : :1775.–1783. 9.
Lozach
PY
,
Burleigh
L
,
Staropoli
I
, et al.
Dendritic cell-specific intercellular adhesion molecule 3-grabbing non-integrin (DC-SIGN)-mediated enhancement of dengue virus infection is independent of DC-SIGN internalization signals . J Biol Chem.
2005; ; 280 : :23698.–23708. 10.
Lozach
PY
,
Huotari
J
,
Helenius
A
. Late-penetrating viruses . Curr Opin Virol.
2011; ; 1 : :35.–43. 11.
Tabarani
G
,
Thepaut
M
,
Stroebel
D
, et al.
DC-SIGN neck domain is a pH-sensor controlling oligomerization: SAXS and hydrodynamic studies of extracellular domain . J Biol Chem.
2009; ; 284 : :21229.–21240. 12.
Lozach
PY
,
Mancini
R
,
Bitto
D
, et al.
Entry of bunyaviruses into mammalian cells . Cell Host Microbe.
2010; ; 7 : :488.–499. |


