| |
| Med Sci (Paris). 2012 January; 28(1): 63–68. Published online 2012 January 27. doi: 10.1051/medsci/2012281018.Les souris ne sont pas des hommes et pourtant… Ce que les souris humanisées nous apprennent sur les maladies infectieuses Anne Cachat,1,2* Julien Villaudy,1,2* Dominique Rigal,3 Louis Gazzolo,1,2 and Madeleine Duc Dodon1,2** 11 Virologie humaine, INSERM-U758, École normale supérieure, 2 UMS 3444 BioSciences Lyon-Gerland, 69364Lyon Cedex 07, France 2UMS 3444 BioSciences Lyon-Gerland, 69364Lyon Cedex 07, France 3Établissement français du sang, 1-3, rue du Vercors, 69007Lyon, France |
Pour servir de modèle d’étude à un processus pathologique observé chez l’homme, un animal devrait offrir les propriétés idéales suivantes : une descendance nombreuse, un développement rapide, une taille réduite et un entretien facile. La souris (Mus musculus) présente de telles caractéristiques qu’elle partage avec d’autres espèces animales, comme le ver nématode (Caenorhabditis elegans), la mouche du vinaigre (Drosophila melanogaster) et le poisson zèbre (Danio rerio). La souris de laboratoire vient de fêter son centième anniversaire : c’est en effet en 1909 que la première souche isogénique de mammifère a été obtenue et identifiée. Il s’agit de la souche de souris DBA (dilute brown non-agouti). Cette population d’individus génétiquement identiques représentait alors le groupe témoin essentiel à toute expérimentation biologique. Depuis, la souris est considérée comme le meilleur modèle animal, un « top model » taillé sur mesure pour la recherche. Les premières souris « humanisées » sont apparues dans les années 1980 : ce sont les souris transgéniques dans le génome desquelles a été inséré un gène humain pour en étudier l’expression et la fonction. Ainsi, certaines de ces souris appelées xenomouse ont été utilisées pour produire des anticorps humanisés [
1,
39]. Il faut toutefois admettre que ce qualificatif « humanisées » convient davantage aux souris greffées avec des cellules ou tissus humains. Ce sont ces dernières qui font l’objet de cette revue, car elles représentent, à ce jour, un outil très performant pour la recherche biomédicale. |
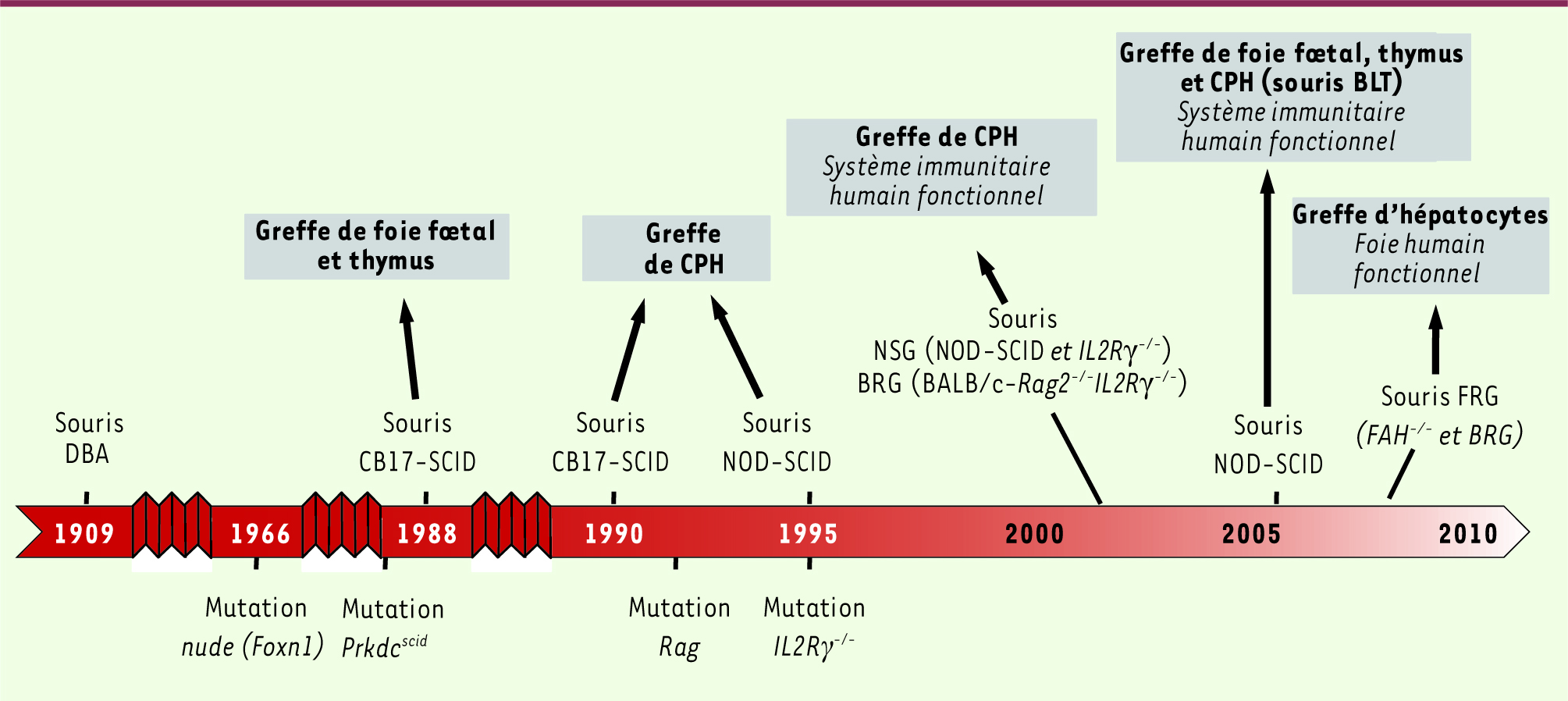
De l’immunodéficience à l’humanisation Un grand choix de souris immunodéficientes Seules des souris immunodéficientes se prêtent à la reconstitution d’un système hématolymphoïde humain et sont capables de générer des réponses immunitaires innées et adaptatives humaines. La réussite de la prise de greffe des cellules humaines transplantées chez ces souris - et, dans le cas dont il est question ici, de cellules progénitrices hématopoïétiques (CPH) humaines - est conditionnée par l’absence de lymphocytes T et B murins, mais surtout par celle des cellules murines natural killer (NK). Les principales souches de souris immunodéficientes qui ont été utilisées pour le développement des souris humanisées au cours des récentes décennies sont présentées dans la
Figure 1
.
 | Figure 1.
Représentation schématique de la chronologie de la production des différentes souches de souris immunodéficientes utilisées pour la transplantation de cellules ou tissus humains. BLT : bone marrow liver thymus ; CPH : cellule progénitrice humaine ; DBA : dilute brown non aguti ; FAH : fumaryl acetate hydrolase ; FRG : FAH rag gamma ; IL2Rγ : interleukin-2 receptor gamma chain ; NOD : non obese diabetic ; NSG : NOD-SCID gamma c ; Rag : recombination-activating gene ; SCID : severe combined immuno-deficiency. |
Pour mémoire, citons d’abord les souris nude athymiques, décrites en 1966, qui ne produisent pas de lymphocytes T. En 1983, les souris CB17-scid (severe combined immunodeficiency) ont été obtenues [
2]. Elles présentent une mutation autosomale récessive du gène prkdc (protein kinase DNA activated catalytic polypeptide) codant pour une protéine impliquée dans les recombinaisons V(D)J nécessaires aux réarrangements des récepteurs des cellules T et des immunoglobulines (Ig). Cependant, une forte activité des cellules murines NK limitait la prise de greffe de cellules humaines provenant de tissus hématopoïétiques fœtaux (foie, thymus) ou celle de cellules progénitrices hématopoïétiques (CPH) humaines CD34+, empêchant le développement d’un système immunitaire [
3,
4]. De même, le système immunitaire humain ne s’établit pas non plus chez les souris immunodéficientes NOD (non-obese diabetic)-SCID, malgré une activité réduite des cellules murines NK [
5]. Mais la forte incidence de thymomes observés chez ces souris réduit leur durée de vie, ce qui empêche la réalisation de longues expériences. Cependant, les souris NOD-SCID ont permis, après implantation de foie et de thymus de fœtus humains sous la capsule rénale, de générer les souris humanisées BLT (pour bone marrow, liver, thymus) : l’implantation des tissus humains est suivie d’une irradiation sous-létale et d’une injection intraveineuse de CPH CD34+ isolées du même foie fœtal [
6]. On observe une reconstitution avec présence de cellules hématopoïétiques humaines circulantes (lymphocytes T, B, monocytes, cellules dendritiques). La thymopoïèse humaine se développe exclusivement dans l’implant thymique humain : l’éducation des cellules T s’y déroule dans le contexte d’un CMH (complexe majeur d’histocompatibilité) humain, comme le confirme la restriction HLA-A1 et HLA-A2 des réponses des cellules T à l’infection par le virus d’Epstein-Barr in vivo [6]. De plus, ces souris sont capables d’une forte production d’anticorps (IgG) après leur immunisation avec des antigènes T-dépendants in vivo. Elles produisent aussi des cytokines inflammatoires en réponse à la toxine du syndrome du choc toxique [6]. Enfin, des cellules B, des cellules T, des monocytes/macrophages, des cellules NK et des cellules dendritiques sont présentes dans l’épithélium intestinal, ainsi que dans les poumons et les muqueuses rectales et vaginales. Cependant, la mise en œuvre de ce protocole est très laborieuse, ce qui explique que le modèle BLT soit rarement utilisé. Plus récemment, des souris IL2Rγ
−/−
présentant une mutation du locus de la chaîne g du récepteur de l’interleukine 2 (IL2Rγ ou γc pour chaîne commune aux récepteurs de l’IL-2, IL-4, IL-7, IL-9, IL-15 et IL-21) ont été générées. Cette mutation empêche le développement des cellules NK. Ces souris ont été croisées, soit avec les souris NOD-SCID pour obtenir les souris NOD-SCID-γc−/−
(NSG) [
7,
8], soit avec les souris BALB/c-Rag2−/−
, chez lesquelles la mutation Rag2 empêche les recombinaisons V(D)J, pour obtenir les souris BALB/c-Rag2−/−
γc
−/− (BRG) [
9]. Les conditions d’une reconstitution hématolymphoïde humaine complète et fonctionnelle chez les souris NSG et BRG Ces deux souches de souris, qui ne développent pas spontanément de tumeurs et sont génétiquement très stables, sont complètement dépourvues de lymphocytes murins T, B, et de cellules NK. Ces souris sont, à ce jour, les plus utilisées pour étudier les paramètres essentiels à la reconstitution chez ces animaux d’un système hématolymphoïde humain et au développement d’un système immunitaire fonctionnel. L’inoculation intrahépatique ou intracardiaque de CPH humaines CD34 + préparées à partir de sang de cordon dans des souriceaux âgés de 24 à 48 h préalablement irradiés représente le protocole idéal [
10]. L’efficacité de la greffe de ces CPH autorise la mise en place et le développement d’un système immunitaire humain fonctionnel avec une thymopoïèse humaine active. Celle-ci se développe dans le rudiment thymique murin qui est colonisé par des cellules humaines produites de novo dans la moelle osseuse des souris [ 9,
11,
12]. Il faut noter que les thymocytes humains sont éduqués principalement contre le complexe majeur d’histocompatibilité (CMH) murin avant leur maturation en lymphocytes T. Puis ils sortent du thymus pour coloniser les organes lymphoïdes secondaires. Deux à trois mois plus tard, des lymphocytes T et B humains sont détectés dans le sang périphérique, la moelle osseuse, la rate, et les ganglions lymphatiques (voir Tableau I). Le nombre de lymphocytes T et B, plus élevé dans les souris NSG que dans les souris BRG, souligne que le fonds génétique NOD est plus permissif à la greffe xénogénique de cellules humaines que le fonds Balb/c. Cette différence est probablement due à une variabilité de l’activité macrophagique, liée notamment à l’expression de différents allèles du gène Sirpα ( signal regulatory protein α) 1 [
13]. Ces modèles autorisent la mise en place d’une réponse immunitaire adaptative. Outre la présence de cellules humaines NK, celle de cellules myélomonocytaires et dendritiques, dont des cellules dendritiques plasmacytoïdes, souligne l’établissement d’une réponse immunitaire innée [ 7, 9,
14,
15]. La production d’anticorps (IgM/IgG) par les lymphocytes B en réponse à une immunisation contre la toxine tétanique est très faible, ce qu’explique l’absence de collaboration entre les lymphocytes T et B chez ces souris chimères, conséquence de la non-expression des molécules HLA ( human leukocyte antigens). Enfin, la détection dans la muqueuse intestinale de lymphocytes B sécrétant des IgA témoigne d’une possible reconstitution de l’immunité mucosale [ 7].
Tableau I.
| Tissu |
Pourcentage de cellules hCD45+ |
| Cellules B |
Cellules T |
Cellules myéloïdes |
Cellules dendritiques |
| Moelle osseuse |
78 à 90 |
3,8 à 15,1 |
4,7 à 11,6 |
1,6 à 4,4 |
| Rate |
50 à 85 |
1,0 à 39,2 |
6,4 à 11,4 |
1,4 à 3,3 |
| Thymus |
2,1 à 3,2 |
95 à 98 |
– |
– |
| Sang périphérique |
49 à 76 |
5,2 à 27,8 |
5,6 à 13,4 |
– |
Composition cellulaire du système hématolymphoïde humain observé dans des souris humanisées. Les CPH CD34+ humaines, isolées à partir de sang placentaire, ont été inoculées par voie intrahépatique dans des souriceaux NSG ou BRG nouveau-nés, préalablement irradiés avec une dose sous-létale. L’analyse a été faite 2 à 3 mois après la greffe. |
|
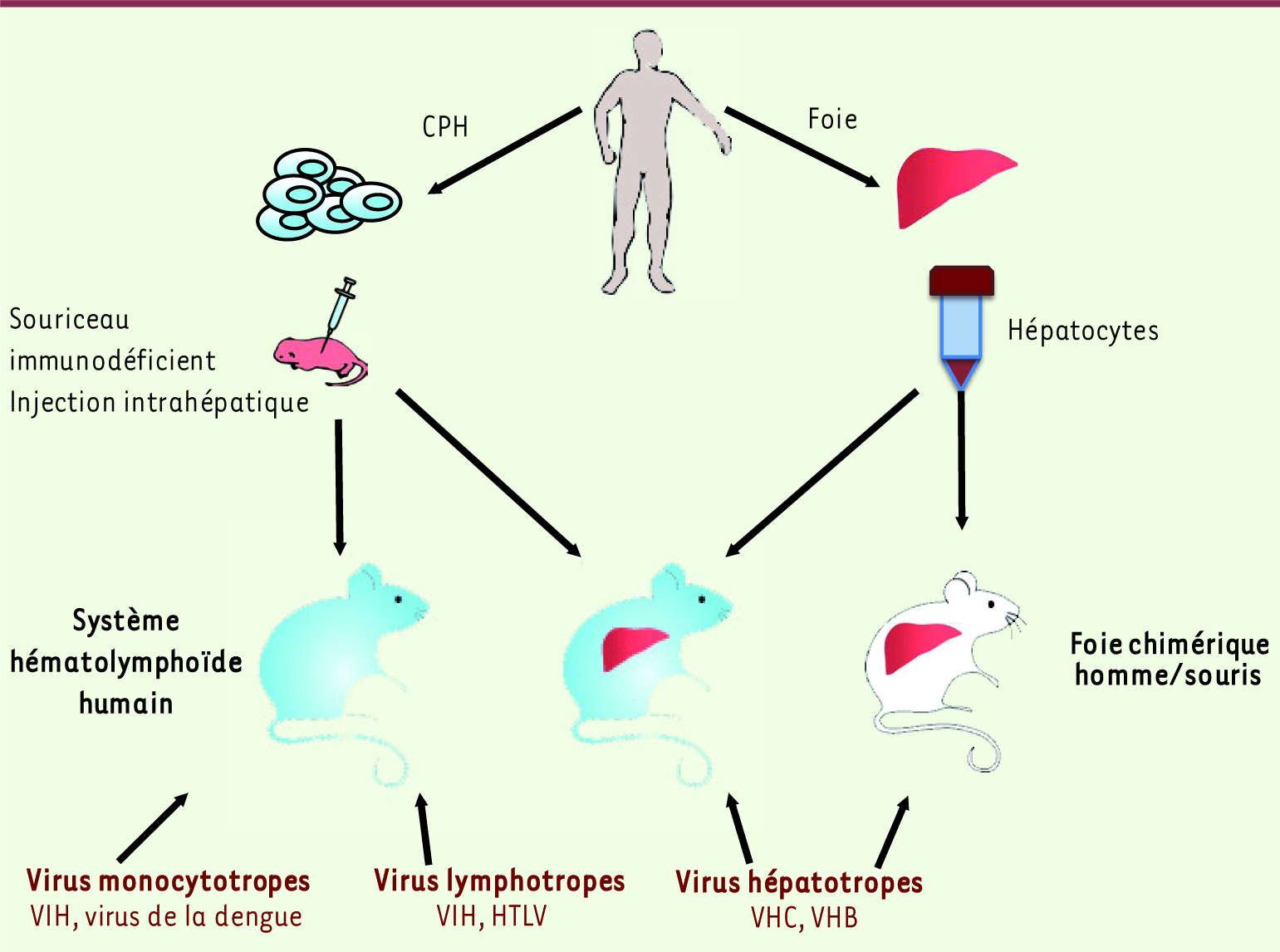
De l’humanisation à l’infectiologie La mise au point, au cours de la dernière décennie, des souris humanisées BLT, NSG et BRG a permis l’étude de divers agents pathogènes humains d’origine virale, bactérienne ou parasitaire, ce que ne permettaient pas de manière convaincante les modèles animaux traditionnels (pour revues voir [
16–
18]). L’utilisation des souris humanisées permettra de préciser les mécanismes moléculaires et cellulaires de la pathogenèse, de définir de nouvelles stratégies thérapeutiques et de procéder à une évaluation préclinique des modalités de prévention vaccinale. Cette recherche translationnelle devrait aboutir à des avancées majeures dans le traitement des maladies infectieuses humaines. Nous analysons ici quelques exemples illustrant l’apport des souris humanisées à l’étude des virus ciblant les cellules du système immunitaire humain. Il s’agit des virus lymphotropes et monocytotropes : VIH (virus de l’immunodéficience humaine), HTLV-1 (human T-cell leukemia virus type 1), virus de la dengue. Récemment, la greffe de cellules hépatiques a permis d’aborder la pathogenèse des virus hépatotropes (VHB, virus de l’hépatite B ; VHC, virus de l’hépatite C) (Figure 2).
 | Figure 2.
Stratégies mises en œuvre pour établir les modèles de souris humanisées adaptés à l’étude des maladies infectieuses humaines. Voir texte pour détails et [ 16, 18,
32]. |
VIH, virus du syndrome de l’immunodéficience acquise Un des premiers virus étudiés dans ce modèle de souris humanisées est le VIH, lentivirus à la fois lymphotrope et monocytotrope [
19]. L’infection des souris BRG par ce virus reproduit chez ces souris des aspects spécifiques de la maladie, par exemple la déplétion des lymphocytes T CD4 +, la virémie et la dissémination du virus dans les organes lymphoïdes [
20–
22]. Cependant, la réponse des cellules B anti-VIH restant très faible dans ce modèle, les études se sont principalement focalisées, chez ces souris humanisées, sur les phases précoces de l’infection, notamment sur la transmission du virus au niveau des muqueuses vaginale et rectale. Ces muqueuses sont constituées de cellules T, de macrophages et de cellules dendritiques humaines. Lorsque le VIH est directement injecté dans les cavités vaginale ou rectale, l’infection est systémique dès la première semaine [
21]. Ce modèle d’étude est très prometteur pour la validation in vivo de nouvelles stratégies thérapeutiques visant à empêcher la transmission du virus au niveau des muqueuses. Dans ce contexte, rappelons qu’un essai de thérapie génique utilisant les shARN (ou ARN en épingle à cheveu) a donné des résultats intéressants [
23]. Notons enfin que les souris humanisées permettent l’étude des co-infections. C’est, par exemple, le cas du virus du sarcome de Kaposi qui se réplique chez ces souris en présence ou en absence d’infection par le VIH, et celui de co-infections par le parasite Toxoplasma gondii responsable d’encéphalites [18]. HTLV-1, virus de la leucémie T de l’adulte Le deltarétrovirus HTLV-1 ( human T-cell leukemia virus type 1), qui infecte 15 à 20 millions d’individus dans le monde, est l’agent étiologique de deux pathologies : la leucémie T de l’adulte ou ATL et une maladie neurodégénérative invalidante, la paraparésie spastique tropicale ou TSP/HAM [
24]. Comme pour le VIH, aucun petit modèle traditionnel n’a permis de reproduire l’infection et la pathogenèse in vivo. Le modèle des souris scid humanisées BLT ( bone marrow, liver, thymus) a été d’abord utilisé pour comparer la greffe de cellules CPH préalablement infectées par HTLV-1 à celle de cellules de lignées établies transformées par ce virus [
25]. Les auteurs ont montré que le virus était retrouvé dans les biopsies de foie et de thymus à distance de la greffe, mais n’entraînait pas d’infection systémique. Les souris humanisées ont récemment contribué à l’étude des mécanismes de l’activité leucémogène de ce virus in vivo [
26]. Ainsi, quand les CPH CD34+ infectées ex vivo par le virus HTLV-1 sont transplantées dans des souris NSG, ces souris développent exclusivement des lymphomes T CD4+ semblables à ceux retrouvés chez les patients ATL, et l’intégration du provirus est détectée dans les progéniteurs présents dans la moelle osseuse. Les auteurs concluent que les CPH de la moelle osseuse seraient le réservoir du virus in vivo et représentent les cellules cibles de la transformation par HTLV-1 chez l’homme. Nous avons utilisé une approche différente pour étudier les étapes précoces de l’infection par HTLV-1. Des souris BRG humanisées sont infectées par injection intrapéritonéale de cellules irradiées productrices d’HTLV-1, une fois le développement du thymus humain achevé. L’infection, attestée par une charge provirale élevée dans les thymocytes et les splénocytes humains, perturbe la maturation des thymocytes, provoque une augmentation du nombre de lymphocytes T dans les organes périphériques et induit des pathologies caractéristiques de l’ATL. Ces résultats suggèrent que, chez l’homme, l’infection par HTLV-1 des thymocytes immatures est un événement favorisant le développement de leucémies/lymphomes [
27]. Virus de la dengue Ce virus de la famille des Flaviviridae est le plus souvent à l’origine d’une fièvre bénigne chez les individus infectés (50 à 100 millions par an dans le monde), mais dans de rares cas il induit une fièvre hémorragique, parfois mortelle. Il est transmis à l’homme par des moustiques qui jouent à la fois le rôle de vecteurs et de réservoirs. Des souris NOD- scid, greffées avec des CPH puis infectées par voie sous-cutanée avec le virus, ce qui mime la transmission par les moustiques, développent des signes cliniques identiques à ceux observés chez l’homme : fièvre, érythème et thrombocytopénie [
28]. De même, des souris BRG humanisées ayant reçu une greffon de CPH puis secondairement infectées par le virus de la dengue, développent pendant trois semaines une virémie élevée accompagnée d’une fièvre importante [
29]. La production précoce d’anticorps de type IgM est suivie de celle d’anticorps IgG, dont certains sont neutralisants. Récemment, des souris NSG, exprimant la molécule humaine HLA-A2 ont été utilisées. Chez ces souris, l’éducation intrathymique des cellules T humaines s’effectue au contact des molécules HLA-A2 humaines exprimées par les cellules de souris. Ces souris humanisées reçoivent une injection de CPH HLA-A2 +, puis elles sont infectées par le virus de la dengue [
30]. Des splénocytes humains sont ensuite isolés et stimulés ex vivo par des peptides viraux restreints par HLA-A2. La sécrétion d’interféron γ, de TNFα ( tumor necrosis factor) et d’interleukine-2 reflète la présence de lymphocytes T CD8 + chez les souris NSG mais uniquement si elles expriment HLA-A2. VHB et VHC, virus des hépatites Les hépatocytes humains sont les cellules cibles de plusieurs agents pathogènes, parmi lesquels les virus des hépatites B et C (VHB, de la famille des Hepadnaviridae et VHC, de la famille des Flaviviridae), qui infectent 800 millions d’individus dans le monde. Pour mieux comprendre la pathogenèse de ces infections virales, des souris immunodéficientes ont été croisées avec des souris transgéniques pour un gène exprimant une protéine cytolytique pour les hépatocytes murins. Cette cytolyse hépatique est un stimulus pour la régénération hépatique. C’est le cas chez les souris urokinase-type plasminogen activator uPA/Rag2−/−
[
31]. Lorsque ces souris sont greffées avec des hépatocytes adultes humains, puis infectées par le VHB, on observe les stigmates d’une infection productive. Plus récemment, des souris qui n’expriment pas la fumaryle acétate hydrolase (FAH) ont été croisées avec des souris immunodéficientes (souris FAH -/BRG). L’absence de cet enzyme conduit à la destruction du foie murin [ 32,
33]. Ces souris FAH -/BRG, lorsqu’elles sont transplantées avec des hépatocytes adultes humains, montrent un chimérisme hépatique humain/souris élevé, corrélé à la quantité d’albumine humaine détectable dans le sérum. Ces souris chimériques sont sensibles à l’infection par le VHB et le VHC, comme l’indique la détection des antigènes viraux dans le foie chimérique de ces animaux. De plus, les souris infectées par le VHC répondent au traitement antiviral. Récemment, des souris BRG transgéniques ont été obtenues, qui expriment de façon inductible une protéine de fusion (FK506 binding protein-caspase 8). Son induction entraîne la dimérisation de la caspase 8 et son activation, ce qui provoque la mort des hépatocytes murins [
34]. Ces souris sont ensuite greffées à la fois avec des CPH (pour une reconstitution hématolymphoïde) et des progéniteurs hépatocytaires (reconstitution hépatique) isolés du même foie fœtal, puis infectées quatre semaines plus tard par le VHC. Elles sont alors capables d’une réponse immunitaire humaine T spécifique du VHC et développent des hépatites et des fibroses. Ces souris, constituées à la fois d’hépatocytes humains et de cellules immunitaires humaines, illustrent le potentiel de ce modèle pour étudier l’immunopathogenèse induite par l’infection par les virus hépatotropes. Ce modèle sera également utile pour l’étude de l’étape intrahépatique obligatoire du développement de Plasmodium falciparum, le parasite responsable de la malaria [
35]. |
Quelles souris humanisées pour l’avenir ? Actuellement, des protocoles standards relativement faciles à mettre en œuvre pour produire ces souris humanisées sont disponibles [
36,
37]. Une des grandes innovations dans ces modèles est la diversité des tissus humains que l’on envisage maintenant de greffer chez ces souris, multipliant ainsi le nombre de maladies humaines modélisables. Certains tissus humains cibles spécifiques d’infections virales peuvent être transplantés dans des souris immunodéficientes : c’est le cas de l’épithélium intestinal pour l’étude des virus entériques [
17]. Comment améliorer ces stratégies ? Citons l’ablation des cellules et/ou tissus murins pour créer de « l’espace », soit par irradiation (cas de la greffe de précurseurs hématopoiétiques), soit par modifications génétiques (exemple des hépatocytes humains). On peut aussi essayer d’augmenter la spécificité de la réponse immunitaire des souris humanisées grâce à l’ajout de cytokines humaines, et d’éviter la destruction active de la greffe par la souris [
38]. L’éducation des cellules T et B humaines greffées est restreinte du fait de la non-expression des molécules HLA. C’est la limitation majeure inhérente à ce modèle de souris humanisées. L’expression transgénique des molécules HLA pourrait améliorer les sélections positive et négative des lymphocytes T et la réponse immunitaire [30,
40]. Il faut espérer un effet synergique de chacune de ces améliorations ce qui permettrait d’obtenir, dans un avenir très proche, le modèle animal le plus performant pour l’étude des virus, bactéries et autres agents pathogènes humains, ainsi que pour le développement de thérapies innovantes et de vaccins [15]. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Le travail de notre laboratoire sur l’étude de l’infection par HTLV-1 des souris humanisées est soutenu par l’Inserm, par le projet Européen Infection and Cancer (INCa) du sixième Research Framework Program (n° LSHC-CT-2005-018704) et par la Fondation de France, comité leucémie (n°RAF09001CCA).
|
Footnotes |
1.
Bellet
D
,
Pecking
A
,
Dangles-Marie
V
.
XenoMouse : un tour de force pour l’obtention d’anticorps humains chez la souris . Med Sci (Paris).
2008; ; 24 : :903.–905. 2.
Bosma
GC
,
Custer
RP
,
Bosma
MJ
. A severe combined immunodeficiency mutation in the mouse . Nature.
1983; ; 301 : :527.–530. 3.
Mosier
DE
,
Gulizia
RJ
,
Baird
SM
,
Wilson
DB
. Transfer of a functional human immune system to mice with severe combined immunodeficiency . Nature.
1988; ; 335 : :256.–259. 4.
McCune
JM
,
Namikawa
R
,
Kaneshima
H
, et al.
The SCID-hu mouse : murine model for the analysis of human hematolymphoid differentiation and function . Science.
1988; ; 241 : :1632.–1639. 5.
Shultz
LD
,
Schweitzer
PA
,
Christianson
SW
, et al.
Multiple defects in innate and adaptive immunologic function in NOD/LtSz-scid mice . J Immunol.
1995; ; 154 : :180.–191. 6.
Melkus
MW
,
Estes
JD
,
Padgett-Thomas
A
, et al.
Humanized mice mount specific adaptive and innate immune responses to EBV and TSST-1 . Nat Med.
2006; ; 12 : :1316.–1322. 7.
Ishikawa
F
,
Yasukawa
M
,
Lyons
B
, et al.
Development of functional human blood and immune systems in NOD/SCID/IL2 receptor gamma chain(null) mice . Blood.
2005; ; 106 : :1565.–1573. 8.
Ito
M
,
Kobayashi
K
,
Nakahata
T
. NOD/Shi-scid IL2rgamma(null) (NOG) mice more appropriate for humanized mouse models . Curr Top Microbiol Immunol.
2008; ; 324 : :53.–76. 9.
Traggiai
E
,
Chicha
L
,
Mazzucchelli
L
, et al.
Development of a human adaptive immune system in cord blood cell-transplanted mice . Science.
2004; ; 304 : :104.–107. 10.
Brehm
MA
,
Shultz
LD
,
Greiner
DL
. Humanized mouse models to study human diseases . Curr Opin Endocrinol Diabetes Obes.
2010; ; 17 : :120.–125. 11.
Gimeno
R
,
Weijer
K
,
Voordouw
A
, et al.
Monitoring the effect of gene silencing by RNA interference in human CD34+ cells injected into newborn RAG2−/− gammac−/− mice : functional inactivation of p53 in developing T cells . Blood.
2004; ; 104 : :3886.–3893. 12.
Awong
G
,
LaMotte-Mohs
R
,
Zuniga-Pflucker
JC
. Key players for T-cell regeneration . Curr Opin Hematol.
2010; ; 17 : :327.–332. 13.
Takenaka
K
,
Prasolava
TK
,
Wang
JC
, et al.
Polymorphism in Sirpa modulates engraftment of human hematopoietic stem cells . Nat Immunol.
2007; ; 8 : :1313.–1323. 14.
Huntington
ND
,
Di Santo
JP
. Humanized immune system (HIS) mice as a tool to study human NK cell development . Curr Top Microbiol Immunol.
2008; ; 324 : :109.–124. 15.
Manz
MG
,
Di Santo
JP
. Renaissance for mouse models of human hematopoiesis and immunobiology . Nat Immunol.
2009; ; 10 : :1039.–1042. 16.
Legrand
N
,
Ploss
A
,
Balling
R
, et al.
Humanized mice for modeling human infectious disease : challenges, progress, and outlook . Cell Host Microbe.
2009; ; 6 : :5.–9. 17.
Shultz
LD
,
Ishikawa
F
,
Greiner
DL
. Humanized mice in translational biomedical research . Nat Rev Immunol.
2007; ; 7 : :118.–130. 18.
Van Duyne
R
,
Pedati
C
,
Guendel
I
, et al.
The utilization of humanized mouse models for the study of human retroviral infections . Retrovirology.
2009; ; 6 : :76.. 19.
Baenziger
S
,
Tussiwand
R
,
Schlaepfer
E
, et al.
Disseminated and sustained HIV infection in CD34+ cord blood cell-transplanted Rag2−/− gamma c−/− mice . Proc Natl Acad Sci USA.
2006; ; 103 : :15951.–15956. 20.
An
DS
,
Poon
B
,
Ho Tsong Fang
R
, et al.
Use of a novel chimeric mouse model with a functionally active human immune system to study human immunodeficiency virus type 1 infection . Clin Vaccine Immunol.
2007; ; 14 : :391.–396. 21.
Berges
BK
,
Wheat
WH
,
Palmer
BE
, et al.
HIV-1 infection, CD4 T cell depletion in the humanized Rag2−/− gamma c−/− (RAG-hu) mouse model . Retrovirology.
2006; ; 3 : :76.. 22.
Gorantla
S
,
Sneller
H
,
Walters
L
, et al.
Human immunodeficiency virus type 1 pathobiology studied in humanized BALB/c-Rag2−/− gammac−/− mice . J Virol.
2007; ; 81 : :2700.–2712. 23.
Kumar
P
,
Ban
HS
,
Kim
SS
, et al.
T cell-specific siRNA delivery suppresses HIV-1 infection in humanized mice . Cell.
2008; ; 134 : :577.–586. 24.
Duc Dodon
M
,
Mesnard
JM
,
Barbeau
B
. Leucémies T induites par HTLV-1 : y a-t-il un avant et un après HBZ ? . Med Sci (Paris).
2010; ; 26 : :391.–396. 25.
Feuer
G
,
Fraser
JK
,
Zack
JA
, et al.
Human T-cell leukemia virus infection of human hematopoietic progenitor cells : maintenance of virus infection during differentiation in vitro and in vivo
. J Virol.
1996; ; 70 : :4038.–4044. 26.
Banerjee
P
,
Tripp
A
,
Lairmore
MD
, et al.
Adult T-cell leukemia/lymphoma development in HTLV-1-infected humanized SCID mice . Blood.
2010; ; 115 : :2640.–2648. 27.
Villaudy
J
,
Wencker
M
,
Gadot
N
, et al.
HTLV-1 propels thymic human T cell development in “human immune system” Rag2−/− gammac−/− mice . PLoS Pathogens.
2011;
7 : :e1002231.. 28.
Bente
DA
,
Melkus
MW
,
Garcia
JV
,
Rico-Hesse
R
. Dengue fever in humanized NOD/SCID mice . J Virol.
2005; ; 79 : :13797.–13799. 29.
Kuruvilla
JG
,
Troyer
RM
,
Devi
S
,
Akkina
R
. Dengue virus infection and immune response in humanized RAG2(−/−)gamma(c)(−/−) (RAG-hu) mice . Virology.
2007; ; 369 : :143.–152. 30.
Jaiswal
S
,
Pearson
T
,
Friberg
H
, et al.
Dengue virus infection, virus-specific HLA-A2 restricted immune responses in humanized NOD-scid IL2rgammanull mice . PLoS One.
2009; ; 4 : :e7251.. 31.
Dandri
M
,
Burda
MR
,
Torok
E
, et al.
Repopulation of mouse liver with human hepatocytes and in vivo infection with hepatitis B virus . Hepatology.
2001; ; 33 : :981.–988. 32.
De Jong
YP
,
Rice
CM
,
Ploss
A
. New horizons for studying human hepatotropic infections . J Clin Invest.
2010; ; 120 : :650.–653. 33.
Bissig
KD
,
Wieland
SF
,
Tran
P
, et al.
Human liver chimeric mice provide a model for hepatitis B and C virus infection and treatment . J Clin Invest.
2010; ; 120 : :924.–930. 34.
Washburn
ML
,
Bility
MT
,
Zhang
L
, et al.
A humanized mouse model to study hepatitis C virus infection, immune response, and liver disease . Gastroenterology.
2011; ; 140 : :1334.–1344. 35.
Morosan
S
,
Hez-Deroubaix
S
,
Lunel
F
, et al.
Liver-stage development of Plasmodium falciparum, in a humanized mouse model . J Infect Dis.
2006; ; 193 : :996.–1004. 36.
Legrand
N
,
Weijer
K
,
Spits
H
. Experimental model for the study of the human immune system : production and monitoring of “human immune system” Rag2−/− gamma c−/− mice . Methods Mol Biol.
2008; ; 415 : :65.–82. 37.
Van Lent
AU
,
Centlivre
M
,
Nagasawa
M
, et al.
In vivo modulation of gene expression by lentiviral transduction in “human immune system” Rag2−/− gammac−/− mice . Methods Mol Biol.
2010; ; 595 : :87.–115. 38.
Willinger
T
,
Rongvaux
A
,
Strowig
T
, et al.
Improving human hemato-lymphoid-system mice by cytokine knock-in gene replacement . Trends Immunol.
2011; ; 32 : :321.–327. 39.
Cogné
M
,
Duchez
S
,
Pascal
V
. Transgenèse animale et humanisation des anticorps : des souris pour des hommes . Med Sci (Paris).
2009; ; 25 : :1149.–1154. 40.
Shultz
LD
,
Saito
Y
,
Najima
Y
, et al.
Generation of functional human T-cell subsets with HLA-restricted immune responses in HLA class I expressing NOD/SCID/IL2r gamma (null) humanized mice . Proc Natl Acad Sci USA.
2010; ; 107 : :13022.–13027. |