| |
| Med Sci (Paris). 2012 January; 28(1): 69–75. Published online 2012 January 27. doi: 10.1051/medsci/2012281019.Les IAP au cœur de la signalisation NF-κB Jessy Cartier,1,2 Arthur Marivin,1,2 Jean Berthelet,1,2 and Laurence Dubrez1,2* 1Inserm UMR 866, faculté de médecine, université de Bourgogne, 7, boulevard Jeanne d’Arc, 21079Dijon Cedex, France 2Institut fédératif de recherche (IFR) 100, 21079Dijon Cedex, France |
Les protéines IAP (inhibitors of apoptosis proteins) ont été identifiées chez le baculovirus en 1993 par l’équipe de Miller, lors d’une recherche de protéines virales capables d’inhiber l’apoptose de cellules infectées [
1]. Des homologues ont ensuite été décrits chez la drosophile, les mammifères, le nématode C. elegans et le poisson zèbre. Les cellules de mammifères contiennent huit membres de cette famille : cIAP1, cIAP2 (cellular IAP1 et 2), XIAP (X-linked IAP), NAIP (neuronal apoptosis inhibitory protein), Apollon, Livin, ILP2 (IAP-like protein 2) et la survivine. Les premières études se sont focalisées sur la possible activité antiapoptotique de ces protéines et ont montré que la plupart d’entre elles étaient capables de lier directement certaines caspases. Si XIAP est un inhibiteur direct de ces protéases, cette activité n’a cependant pas été confirmée pour les autres IAP [
2]. L’existence d’anomalies d’expression des IAP dans des tumeurs d’origine différente et leur association à un mauvais pronostic ou à la résistance des cellules au traitement [
3] ont rapidement conduit au développement d’antagonistes, aujourd’hui en phase d’essais cliniques dans des traitements anticancéreux [3]. L’utilisation de ces antagonistes, la recherche de partenaires des IAP et l’analyse de modèles cellulaires issus d’organismes invalidés pour ces protéines ont permis de mettre en évidence un rôle important des IAP, principalement cIAP1, cIAP2 et XIAP, dans la signalisation cellulaire conduisant à l’activation des facteurs de transcription NF-κB (nuclear factor-κB). |
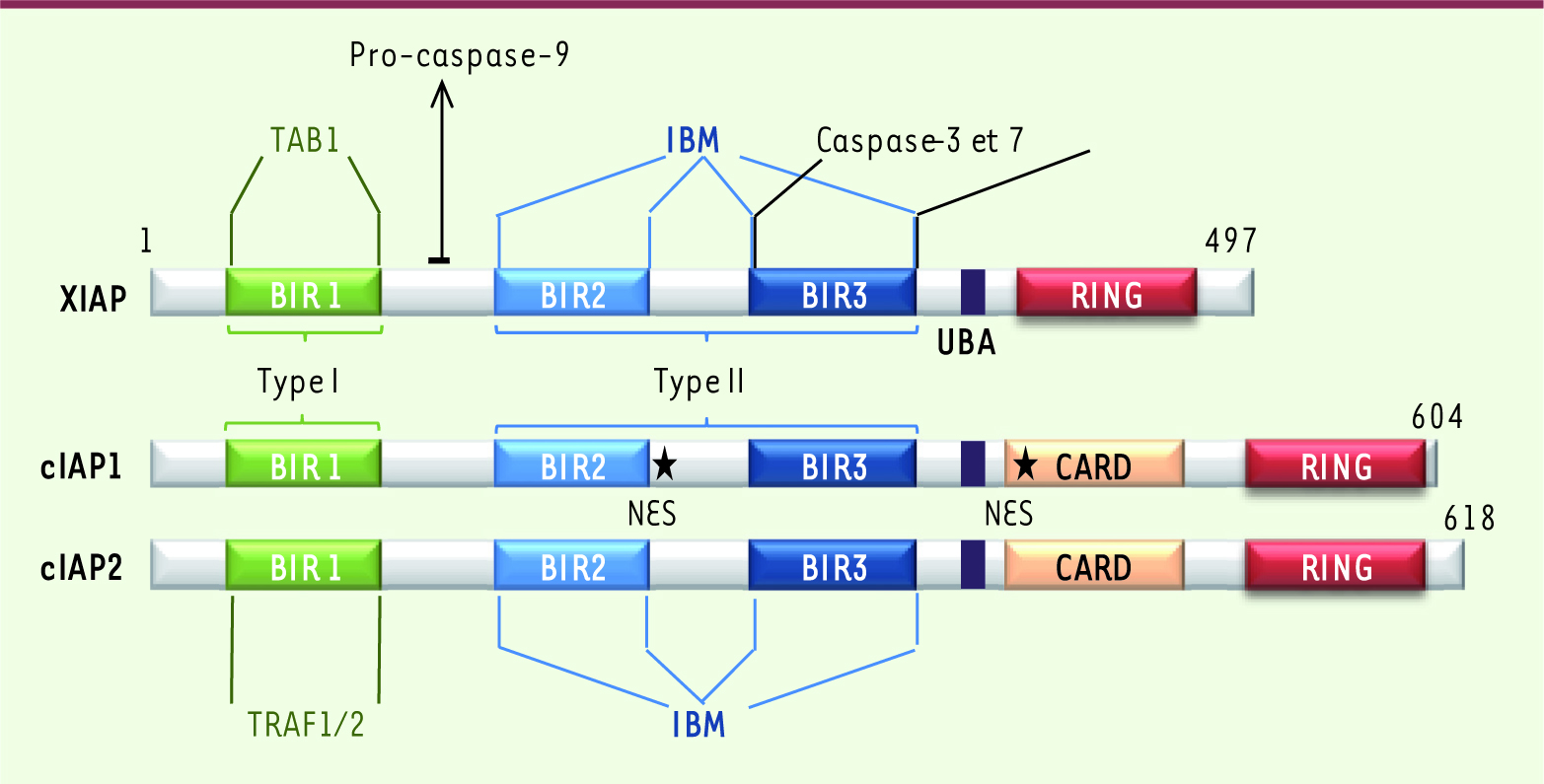
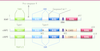
Relation structure-fonction des IAP La famille des IAP est définie par la présence, à l’extrémité amino-terminale des protéines, d’au moins une copie d’un domaine conservé d’interaction protéine-protéine nommé BIR (baculoviral IAP repeat) (voir Encadré). cIAP1, cIAP2 et XIAP possèdent aussi un domaine RING en position carboxy-terminale qui permet la dimérisation et confère à la protéine une activité E3-ubiquitine et NEDD8-ligase [
4], et un domaine UBA (ubiquitin-associated domain) de reconnaissance de chaînes d’ubiquitines [
5] (
Figure 1
et Encadré). De plus, cIAP1 et cIAP2 possèdent un domaine central CARD (caspase recruitment domain) régulateur de l’activité E3-ubiquitine ligase [
6]. L’activité des IAP est étroitement associée à leur capacité à interagir avec leurs partenaires protéiques via les domaines BIR et à stimuler leur ubiquitinylation grâce au domaine RING (voir Encadré).
 | Figure 1
Structure primaire de cIAP1, cIAP2 et XIAP. BIR : baculoviral IAP repeat; UBA : ubiquitin binding associated; CARD : caspase recruitment domain; NES : nuclear export signal.
|
Différents régulateurs de la signalisation NF-κB s’avèrent être des partenaires et cibles d’ubiquitinylation des IAP [2]. Il s’agit des adaptateurs TRAF1/2/3 (TNF receptor associated protein-1/2/3) [
7–
9], des kinases RIP1/2 (receptor-interacting protein-1/2) [
10,
11], NIK (NF-kB-inducing kinase) [
12,
13], ASK1 (apoptosis signal-regulating kinase 1) et TAK1 (TGFβ [transforming growth factor, beta 1]-activated kinase 1) [
14,
15], de la sous-unité IKKγ (appelée aussi NEMO : NF-kB essential modulator) régulatrice du complexe IKK (Iκ-B kinase) [
16,
31]. Les IAP catalysent la conjugaison de chaînes d’ubiquitines de type K48 (ubiquitines associées les unes aux autres par une liaison peptidique entre la glycine carboxy-terminale et la lysine 48 de l’ubiquitine précédente) sur les protéines TRAF2/3 et NIK. Cette modification permet la reconnaissance et la dégradation de la protéine par le complexe du protéasome [7–9, 13,
17]. Les IAP peuvent aussi stimuler la mono-ubiquitinylation ou une ubiquitinylation de type K63 ou K11 d’IKKγ et de RIP1/2 [10, 11, 16]. Ceci conduit à une modification de l’activité des protéines ou de leur recrutement dans des complexes de signalisation [10, 16]. |
BIR : baculoviral IAP repeat. Il est composé d’environ 70 acides aminés formant 4 à 5 hélices alpha et 3 feuillets bêta, maintenus par un atome de zinc. Ce sont des domaines d’interaction protéine-protéine. On distingue 2 types de domaines BIR. Le domaine de type I (BIR1) permet une interaction des IAP avec des molécules de signalisation cellulaire : interaction cIAP1/2-TRAF1/2 et XIAP-TAB1. Les domaines de type II (BIR2 et BIR3) présentent un sillon hydrophobe profond de liaison d’un motif peptidique conservé appelé IBM (IAP-binding motif). Ce motif consiste en un tétrapeptide contenant un résidu arginine ou sérine en position amino-terminale et un résidu hydrophobe en 3e ou 4e position. La liaison BIR-IBM n’est possible que si l’IBM est exposé à l’extrémité amino-terminale de la protéine. Ce motif est retrouvé à l’extrémité amino-terminale de la petite sous-unité des caspases-3, -7 et -9. Il est rendu accessible après le clivage protéolytique activateur. Le motif IBM de Smac (AVPI), l’inhibiteur endogène des IAP, est exposé après l’élimination du peptide signal, motif d’adressage mitochondrial. Ce motif AVPI a été utilisé pour la conception des antagonistes des IAP appelés Smac mimetics.
UBA : ubiquitin binding associated. Domaine constitué de 3 hélices α compactées. C’est un domaine de reconnaissance de chaînes d’ubiquitines, aussi désigné comme un récepteur d’ubiquitine. Il permettrait le recrutement des IAP dans des plateformes protéiques. Il est nécessaire à l’activité de signalisation et oncogénique des IAP [4].
CARD : caspase recruitment domain. Décrit comme un domaine de dimérisation homotypique, mais aucun partenaire du CARD des IAP n’est, à ce jour, identifié. Le CARD des IAP est un domaine de régulation de leur activité E3-ubiquitine ligase [5]. À noter la présence, dans le domaine CARD de cIAP1, d’une séquence NES permettant l’export nucléaire de la protéine lors de la différenciation.
RING. Ce domaine en doigt de zinc contient un motif consensus constitué de 6 à 7 cystéines et de 1 à 2 histidines (CX2CXNCXHX2-3CX2CXMCX2C) coordonné par un atome de zinc. Il permet le recrutement d’une enzyme E2 de conjugaison de l’ubiquitine et confère aux IAP une activité E3-ubiquitine ligase. Il possède aussi une activité E3-NEDD8- ligase [3]. II permet la dimérisation des IAP nécessaire à leur autoubiquitinylation
|
|
Les voies d’activation de NF-kB Les facteurs de transcription de la famille Rel/NF-κB sont actifs sous forme de dimères formés d’une sous-unité de la famille Rel (Rel A aussi appelée p65, Rel-B ou c-Rel) et d’une sous-unité NF-κB : la protéine p50 (NF-κB1) ou p52 (NF-κB2). Ils sont activés en réponse à la stimulation d’un récepteur par son ligand ou lors d’un stress cellulaire. Deux grandes voies d’activation ont été décrites en fonction du signal déclencheur et de la nature du facteur de transcription, toutes deux régulées par des processus de phosphorylation et d’ubiquitinylation [
18] : la voie classique ou canonique et la voie alternative. La première concerne principalement le dimère p50/RelA (Figure 2). Celui-ci est séquestré dans le cytoplasme sous forme inactive par IκB-α (NF-κB inhibitor α). Le complexe IKK, composé d’IKKα, β et γ, induit la phosphorylation d’IκB-α permettant son ubiquitinylation et sa dégradation par le protéasome et libérant ainsi le facteur de transcription. La seconde permet l’activation protéolytique de la sous-unité p52 (NF-κB2) à partir de son précurseur p100 (Figure 3). Elle implique la kinase NIK qui catalyse la phosphorylation du dimère IKKα. Celui-ci, en retour, stimule la phosphorylation du précurseur p100 nécessaire à sa protéolyse limitée par le complexe du protéasome et à son activation.
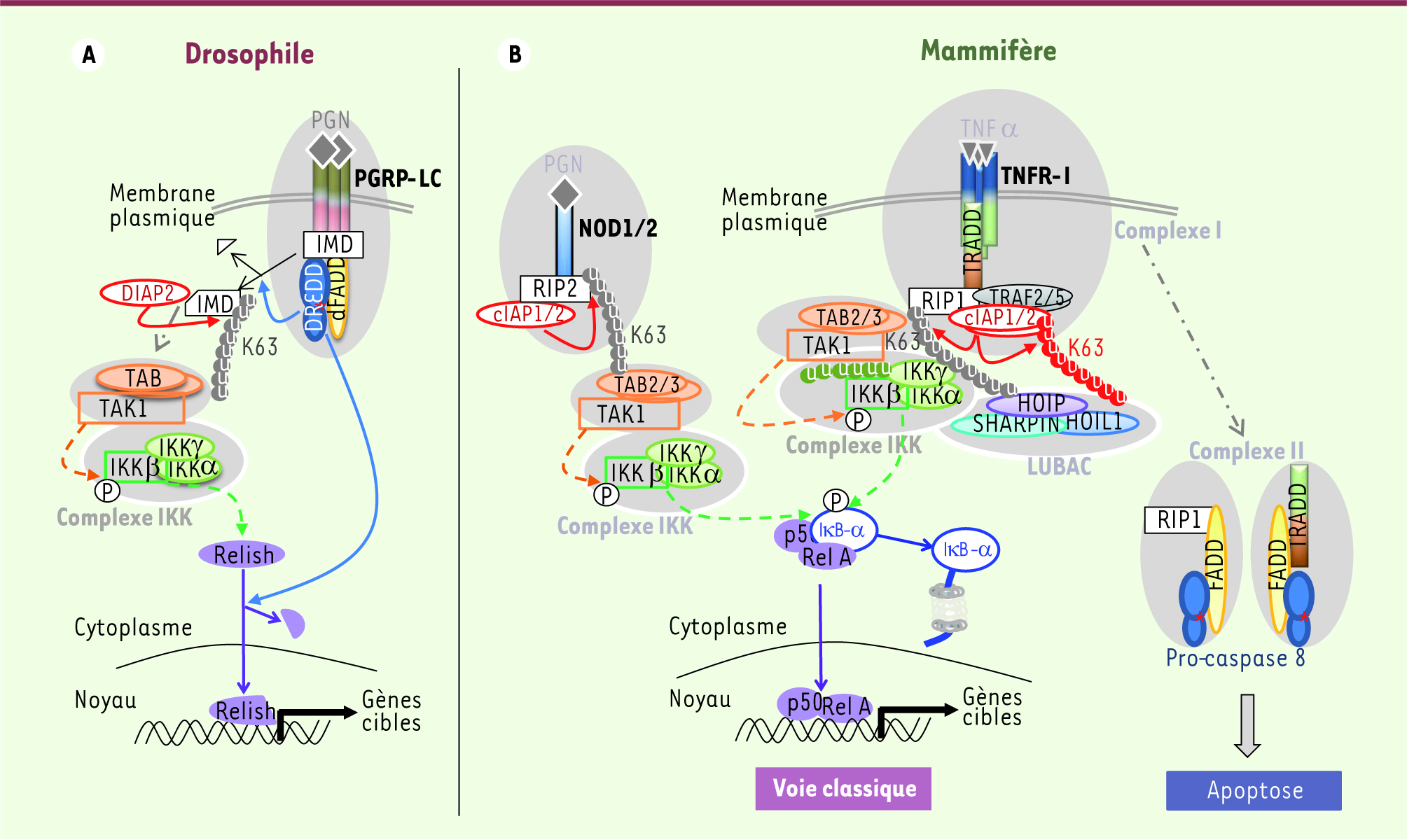
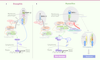 | Figure 2
Schéma comparant la voie IMD de la drosophile et les voies NOD et TNFRI des mammifères. A. Chez la drosophile, une stimulation du récepteur membranaire de peptidoglycanes (PGRP-LC : peptidoglycan recognition protein-LC) par un dérivé de bactéries Gram- (peptidoglycane : PGN) conduit au recrutement de IMD (homologue de RIP1), de la caspase DREDD et de l’adaptateur dFADD. DREDD clive la protéine IMD qui est ainsi reconnue par DIAP2. DIAP2 induit la poly-ubiquitinylaiton de type K63 d’IMD permettant le recrutement et l’activation des complexes TAB2/TAK1 et IKK conduisant à l’activation de Relish (homologue NF-κB). B. Chez les mammifères, cIAP1 et 2 catalysent l’ubiquitinylation K63 de RIP2 (voie des récepteurs NOD) et de RIP1 (voie TNFRI). De plus, cIAP1 et 2 induisent leur propre ubiquitinylation. Ces chaînes d’ubiquitines sont des signaux favorisant le rapprochement des complexes IKK (IKKβ/IKKα/IKKγ) et TAK1/TAB2/TAB3 et de LUBAC (HOIP/HOIL1/SHARPIN). Ceci conduit à l’ubiquitinylation linéaire d’IKKγ et de RIP1 par LUBAC participant à la stabilisation des complexes et à leur activation. TAK1 catalyse la phosphorylation d’IKKβ qui en retour stimule la phosphorylation d’IκB-α (NF-kB inhibitor α) permettant ainsi son ubiquitinylation et sa dégradation. L’absence des IAP ou des intermédiaires TRAF favorise la formation des complexes II conduisant à l’apoptose. |
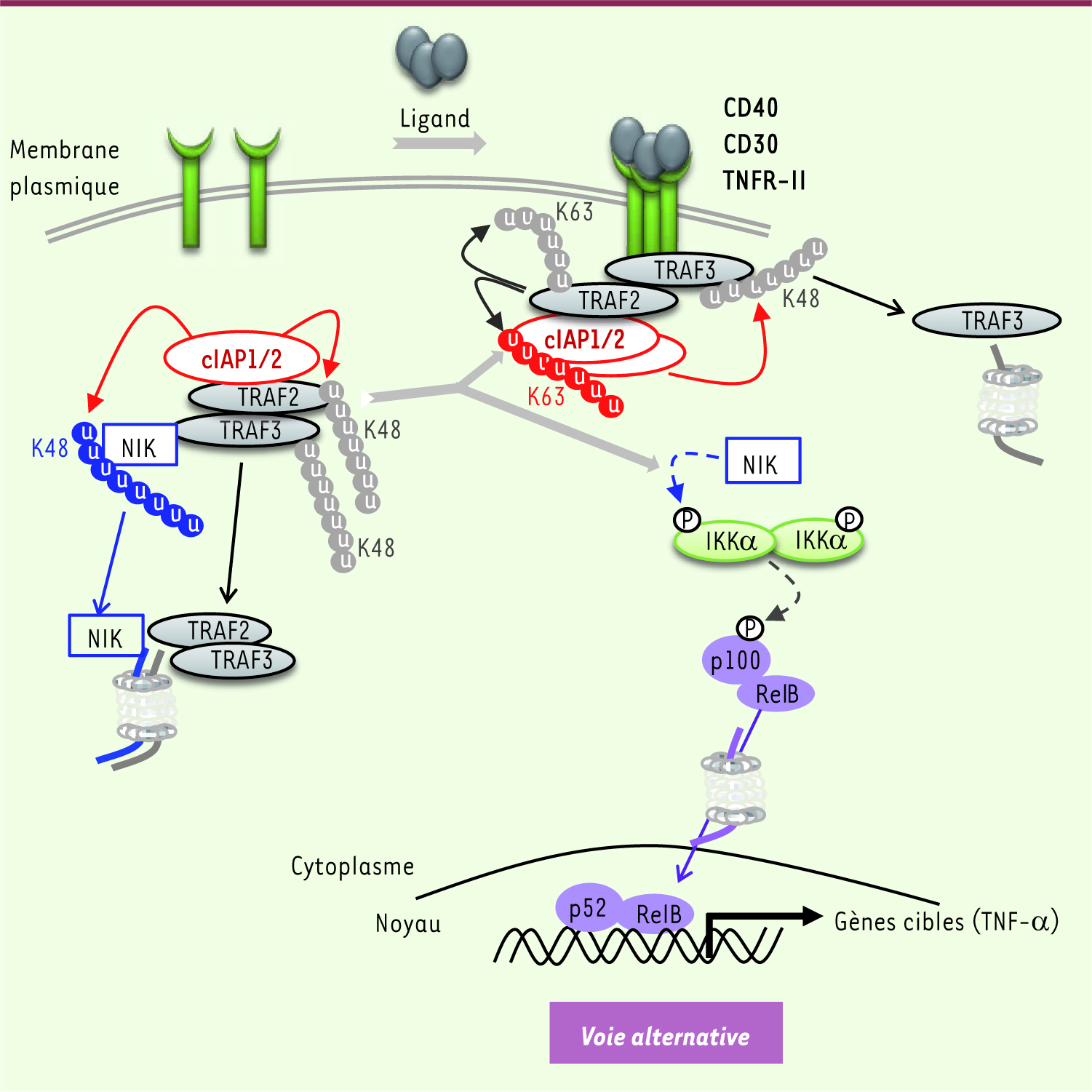
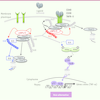 | Figure 3
Régulation de la voie alternative d’activation de NF-κB par cIAP1/2. En absence de stimulation des récepteurs, cIAP1 et 2 catalysent l’ubiquitinylation de type K48 de NIK, et, dans une moindre mesure, de TRAF2 et TRAF3, et stimulent leur dégradation par le protéasome. La fixation du ligand sur le récepteur conduit au recrutement des adaptateurs TRAF2/3 et de cIAP1/2 sur le récepteur, ce qui libère NIK. NIK phosphoryle les composants du complexe IKKα. IKKα induit la phosphorylation de p100 NF-κB, signal permettant son activation par une protéolyse limitée par le protéasome. La forme active p52 associée à la sous-unité RelB forme un facteur de transcription actif qui migre dans le noyau. Au niveau du récepteur, TRAF2 induit son auto-ubiquitinylation de type K63 et l’ubiquitinylation K63 de cIAP1. cIAP1 stimule l’ubiquitinylation de type K48 de TRAF3 l’orientant vers le protéasome pour une dégradation.
Régulation de la voie alternative d’activation de NF-κB par cIAP1/2. En absence de stimulation des récepteurs, cIAP1 et 2 catalysent l’ubiquitinylation de type K48 de NIK, et, dans une moindre mesure, de TRAF2 et TRAF3, et stimulent leur dégradation par le protéasome. La fixation du ligand sur le récepteur conduit au recrutement des adaptateurs TRAF2/3 et de cIAP1/2 sur le récepteur, ce qui libère NIK. NIK phosphoryle les composants du complexe IKKα. IKKα induit la phosphorylation de p100 NF-κB, signal permettant son activation par une protéolyse limitée par le protéasome. La forme active p52 associée à la sous-unité RelB forme un facteur de transcription actif qui migre dans le noyau. Au niveau du récepteur, TRAF2 induit son auto-ubiquitinylation de type K63 et l’ubiquitinylation K63 de cIAP1. cIAP1 stimule l’ubiquitinylation de type K48 de TRAF3 l’orientant vers le protéasome pour une dégradation. |
Les IAP contrôlent les deux voies d’activation : elles apparaissent nécessaires à la voie classique lors de la réponse immunitaire innée [
8–10], après stimulation du TNFRI (tumor necrosis factor [TNF]-receptor 1) [
19] ou après des lésions de l’ADN [16,
20]. Au contraire, elles sont un frein à l’activation de la voie alternative après une stimulation TNFRII, TWEAK/FN14 (TNF-like weak inducer of apoptosis), CD30 ou dans les lymphocytes B [13,
21,
22]. |
Rôle des IAP dans la régulation de l’immunité innée La participation des IAP à la réponse immunitaire innée et à l’activation de NF-κB a été mise en évidence pour la première fois chez la drosophile lors d’un crible génétique par ARN interférence de la réponse antimicrobienne [
23]. Dans ce modèle, une infection bactérienne active la signalisation IMD (immune deficiency) [
32] qui présentent de nombreuses similitudes avec la voie du TNFRI des mammifères (Figure 2) [23,
24]. L’activation, par des dérivés bactériens, de récepteurs PGRP (peptidoglycan recognition protein) conduit à leur agrégation et au recrutement de protéines contenant un domaine de mort (DD : death domain) : dFADD (homologue de FADD), la caspase DREDD (death related ced-3/Nedd2-like) et la protéine adaptatrice IMD (homologue de RIP1). Ce complexe permet l’activation de TAK1 puis du complexe IKK à l’origine de l’activation de Relish (homologue de NF-κB) et de la sécrétion consécutive de cytokines et de produits antibactériens. DIAP2 (d pour drosophile) participe à cette signalisation en catalysant la poly-ubiquitinylation de type K63 de la protéine IMD, une modification indispensable au recrutement et à l’activation de TAK1 (Figure 2) [24]. Chez les mammifères, les dérivés bactériens sont reconnus par les récepteurs cytosoliques NOD1/NOD2 (nucleotide-binding oligomerization domain containing 1/2) et membranaires TLR (toll-like receptors) [8, 10, 32]. Les ARN viraux peuvent être reconnus par RIG-1 (retinoic acid-inducible gene I). Le recrutement et l’activation de TAK1 par les récepteurs NOD nécessitent l’intermédiaire RIP2. Tout comme pour la voie IMD chez la drosophile, la poly-ubiquitinylation de type K63 de RIP2 par cIAP1/2 favorise le recrutement, par les récepteurs NOD1/2, de TAK1 et du complexe IKK à l’origine de l’activation de NF-κB [10] (Figure 2). Les IAP contrôlent aussi la signalisation TLR4 et RIG-1 par leur capacité à catalyser l’ubiquitinylation de type K48 et la dégradation de TRAF3 [8, 9]. Une stimulation de TLR4 et RIG-1 favorise le recrutement de différents adaptateurs, conduisant soit à la sécrétion de cytokines pro-inflammatoires via une activation des voies NF-κB et MAPK (mitogen-activated protein kinase), soit à la production d’interféron-β via IRF-3 (interferon regulatory factor-3). L’activation d’IRF-3 nécessite la présence de l’adaptateur TRAF3. cIAP1/2 sont recrutées au niveau du complexe du récepteur TLR4 et contrôlent la réponse des cellules en catalysant l’ubiquitinylation (de type K48) et la dégradation de TRAF3, ce qui bloque la voie IRF-3 aux dépens de la voie NF-κB/MAPK [8]. |
Rôle de cIAP1/2 dans l’activation de la voie classique NF-κB suite à une stimulation des récepteurs de la famille des TNFR Le rôle des cIAP1/2 dans la signalisation TNF a été suggéré dès l’identification de ces protéines en 1995 puisqu’elles ont été détectées au sein du complexe des récepteurs TNFR [2]. Une stimulation du récepteur TNFR1 conduit à la liaison de l’adaptateur TRADD (TNRF-associated via death domain) qui recrute à son tour TRAF2, TRAF5, cIAP1, cIAP2 et la kinase RIP1. Les IAP catalysent leur auto-ubiquitinylation et la polyubiquitinylation de type K63 de RIP1 [11]. Ces chaînes d’ubiquitines sont un signal reconnu par les domaines de reconnaissance de l’ubiquitine (UBD) de TAB2, IKKγ, et HOIP (HOIL1 [heme-oxidized IRP2 Ub ligase-1]-interacting protein) [19]. Ce signal permet le rapprochement des complexes : (1) TAK1/TAB2/TAB3, (2) IKKγ/IKKα/IKKβ et (3) LUBAC (linear ubiquitin chain assembly complex) composé de HOIL1/HOIP/SHARPIN (SHANK-associated RH domain interacting protein in postsynaptic density). Ce rapprochement stérique favorise l’ubiquitinylation linéaire d’IKKγ et de RIP1 par LUBAC et la phosphorylation d’IKKβ et d’IκB-α, nécessaires à l’activation de NF-κB [19]. Une inhibition de l’ubiquitinylation de RIP1, l’absence ou la dégradation de TRAF2 ou de cIAP1/2 favorisent la formation d’un complexe secondaire cytoplasmique (complexe II) composé de RIP1 ou TRADD, de FADD et de la procaspase-8, conduisant à l’activation de la caspase et à la mort cellulaire par apoptose [12, 22,
25] (Figure 2). |
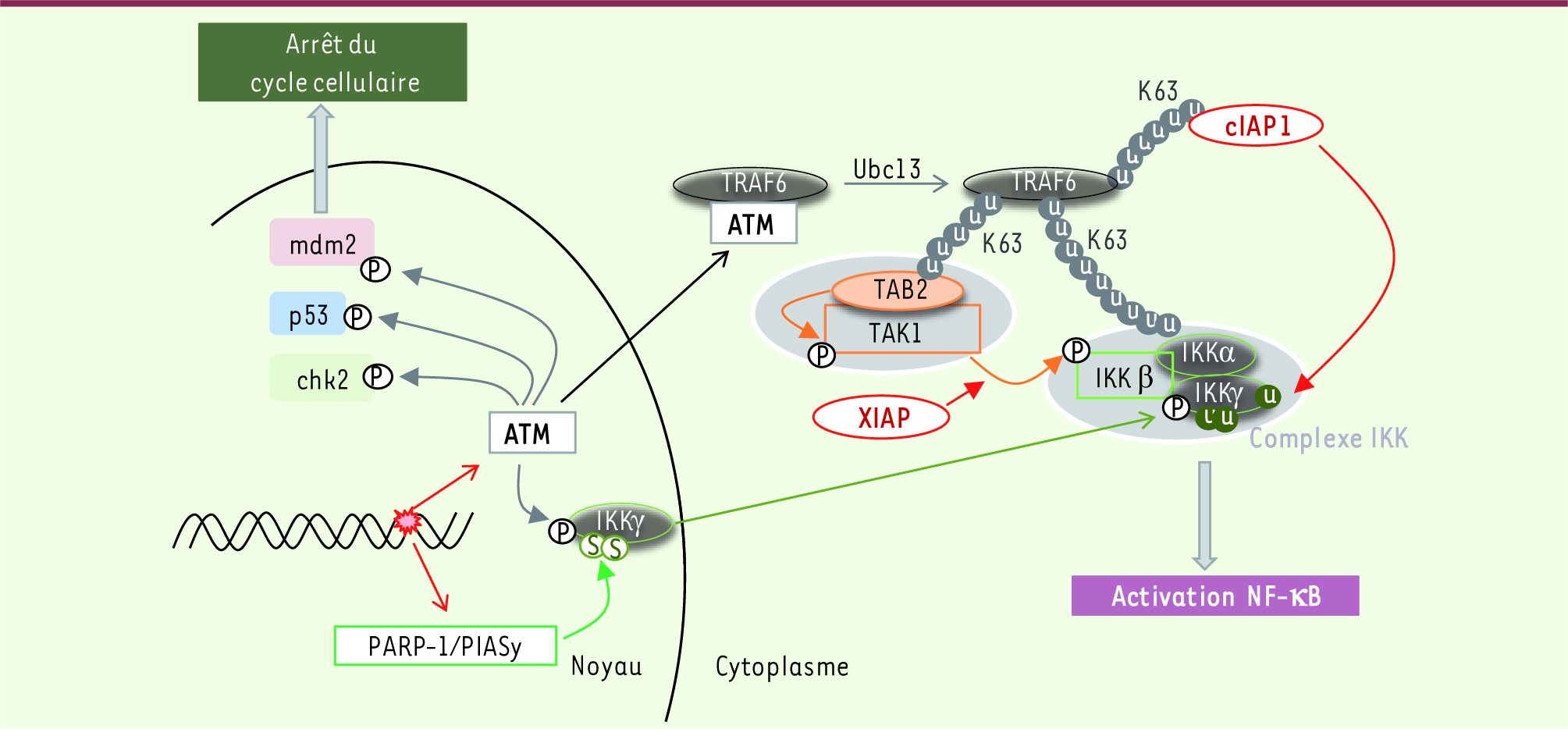
Influence des IAP dans l’activation de NF-κB induite par des lésions de l’ADN Des lésions de l’ADN conduisent à une activation du complexe de sumoylation PARP-1 (poly [ADP-ribose] polymerase 1)/PIASy (protein inhibitor of activated STAT) et de la kinase ATM (ataxia telangiectasia mutated). PARP-1/PIASy induit la sumoylation d’IKKγ et ATM stimule sa phosphorylation, qui permet son export nucléaire et son recrutement dans le complexe IKK. D’autre part, ATM est transloquée dans le cytoplasme où elle interagit avec l’adaptateur protéique TRAF6 et favorise sa poly-ubiquitinylation de type K63 par Ubc13. Ce signal ubiquitine permet : (1) le recrutement de cIAP1 grâce au domaine UBA de ce dernier ; (2) le recrutement du complexe TAB2-TAK1; et (3) le recrutement du complexe IKKγ/IKKα/IKKβ. La plateforme protéique ainsi formée favorise la phosphorylation de TAK1 et de IKKβ, la mono-ubiquitinylation et l’activation d’IKKγ conduisant à l’activation de NF-κB [16] (Figure 4). cIAP1 catalyse la mono-ubiquitinylation de IKKγ sur les résidus K277 et K309. Ses résidus sont aussi les sites de sumoylation par PIASy [20]. L’ubiquitine pourrait prendre le relais de SUMO, favoriser l’export nucléaire et préparer l’activation d’IKKγ. D’autre part, cIAP1 induit la mono-ubiquitinylation de la lysine 285 [16]. Dans la mesure où cette lysine est aussi le site de polyubiquitinylation linéaire par LUBAC [19], nous pouvons supposer que cIAP1 coopère avec LUBAC pour permettre l’activation d’IKKγ.
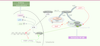 | Figure 4
Influence des IAP dans l’activation de NF-kB suite à des lésions de l’ADN. Dans cette voie de signalisation, cIAP1 permet la mono-ubiquitinylation (sur les résidus K277, K285, K309) et l’activation d’IKKγ nécessaires à l’activation de NF-κB. Une lésion de l’ADN conduit à l’activation du complexe de sumoylation PARP-1/PIASy et de la kinase ATM. PARP-1/PIASy induit la sumoylation d’IKKγ et ATM stimule sa phosphorylation. Ces deux événements permettent la translocation cytoplasmique d’IKKγ et son recrutement dans le complexe IKK. Par ailleurs, ATM lie et favorise l’ubiquitinylation de TRAF6. Cette ubiquitinylation est le signal reconnu par cIAP1/2, TAB2 et IKKβ. Le rapprochement des complexes de signalisation favorise la phosphorylation de TAK1 par TAB2, d’IKKβ par TAK1 et la mono-ubiquitinylation d’IKKγ par cIAP1. L’ensemble de ces modifications conduit à l’activation de NF-κB. |
Un rôle de XIAP dans cette voie de signalisation a aussi été démontré [20] : XIAP favorise la phosphorylation d’IKKβ par TAK1 en permettant ou en stabilisant l’association des deux molécules [20]. |
Influence de cIAP1/2 sur la voie alternative NF-κB En l’absence de stimulus, NIK est associée à cIAP1/2, TRAF2 et TRAF3. cIAP1 stimule l’ubiquitinylation de type K48 et la dégradation par le protéasome de NIK, TRAF2 et TRAF3 [13, 17]. Une stimulation des récepteurs CD30, CD40, TNFRII ou encore TWEAK/FN14 conduit au recrutement du complexe cIAP1/2/TRAF2/TRAF3 sur le récepteur. Ceci libère NIK, qui s’accumule et catalyse la phosphorylation du dimère IKKα, permettant l’activation de NF-κB [17, 22] (Figure 3). La dégradation de cIAP1/2 par des antagonistes favorise l’activation de NF-κB, laquelle peut conduire, dans certaines cellules tumorales, à l’expression et à la sécrétion de TNF-α responsable d’une réponse apoptotique [25]. |
Rôle de XIAP dans la signalisation TGF-β/BMP et dans l’activation de NF-κB Les cytokines de la famille TGF-β/BMP (bone morphogenetic protein) sont d’importants régulateurs de la morphogenèse, du développement, de la prolifération et de la différenciation cellulaires. Elles sont reconnues par un récepteur membranaire qui déclenche deux voies de signalisation intracellulaire. La première inclut les protéines de la famille Smad et conduit à l’activation du facteur de transcription Smad4. La seconde comprend le complexe TAB1/TAB2/TAK1 qui stimule les voies NF-κB et JNK (c-Jun N-terminal kinase). XIAP contrôle cette seconde voie de signalisation. Sa dimérisation via son domaine RING permet la dimérisation et l’activation de TAK1 [14]. Une ubiquitinylation de TAK1 par XIAP a aussi été mise en évidence [15]. Dans un modèle d’adénocarcinome hépatique avancé, une forte expression de XIAP favorise la dégradation de TAK1, ce qui interrompt la signalisation JNK et bloque l’apoptose induite par le TGF-β [14]. Dans des cellules tumorales mammaires, XIAP induit une ubiquitinylation de TAK1 qui n’aboutit pas à sa dégradation, favorisant ainsi l’association TAB1/TAK1 avec le complexe IKK et l’activation de NF-κB [15]. |
Des altérations des gènes codant les IAP ont été détectées dans des tumeurs humaines et murines. Les gènes codant cIAP1 et cIAP2 (respectivement birc2 et birc3) sont localisés sur le locus q21 du chromosome 11, une région amplifiée (amplicon 11q21) dans différentes tumeurs solides [3]. Une translocation chromosomique réciproque t(11;18)(q21;q21), qui entraîne la fusion des domaines BIR de cIAP2 et de la partie carboxy-terminale de la protéine MALT1 (mucosal-associated lymphoid tumors 1), est retrouvée dans 30 % des échantillons de lymphomes non hodgkiniens à cellules B de type MALT [
26]. Dans le myélome multiple, différents régulateurs de la voie alternative d’activation de NF-κB, dont cIAP1 et cIAP2, sont porteurs d’altérations génétiques ou épigénétiques [21]. Le syndrome lymphoprolifératif lié au chromosome X de type II est associé à une mutation délétère du gène codant XIAP [
27]. Indépendamment de la présence d’altérations génétiques et/ou épigénétiques, une surexpression de cIAP1, cIAP2 ou XIAP a été corrélée au caractère invasif ou à une mauvaise réponse au traitement [3]. Une activité oncogénique de cIAP1/2 a été démontrée dans des modèles de carcinomes hépatiques ou mammaires et d’ostéosarcomes chez la souris [3], mais les mécanismes de cette activité sont encore mal compris. En plus de leur activité régulatrice de NF-κB, de nouvelles fonctions des IAP dans la régulation des facteurs de transcription c-myc [
28] et E2F1 [
29] ont été décrites; elles pourraient aussi participer à cette activité oncogénique. |
Grâce à leur activité E3-ubiquitine ligase, les IAP apparaissent aujourd’hui comme des régulateurs centraux de l’activation de NF-κB dans différents contextes. Elles agissent comme des commutateurs de signaux, orientent la réponse des cellules vers une activation de la voie classique NF-κB aux dépens d’une signalisation alternative (apoptose, voie alternative NF-κB2 [13, 17, 22] ou voie IRF3 [8]). Cette fonction explique l’importance des IAP dans la physiopathologie de maladies associées à une activation exacerbée de NF-κB comme le myélome multiple [21] et le lymphome de MALT [26]. Les IAP sont des régulateurs incontournables de la différenciation des macrophages, de la réponse inflammatoire et de la réponse immunitaire innée [7–10]. De plus, une analyse génétique de poissons zèbres mutants a révélé le rôle essentiel de cette fonction de cIAP1 dans la survie des cellules endothéliales [
30]. De nombreuses molécules antagonistes des IAP ont été développées avec pour objectif initial de bloquer la capacité de XIAP à inhiber les caspases [3]. Ces molécules miment le domaine IBM de Smac (Figure 1), un inhibiteur endogène des IAP. Les molécules les plus efficaces sont des antagonistes bivalents, capables de neutraliser les différents sites d’interaction des domaines BIR des IAP (Figure 1). Il s’avère que ces molécules altèrent considérablement la signalisation NF-κB. Ce sont de puissants inhibiteurs de cIAP1/2, qui induisent leur dégradation en quelques minutes [3, 12]. Cinq de ces molécules, en association avec des agents chimiothérapeutiques, sont aujourd’hui testées dans des essais de phase I chez des patients porteurs de tumeurs solides ou de lymphomes [3]. Compte tenu des données récentes de la littérature qui élargissent considérablement le champ d’action des IAP, l’utilisation de ces antagonistes pourrait potentiellement être étendue à d’autres pathologies, en particulier les maladies inflammatoires. Cependant, l’utilisation de telles molécules, capables d’interférer avec des processus fondamentaux à l’homéostasie tissulaire, doit se faire avec la plus grande prudence. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Nous remercions Laurent Delva pour la correction du manuscrit. J. Cartier remercie l’association pour la recherche contre le cancer pour son aide doctorale de 4
e
année. Nous remercions l’association pour la recherche contre le cancer, les comités de la région Bourgogne de la ligue contre le cancer pour leur soutien.
|
|
ASK1
|
apoptosis signal-regulating kinase 1
|
|
ATM
|
ataxia telangiectasia mutated
|
|
BIR
|
baculoviral IAP repeat
|
|
BMP
|
bone morphogenetic protein
|
|
CARD
|
caspase recruitment domain
|
|
cIAP2
|
cellular IAP1 et 2 |
|
DD
|
death domain
|
|
DREDD
|
death related ced-3/Nedd2-like
|
|
HOIP
|
HOIL1 (heme-oxidized IRP2 Ub ligase-1)-interacting protein
|
|
IAP
|
inhibitors of apoptosis proteins
|
|
IKK
|
Iκ-B kinase
|
|
ILP2
|
IAP-like protein 2
|
|
IRF-3
|
interferon regulatory factor-3
|
|
IkB-α
|
NF-κB inhibitor α |
|
IMD
|
immune deficiency
|
|
JNK
|
c-Jun N-terminal kinase
|
|
LUBAC
|
linear ubiquitin chain assembly complex)naptic density
|
|
MALT1
|
mucosal-associated lymphoid tumors 1
|
|
MAPK
|
mitogen-activated protein kinase
|
|
NAIP
|
neuronal apoptosis inhibitory protein
|
|
NEMO (ou IKKg)
|
NF-κB essential modulator
|
|
NF-κB
|
nuclear factor-κB
|
|
NIK
|
NF-κB-inducing kinase
|
|
NOD1/NOD2
|
nucleotide-binding oligomerization domain containing 1/2
|
|
PARP-1
|
poly (ADP-ribose) polymerase 1
|
|
PGRP
|
peptidoglycan recognition protein
|
|
PIASy
|
protein inhibitor of activated STAT
|
|
RIG-1
|
retinoic acid-inducible gene I
|
|
RIP1/2
|
receptor-interacting protein-1/2
|
|
TAK1
|
TGF β [transforming growth factor, beta 1]-activated kinase 1
|
|
TRADD
|
TNRF-associated via death domain
|
|
TRAF1/2/3
|
TNF receptor associated protein-1/2/3
|
|
TLR
|
toll-like receptors
|
|
TNFRI
|
tumor necrosis factor [TNF]-receptor 1
|
|
TWEAK/FN14
|
TNF-like weak inducer of apoptosis
|
|
UBA
|
ubiquitin-associated domain
|
|
XIAP
|
X-linked IAP |
|
1.
Crook
NE
,
Clem
RJ
,
Miller
LK
. An apoptosis-inhibiting baculovirus gene with a zinc finger-like motif . J Virol.
1993; ; 67 : :2168.–2174. 2.
Dubrez-Daloz
L
,
Dupoux
A
,
Cartier
J
. IAPs: more than just inhibitors of apoptosis proteins . Cell Cycle.
2008; ; 7 : :1036.–1046. 4.
Broemer
M
,
Tenev
T
,
Rigbolt
KT
, et al.
Systematic in vivo RNAi analysis identifies IAPs as NEDD8-E3 ligases . Mol Cell.
2010; ; 40 : :810.–822. 5.
Gyrd-Hansen
M
,
Darding
M
,
Miasari
M
, et al.
IAPs contain an evolutionarily conserved ubiquitin-binding domain that regulates NF-kappaB as well as cell survival and oncogenesis . Nat Cell Biol.
2008; ; 10 : :1309.–1317. 6.
Lopez
J
,
John
SW
,
Tenev
T
, et al.
CARD-mediated autoinhibition of cIAP1’s E3 ligase activity suppresses cell proliferation and migration . Mol Cell.
2011; ; 142 : :569.–583. 7.
Dupoux
A
,
Cartier
J
,
Cathelin
S
, et al.
cIAP1-dependent TRAF2 degradation regulates the differentiation of monocytes into macrophages and their response to CD40 ligand . Blood.
2009; ; 113 : :175.–185. 8.
Tseng
PH
,
Matsuzawa
A
,
Zhang
W
, et al.
Different modes of ubiquitination of the adaptor TRAF3 selectively activate the expression of type I interferons and proinflammatory cytokines . Nat Immunol.
2010; ; 11 : :70.–75. 9.
Mao
AP
,
Li
S
,
Zhong
B
, et al.
Virus-triggered ubiquitination of TRAF3/6 by cIAP1/2 is essential for induction of interferon-beta (IFN-beta) and cellular antiviral response . J Biol Chem.
2010; ; 285 : :9470.–9476. 10.
Bertrand
MJ
,
Doiron
K
,
Labbe
K
, et al.
Cellular inhibitors of apoptosis cIAP1 and cIAP2 are required for innate immunity signaling by the pattern recognition receptors NOD1 and NOD2 . Immunity.
2009; ; 30 : :789.–801. 11.
Bertrand
MJ
,
Milutinovic
S
,
Dickson
KM
, et al.
cIAP1 and cIAP2 facilitate cancer cell survival by functioning as E3 ligases that promote RIP1 ubiquitination . Mol Cell.
2008; ; 30 : :689.–700. 12.
Varfolomeev
E
,
Blankenship
JW
,
Wayson
SM
, et al.
IAP antagonists induce autoubiquitination of c-IAPs, NF-kappaB activation, and TNFalpha-dependent apoptosis . Cell.
2007; ; 131 : :669.–681. 13.
Zarnegar
BJ
,
Wang
Y
,
Mahoney
DJ
, et al.
Noncanonical NF-kappaB activation requires coordinated assembly of a regulatory complex of the adaptors cIAP1, cIAP2, TRAF2 and TRAF3 and the kinase NIK . Nat Immunol.
2008; ; 9 : :1371.–1378. 14.
Lu
M
,
Lin
SC
,
Huang
Y
, et al.
XIAP induces NF-kappaB activation via the BIR1/TAB1 interaction and BIR1 dimerization . Mol Cell.
2007; ; 26 : :689.–702. 15.
Neil
JR
,
Tian
M
,
Schiemann
WP
. X-linked inhibitor of apoptosis protein and its E3 ligase activity promote transforming growth factor-{beta}-mediated nuclear factor-{kappa}B activation during breast cancer progression . J Biol Chem.
2009; ; 284 : :21209.–21217. 16.
Hinz
M
,
Stilmann
M
,
Arslan
SC
, et al.
A cytoplasmic ATM-TRAF6-cIAP1 module links nuclear DNA damage signaling to ubiquitin-mediated NF-kappaB activation . Mol Cell.
2010; ; 40 : :63.–74. 17.
Vallabhapurapu
S
,
Matsuzawa
A
,
Zhang
W
, et al.
Nonredundant and complementary functions of TRAF2 and TRAF3 in a ubiquitination cascade that activates NIK-dependent alternative NF-kappaB signaling . Nat Immunol.
2008; ; 9 : :1364.–1370. 18.
Baud
V
,
Jacque
E
. Voie alternative d’activation de NF-κB et cancer : amis ou ennemis ?
Med Sci (Paris).
2008; ; 24 : :1083.–1088. 19.
Gerlach
B
,
Cordier
SM
,
Schmukle
AC
, et al.
Linear ubiquitination prevents inflammation and regulates immune signalling . Nature.
2011; ; 471 : :591.–596. 20.
Jin
HS
,
Lee
DH
,
Kim
DH
, et al.
cIAP1, cIAP2, and XIAP act cooperatively via nonredundant pathways to regulate genotoxic stress-induced nuclear factor-kappaB activation . Cancer Res.
2009; ; 69 : :1782.–1791. 21.
Annunziata
CM
,
Davis
RE
,
Demchenko
Y
, et al.
Frequent engagement of the classical and alternative NF-kappaB pathways by diverse genetic abnormalities in multiple myeloma . Cancer Cell.
2007; ; 12 : :115.–130. 22.
Vince
JE
,
Chau
D
,
Callus
B
, et al.
TWEAK-FN14 signaling induces lysosomal degradation of a cIAP1-TRAF2 complex to sensitize tumor cells to TNFalpha . J Cell Biol.
2008; ; 182 : :171.–184. 23.
Gesellchen
V
,
Kuttenkeuler
D
,
Steckel
M
, et al.
An RNA interference screen identifies inhibitor of apoptosis protein 2 as a regulator of innate immune signalling in Drosophila . EMBO Rep.
2005; ; 6 : :979.–984. 24.
Paquette
N
,
Broemer
M
,
Aggarwal
K
, et al.
Caspase-mediated cleavage, IAP binding, and ubiquitination: linking three mechanisms crucial for Drosophila NF-kappaB signaling . Mol Cell.
2010; ; 37 : :172.–182. 25.
Petersen
SL
,
Wang
L
,
Yalcin-Chin
A
, et al.
Autocrine TNFalpha signaling renders human cancer cells susceptible to Smac-mimetic-induced apoptosis . Cancer Cell.
2007; ; 12 : :445.–456. 26.
Lucas
PC
,
Kuffa
P
,
Gu
S
, et al.
A dual role for the API2 moiety in API2-MALT1-dependent NF-kappaB activation: heterotypic oligomerization and TRAF2 recruitment . Oncogene.
2007; ; 26 : :5643.–5654. 27.
Rigaud
S
,
Latour
S
.
XIAP, un gène anti-apoptotique muté dans un nouveau syndrome lymphoprolifératif lié à l’X (XLP) . Med Sci (Paris).
2007; ; 23 : :235.–237. 28.
Xu
L
,
Zhu
J
,
Hu
X
, et al.
c-IAP1 cooperates with Myc by acting as a ubiquitin ligase for Mad1 . Mol Cell.
2007; ; 28 : :914.–922. 29.
Cartier
J
,
Berthelet
J
,
Marivin
A
, et al.
Cellular inhibitor of apoptosis protein-1 (ciap1) can regulate E2F1 transcription factor-mediated control of cyclin transcription . J Biol Chem.
2011; ; 286 : :26406.–26417. 30.
Santoro
MM
,
Samuel
T
,
Mitchell
T
, et al.
Birc2 (cIap1) regulates endothelial cell integrity and blood vessel homeostasis . Nat Genet.
2007; ; 39 : :1397.–1402. 31.
Gautheron
J
,
Courtois
G
. Les nouvelles fonctions de NEMO, la sous-unité régulatrice de la kinase activant NF-κB . Med Sci (Paris).
2008; ; 24 : :954.–959. 32.
Imler
JL
,
Ferrandon
D
. Le printemps de l’immunité innée couronné à Stockholm. Prix Nobel de médecine 2011 . Med Sci (Paris).
2011; ; 27 : :1019.–1024. |