| |
| Med Sci (Paris). 2012 February; 28(2): 149–151. Published online 2012 February 27. doi: 10.1051/medsci/2012282011.Cellules bêta pancréatiques La première lignée humaine fonctionnelle Philippe Ravassard,1* Paul Czernichow,2 and Raphaël Scharfmann3 1Institut du cerveau et de la moelle, CRICM CNRS UMR7225, Inserm, université Pierre et Marie Curie, hôpital Pitié-Salpêtrière, 47, boulevard de l’hôpital, 75013Paris, France 2Endocells, Paris, France 3Inserm U845, centre de recherche croissance et signalisation, Paris, France MeSH keywords: Animaux, Lignée de cellules transformées, Techniques de transfert de gènes, Humains, Cellules à insuline, cytologie, métabolisme, physiologie, Souris, Souris SCID, Souris transgéniques, Modèles biologiques, Phénotype, Culture primaire de cellules, méthodes, tendances, Ingénierie tissulaire |
Le pancréas est un organe complexe exerçant des fonctions exocrines et endocrines. Le pancréas exocrine est composé de cellules acinaires produisant et sécrétant les enzymes de la digestion qui seront acheminées vers l’intestin via le système des canaux pancréatiques. Le pancréas endocrine, qui contrôle l’homéostasie du glucose, est organisé en microorganes, les îlots de Langerhans, dispersés dans l’ensemble du tissu pancréatique et composés de cinq types cellulaires, α, β, δ, ε et PP sécrétant respectivement le glucagon, l’insuline, la somatostatine, la ghréline et le polypeptide pancréatique, les cellules insulino-sécrétrices étant de loin les plus nombreuses. Le diabète de type I est la conséquence d’une destruction auto-immune des cellules β alors que le diabète de type II résulte de la combinaison d’une résistance à l’insuline et d’une sécrétion d’insuline inadéquate. Ainsi, pour les deux formes de diabète, la masse fonctionnelle de cellules β n’est pas suffisante pour le contrôle de la glycémie. Ces deux pathologies touchent aujourd’hui près de 200 millions de personnes dans le monde. L’étude des cellules bêta humaines est importante pour comprendre non seulement leur fonctionnement mais aussi la physiopathologie des diabètes. L’accès à des cellules bêta humaines primaires est cependant extrêmement difficile. Il est donc nécessaire de disposer d’une source illimitée de telles cellules, ce que permet par exemple la production de lignées immortalisées. Ces lignées seront utiles pour le développement de nouvelles thérapies, soit pharmacologiques soit basées sur la transplantation de cellules. Au cours des trente dernières années, de nombreux groupes de recherche ont tenté de dériver des lignées de cellules bêta humaines, sans succès. Nous avons récemment développé une technologie originale qui nous a permis de générer la lignée EndoC-βH1 qui présente les caractéristiques fonctionnelles des cellules bêta humaines [1]. |
L’outil de départ : un modèle de pancréas transgénique humain Bien qu’il n’existe pas de lignées de cellules bêta pancréatiques humaines, de nombreuses lignées bêta existent chez les rongeurs. Une large proportion de ces lignées ont été produites à partir de souris transgéniques qui expriment le gène codant pour une protéine immortalisante, l’antigène T de SV40 (SV40LT, simian virus) sous le contrôle du promoteur de l’insuline [2, 3]. Dans ces souris transgéniques, le processus d’immortalisation a lieu pendant la phase d’ontogenèse de la cellule bêta. Nous nous sommes inspirés de cette approche et nous l’avons adaptée aux cellules humaines. Nous avons pour cela bénéficié de deux avancées expérimentales importantes.
- La première, issue des travaux du groupe de R. Scharfmann et P. Czernichow au début des années 2000, a rendu possible la génération de souris humanisées portant un pancréas humain mature et fonctionnel [4, 5]. Un fragment d’un bourgeon pancréatique provenant d’un fœtus humain est transplanté dans une souris immuno-incompétente (SCID, severe combined immunodeficient). Ce fragment est riche en progéniteurs pancréatiques et dépourvu de cellules matures. Six à huit mois plus tard, l’ébauche pancréatique est entièrement différenciée et la souris porte un « mini » pancréas humain fonctionnel capable de contrôler la glycémie de la souris hôte. Ainsi, un système dynamique récapitulant la différenciation et la morphogenèse du pancréas humain a été développé. L’ensemble de la procédure se fait en accord avec les lois de bioéthique en vigueur dans notre pays.
- La seconde avancée vient de la possibilité d’effectuer un transfert de gène dans ce modèle dynamique, comme nous l’avons montré. La transduction de l’ébauche pancréatique fœtale à l’aide de vecteurs lentiviraux permet l’intégration d’un transgène dans le génome de progéniteurs pancréatiques [6]. En combinant le modèle dynamique et la procédure de transfert de gène, il est ainsi possible de générer des pancréas humains transgéniques se développant chez la souris SCID.
|
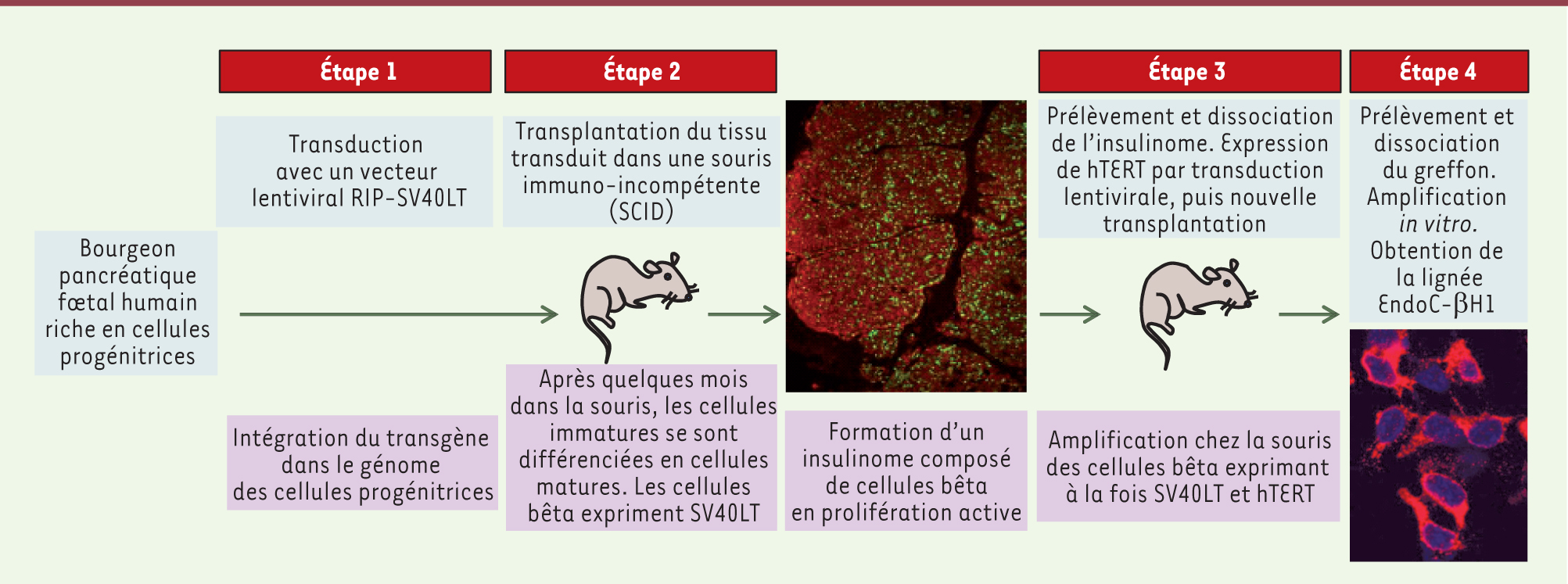
Établissement de lignées de cellules bêta humaines : une approche originale en plusieurs étapes Nous avons établi une procédure expérimentale en plusieurs étapes afin de générer des lignées de cellules bêta humaines (Figure 1). (1) La première étape consiste en un transfert du transgène immortalisant SV40LT - dont l’expression est contrôlée par le promoteur de l’insuline - dans des pancréas fœtaux humains immatures riches en progéniteurs non encore différenciés. Ainsi, toutes les cellules transduites par le vecteur lentiviral intègrent le transgène dans leur génome. Dans les cellules non différenciées, ne sécrétant pas d’insuline, ce promoteur reste silencieux. (2) La deuxième étape consiste à transplanter dans la souris SCID le tissu fœtal transduit. Les progéniteurs transduits qui se différencient en cellules bêta transcrivent le gène de l’insuline et parallèlement activent l’expression de SV40LT. Ces cellules bêta acquièrent alors un avantage sélectif et forment dans le greffon un insulinome. Ainsi, la grande originalité de notre système expérimental tient en ce qu’il n’immortalise pas directement des cellules bêta matures, mais ces mêmes cellules au cours de leur processus de différenciation. Huit à dix mois après transplantation, la formation d’insulinomes est observée de façon systématique. Ces insulinomes sont principalement composés de cellules proliférant activement et exprimant l’insuline (Figure 1). (3) Ces insulinomes sont prélevés et dissociés, et les cellules transduites avec un second vecteur lentiviral exprimant hTERT (telomerase reverse transcriptase), la sous-unité catalytique. L’ajout du transgène hTERT est destiné à prévenir la sénescence des cellules qui prolifèrent activement. Après transduction, les cellules sont transplantées chez une nouvelle souris SCID. Quelques mois plus tard, un nouvel insulinome se développe. Il est dissocié et les cellules sont amplifiées in vitro, aboutissant à l’établissement de lignées de cellules bêta humaines (étape 4). La lignée EndoC-βH1 est une de ces lignées et présente des propriétés similaires à celles de cellules bêta adultes.
 | Figure 1. Schéma récapitulatif de la procédure expérimentale de production de la lignée EndoC-βH1. Étape 1. Transduction d’ébauches fœtales humaines avec un vecteur lentiviral RIP-SV40LT exprimant l’antigène T de SV40 sous le contrôle du promoteur de l’insuline (RIP). Étape 2. Transplantation chez la souris SCID du tissu transduit. Après quelques mois on observe la formation d’un insulinome. L’analyse immunohistochimique d’une coupe de cet insulinome révèle un très grand nombre de cellules exprimant l’insuline (rouge) et coexprimant le marqueur de prolifération Ki67 (vert). Étape 3. Les insulinomes sont prélevés, dissociés et les cellules transduites avec un nouveau vecteur exprimant la telomerase reverse transcriptase humaine (hTERT) sous contrôle du promoteur de l’insuline. L’expression de ce transgène hTERT permet de prévenir la sénescence des cellules en prolifération active. Les cellules nouvellement transduites sont transplantées dans une souris SCID et conduisent à la formation d’un nouvel insulinome. Étape 4. Cet insulinome est prélevé, dissocié et les cellules amplifiées en culture, aboutissant à la production d’une lignée de cellules bêta pancréatiques. Les cellules de la lignée EndoC-βH1 sont positives pour l’expression de l’insuline (marquage rouge). Le noyau des cellules est visualisé en bleu. |
|
EndoC-bH1 : une lignée immortalisée fonctionnelle Les caractéristiques phénotypiques des cellules EndoC-bH1 ont été étudiées en détail. Ces cellules expriment le gène de l’insuline, synthétisent et stockent une insuline mature. Le niveau d’expression du gène de l’insuline et celui de l’insuline stockée dans les cellules EndoC-βH1 représentent 10 % des niveaux observés dans des cellules bêta humaines primaires. De plus, EndoC-βH1 exprime un large éventail de marqueurs spécifiques des cellules bêta : (1) les facteurs de transcription spécifiques ; (2) l’ensemble des protéines impliquées dans la réponse au glucose ; (3) les facteurs contrôlant la maturation de l’insuline ; (4) la machinerie de sécrétion de l’insuline et ses contrôles. Enfin, les marqueurs spécifiques des autres types cellulaires pancréatiques, exocrines ou endocrines ne sont pas exprimés. Nous avons aussi évalué les propriétés sécrétoires des cellules in vitro et démontré que la sécrétion d’insuline est directement régulée par le glucose. Elle peut être stimulée par des molécules sécrétagogues utilisées en clinique comme les sulfonylurées et les agonistes du GLP1 (glucagon-like peptide-1). La fonctionnalité des cellules EndoC-bH1 a été confirmée in vivo, puisqu’elles permettent le contrôle et la normalisation de la glycémie après leur greffe chez des souris diabétiques. En résumé, les cellules EndoC-βH1 sont phénotypiquement proches de cellules bêta humaines adultes, sécrètent l’insuline en réponse à la stimulation par le glucose et sont capables in vitro de restaurer le contrôle de la glycémie chez ces souris diabétiques. Ces lignées cellulaires représentent un outil unique et majeur qui doit permettre de tester de nombreuses hypothèses scientifiques concernant la physiologie des cellules bêta pancréatiques humaines. De plus, ces cellules se prêtent bien à la découverte de nouvelles molécules d’intérêt pharmacologique. Enfin, elles offrent un bon modèle cellulaire lors des évaluations précliniques de thérapie cellulaire du diabète. |
Les auteurs déclarent avoir une participation financière dans le capital de l’entreprise Endocells. |
1. Ravassard P, Hazhouz Y, Pechberty S, et al. A genetically engineered human pancreatic beta cell line exhibiting glucose-inducible insulin secretion . J Clin Invest. 2011; ; 121 : :3589.–3597. 2. Efrat S, Linde S, Kofod H, et al. Beta-cell lines derived from transgenic mice expressing a hybrid insulin gene-oncogene . Proc Natl Acad Sci USA. 1988; ; 85 : :9037.–9041. 3. Miyazaki J, Araki K, Yamato E, et al. Establishment of a pancreatic beta cell line that retains glucose-inducible insulin secretion: special reference to expression of glucose transporter isoforms . Endocrinology. 1990; ; 127 : :126.–132. 4. Castaing M, Peault B, Basmaciogullari A, et al. Blood glucose normalization upon transplantation of human embryonic pancreas into beta-cell-deficient SCID mice . Diabetologia. 2001; ; 44 : :2066.–2076. 5. Castaing M, Duvillie B, Quemeneur E, et al. Ex vivo analysis of acinar and endocrine cell development in the human embryonic pancreas . Dev Dyn. 2005; ; 234 : :339.–345. 6. Scharfmann R, Xiao X, Heimberg H, Mallet J, Ravassard P. Beta cells within single human islets originate from multiple progenitors . PLoS One. 2008; ; 3 : :e3559.. |