| |
| Med Sci (Paris). 2012 February; 28(2): 219–221. Published online 2012 February 27. doi: 10.1051/medsci/2012282023.Les dérivés neuraux des cellules souches pluripotentes échappent à la sénescence en gagnant le 1q sauteur Christine Varela,1 Jérôme Alexandre Denis,2 Marc Peschanski,2 and Nathalie Lefort2* 1CECS /AFM, centre d’étude des cellules souches, 91030Évry Cedex, France 2Inserm/UEVE UMR-861, I-STEM, AFM, institute des cellules souches pour le traitement et l’étude des maladies monogéniques, 5, rue Henri Desbruères, 91030 Évry Cedex, France MeSH keywords: Différenciation cellulaire, génétique, Aberrations des chromosomes, statistiques et données numériques, Chromosomes humains de la paire 1, Éléments transposables d'ADN, physiologie, Instabilité du génome, Humains, Neurones, cytologie, métabolisme, Cellules souches pluripotentes, Récidive, Facteurs temps, Translocation génétique |
Les cellules souches pluripotentes ont la capacité de se différencier en n’importe quelle cellule de l’organisme lorsqu’elles sont exposées à un environnement permissif adéquat. À ce titre, elles représentent un espoir majeur pour soigner de nombreuses maladies dégénératives, puisque l’on peut envisager de les utiliser pour remplacer les cellules malades ou perdues. L’agence réglementaire américaine (FDA, food and drug administration) a autorisé l’an dernier le lancement des premiers essais cliniques de thérapie cellulaire fondés sur des cellules différenciées à partir de cellules souches pluripotentes. Dans tous ces essais en cours, il s’agit de cellules progénitrices du système nerveux (central ou rétinien). |
Stabilité des génomes au cours du temps L’application de ces techniques thérapeutiques à partir de cellules produites en laboratoire à un grand nombre de patients est un des objectifs majeurs de ces nouvelles approches fondées sur des lignées cellulaires que l’on peut faire proliférer massivement. Cette capacité des cellules souches pluripotentes pose, on le sait, la question de leur stabilité génomique au cours des passages, et de nombreux travaux ont montré, ces dernières années, qu’il fallait rechercher soigneusement les dérives génomiques dans les cellules indifférenciées qui peuvent effectivement acquérir des anomalies chromosomiques [1, 2]. Nous avions ainsi signalé il y a trois ans l’apparition d’une duplication locale dans la région 20q11.21 dans de nombreuses cellules cultivées au-delà de plusieurs dizaines de passages [3, 4]. Ces contrôles effectués sur les cellules indifférenciées ne sont toutefois pas suffisants. Les essais cliniques en cours reposent en effet, comme beaucoup de protocoles actuels de différenciation, sur la différenciation partielle des cellules pluripotentes le long d’un lignage - ici le lignage neural - permettant d’atteindre un précurseur intermédiaire lui-même largement amplifiable. Nous nous sommes donc intéressés aux anomalies chromosomiques qui, n’existant pas dans les cellules indifférenciées, pouvaient apparaître dans ces progéniteurs intermédiaires au cours de leur amplification. Notre attention a été particulièrement attirée par les progéniteurs neuraux parce que, outre le fait qu’il s’agissait des produits cellulaires aujourd’hui déjà utilisés en clinique1, l’équipe d’Oliver Brüstle (Institute of reconstructive neurobiology, université de Bonn, et Life and Brain GmbH, Allemagne) a publié récemment une étude qui montrait que ces cellules étaient capables de réaliser un nombre de divisions considérable au cours de plusieurs dizaines de passages (plus de 100, donc sans doute plusieurs centaines de cycles de réplication dans l’une de leurs expériences) [5]. Nous avons également observé cette capacité de façon très systématique lors de la différenciation neurale d’une demi-douzaine de lignées de cellules souches pluripotentes humaines, d’origine embryonnaire (cellules ES, embryonic stem) ou induites par reprogrammation (iPS, induced pluripotent stem), alors que la différenciation dans d’autres lignages - vers des progéniteurs mésodermiques, kératinocytaires ou mélanocytaires - aboutissait à une entrée en sénescence après 10 à 20 passages (soit 40 à 60 divisions). La capacité proliférative exceptionnelle des progéniteurs neuraux nous a surpris car elle semblait échapper à ce que l’on appelle la limite de Hayflick [6], qui fonde le concept selon lequel tous les organismes vivants sont composés de cellules programmées pour accomplir un nombre limité de divisions. Cette limite se situe vraisemblablement chez l’homme autour d’une cinquantaine de divisions. |
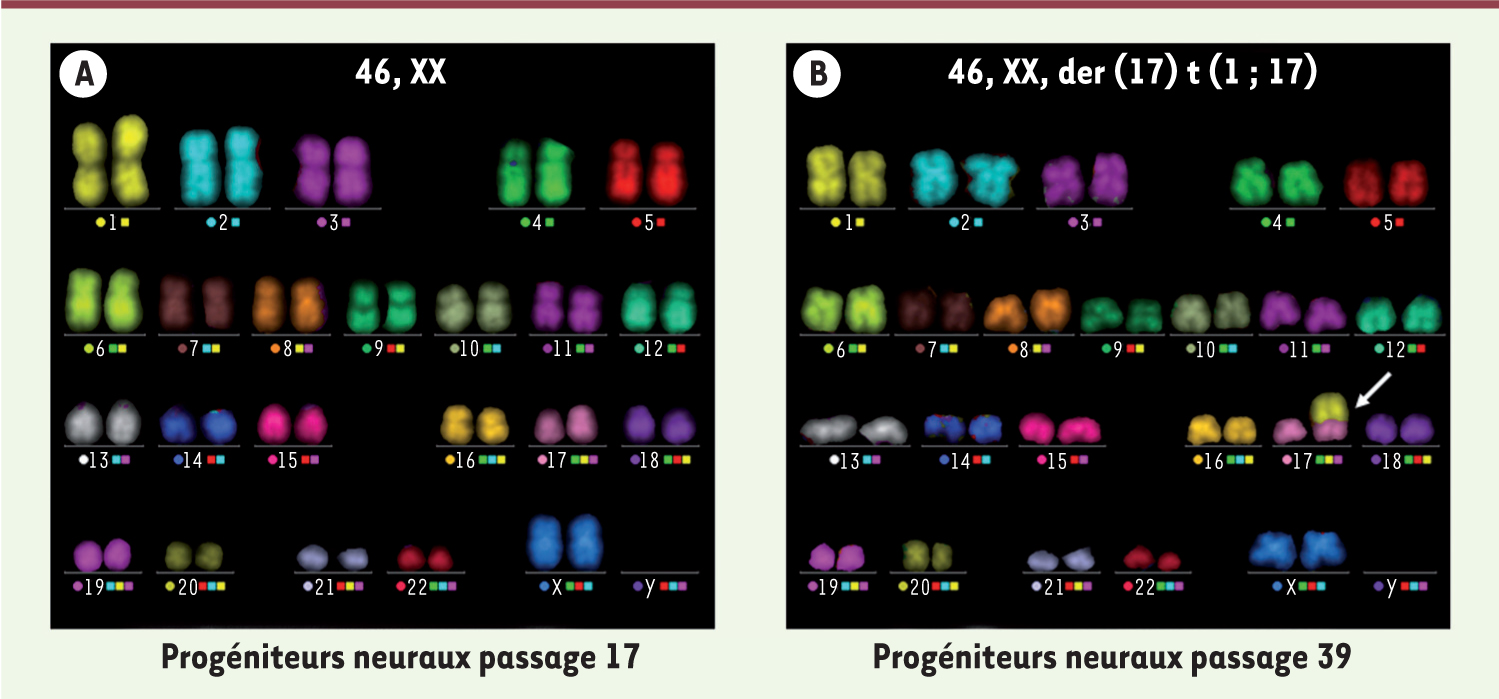
Identification d’un remaniement chromosomique récurrent dans des cultures à long terme de progéniteurs neuraux issus de cellules souches pluripotentes Nous avons donc repris systématiquement la recherche d’anomalies génomiques dans les dérivés neuraux des lignées de cellules souches pluripotentes humaines que nous cultivions (six lignées de cellules ES et une lignée d’iPS), à l’aide des techniques de G-banding et d’hybridation in situ fluorescente multicouleur (mFISH), en confirmant nos résultats avec des hybridations génomiques comparatives sur puces à ADN (ou microarray CGH). Après de longues périodes de culture (au-delà de la limite de Hayflick), nous avons de fait détecté systématiquement, dans ces progéniteurs neuraux, une duplication du bras long du chromosome 1 (bras 1q), absente dans les cellules souches pluripotentes [7]. Cette duplication du bras 1q était accompagnée d’une translocation du bras surnuméraire sur un autre chromosome (aléatoire) (Figure 1). Le chromosome 1q de l’Homme est synténique des chromosomes 1 et 3 de la souris. Chez la souris, les trisomies 1 sont les anomalies les plus fréquemment observées dans les cultures à long terme de cellules souches neurales et de neurosphères [8, 9]. Par ailleurs, ce phénomène de duplication/translocation aléatoire a été décrit dans des tumeurs malignes diverses, et a été appelé « translocation sauteuse » (jumping translocation, JT) [10].
 | Figure 1. Analyse par hybridation in situ fluorescente multicouleur (mFISH). Une série de sondes marquées par une combinaison de cinq fluorochromes est hybridée aux chromosomes en métaphase. Chaque paire de chromosomes est « peinte » d’une couleur qui lui est propre. A. Progéniteurs neuraux issus de la différenciation de cellules souches pluripotentes humaines. Après 17 passages, aucun remaniement chromosomique n’est observé. B. Après 39 passages une translocation sauteuse (jumping translocation) est observée (flèche blanche). Une portion du chromosome 1 (en jaune) est transloquée sur les bras courts du chromosome 17. |
|
Conséquence de l’identification d’une translocation sauteuse dans les progéniteurs neuraux Nous nous sommes intéressés au potentiel de différenciation de ces progéniteurs neuraux mutés en neurones post-mitotiques en culture. Certains en étaient toujours capables, et se comportaient comme des progéniteurs neuraux sains, mais d’autres ne l’étaient plus, leur potentiel étant alors fortement biaisé vers l’autorenouvellement. La présence de jumping translocation du chromosome 1q était donc susceptible d’altérer le potentiel de différenciation des progéniteurs neuraux in vitro et nous avons cherché à l’apprécier également in vivo, après transplantation des cellules dans le striatum de rats immunodéficients. Après sept semaines de xénogreffe, les greffons issus de cellules saines contrôles ont été retrouvés, mais pas ceux formés à partir de cellules porteuses d’une duplication du chromosome 1q. Cela semble indiquer que la présence d’un 1qJT ne s’accompagne pas forcément d’une prolifération incontrôlée après greffe, mais bien évidemment ne garantit pas que des greffons porteurs de l’anomalie soient sans danger dans le cadre d’une thérapie cellulaire. La question de la dangerosité du 1qJT est en effet clairement posée par les données de la littérature sur cette anomalie chromosomique. Chez l’Homme, des translocations sauteuses du chromosome 1q ont été observées dans des hémopathies malignes [11] ainsi que dans des tumeurs solides (cancers du sein, hépatocarcinomes, chordomes, rétinoblastomes, tumeurs cérébrales pédiatriques). La présence de translocations sauteuses du chromosome 1q est toujours associée à un mauvais pronostic chez les patients [12]. Ces données suggèrent que la région 1q amplifiée contient des gènes dont la dérégulation fournit un avantage qui s’exprime à la fois dans les cellules cancéreuses et lors de la culture à long terme de progéniteurs neuraux. La première étape d’une translocation sauteuse est liée à une décondensation hétérochromatique, conduisant à une déstabilisation centromérique. Une endoreduplication partielle se produirait alors facilitant la formation de cette translocation [11]. Nous avons effectivement observé une telle décondensation de l’hétérochromatine centromérique du chromosome 1 dans certains des progéniteurs neuraux porteurs de la 1qJT. Il est intéressant de noter que la décondensation du centromère du chromosome 1 est également caractéristique d’une pathologie non cancéreuse, le syndrome ICF (immunodéficience combinée [I], instabilité de l’hétérochromatine paracentromérique [C] et dysmorphie faciale [F]). Cette maladie est liée à une hypométhylation de l’ADN et est souvent causée par des mutations du gène DNMT3B, qui code pour une ADN méthyltransférase [13]. Les progéniteurs cellulaires dérivés de cellules souches pluripotentes devraient à terme, si les essais en cours ou projetés se révèlent positifs, être utilisés dans le cadre de thérapies cellulaires et tissulaires très nombreuses. Nos résultats démontrent la nécessité de s’assurer de l’intégrité chromosomique à toutes les étapes de la préparation du produit de thérapie cellulaire, puisque l’on retrouve des anomalies chromosomiques systématisées non seulement dans les cellules souches indifférenciées mais également dans des cellules déjà engagées dans un lignage. Toutefois, comme le souligne le commentaire qui accompagne notre article [14], il est encourageant de constater le caractère récurrent de l’anomalie chromosomique identifiée dans les progéniteurs neuraux, qui facilitera la mise au point d’un contrôle qualité systématique. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article |
Ce travail a été soutenu par l’association française contre les myopathies, ainsi que par l’Inserm, le framework program (FP)7 de l’union européenne (NeuroStemCell) et l’ANR (HEScreen).
|
Footnotes |
1. International Stem Cell Initiative. , Amps K, Andrews PW, Anyfantis G, et al. Screening ethnically diverse human embryonic stem cells identifies a chromosome 20 minimal amplicon conferring growth advantage . Nat Biotechnol. 2011; ; 29 : :1132.–1144. 2. Crook JM, Hei D, Stacey G. The international stem cell banking initiative (ISCBI): raising standards to bank on . In Vitro Cell Dev Biol Anim. 2010; ; 46 : :169.–172. 3. Lefort N, Feyeux M, Bas C, et al. Human embryonic stem cells reveal recurrent genomic instability at 20q11.21 . Nat Biotechnol. 2008; ; 26 : :1364.–1366. 4. Lefort N, Feyeux M, Bas C, et al. Les cellules souches embryonnaires humaines révèlent l’existence d’une région hautement instable du génome . Med Sci (Paris). 2009; ; 25 : :99.–101. 5. Koch P, Opitz T, Steinbeck JA, et al. A rosette-type, self-renewing human ES cell-derived neural stem cell with potential for in vitro instruction and synaptic integration . Proc Natl Acad Sci USA. 2009; ; 106 : :3225.–3230. 6. Hayflick L. The limited in vitro lifetime of human diploid cell strains . Exp Cell Res. 1965; ; 37 : :614.–636. 7. Varela C, Denis JA, Polentes J, et al. Recurrent genomic instability of chromosome 1q in neural derivatives of human embryonic stem cells . J Clin Invest. 2012; ; 122 : :569.–574. 8. Conti L, Cattaneo E. Neural stem cell systems: physiological players or in vitro entities ? Nat Rev Neurosci. 2010; ; 11 : :176.–187. 9. Diaferia GR, Conti L, Redaelli S, et al. Systematic chromosomal analysis of cultured mouse neural stem cell lines . Stem Cells Dev. 2011; ; 20 : :1411.–1423. 10. Lejeune J, Maunoury C, Prieur M, et al. A jumping translocation (5p;15q), (8q;15q), and (12q;15q) (author’s transl) . Ann Genet. 1979; ; 22 : :210.–213. 11. Sawyer JR, Tricot G, Mattox S, et al. Jumping translocations of chromosome 1q in multiple myeloma: evidence for a mechanism involving decondensation of pericentromeric heterochromatin . Blood. 1998; ; 91 : :1732.–1741. 12. Faria C, Miguens J, Antunes JL. Pediatric brain tumors: genetics and clinical outcome . J Neurosurg Pediatr. 2010; ; 5 : :263.–270. 13. Ehrlich M, Jackson K, Weemaes C. Immunodeficiency centromeric region instability, facial anomalies syndrome (ICF) . Orphanet J Rare Dis. 2006; ; 1 : :2.. 14. Harrison NJ. Genetic instability in neural stem cells: an inconvenient truth ? J Clin Invest. 2012; ; 122 : :484.–486. |