| |
| Med Sci (Paris). 2012 March; 28(3): 237–239. Published online 2012 April 6. doi: 10.1051/medsci/2012283003.Les facteurs de virulence ciblent des protéines clés de l’interactome de l’hôte Anne-Ruxandra Carvunis1,2* and Matija Dreze1,2 1Center for Cancer Systems Biology (CCSB) and Department of Cancer Biology, Dana-Farber Cancer Institute, Boston, MA 02215, États-Unis 2Department of Genetics, Harvard Medical School, Boston, MA 02115, États-Unis MeSH keywords: Protéines bactériennes, physiologie, Interactions hôte-pathogène, Modèles biologiques, Cellules végétales, microbiologie, Maladies des plantes, immunologie, Protéines végétales, Plantes, Virulence |
Les plantes jouent un rôle central dans la plupart des écosystèmes par leur capacité à convertir l’énergie solaire en énergie « biologique ». Unique source d’oxygène gazeux sur terre, les plantes représentent aussi la source principale de l’alimentation humaine et fournissent carburants fossiles et fibres textiles. Pour répondre aux défis agronomiques et environnementaux présents et futurs, il est primordial d’acquérir une connaissance approfondie des mécanismes contrôlant les processus biochimiques et moléculaires retrouvés spécifiquement chez les plantes. À cette fin, nous nous sommes intéressés plus particulièrement aux interactions entre plantes et phytopathogènes à l’échelle moléculaire. En plus de perspectives agronomiques et environnementales évidentes, nos travaux suggèrent l’existence de principes universels régissant l’organisation des systèmes immunitaires lors d’une interaction hôte-pathogène. |
Interactions entre plantes et phytopathogènes : le modèle zigzag Vingt ans de recherche fondamentale utilisant l’Arabette des dames (Arabidopsis thaliana) comme organisme modèle ont abouti à un concept surnommé zigzag, décrivant à l’échelle moléculaire les interactions dynamiques entre cellules végétales et phytopathogènes [1]. La détection de molécules du « non-soi » par des récepteurs membranaires déclenche une première ligne de défense immunitaire générique, le « zig ». Néanmoins, de nombreux pathogènes sont capables d’injecter à l’intérieur des cellules végétales des effecteurs moléculaires qui, affaiblissant l’effet du zig, augmentent la susceptibilité à l’infection : le « zag ». En réponse, des récepteurs intracellulaires semblent pouvoir reconnaître le « soi modifié » et provoquer une seconde vague de défense immunitaire, un second zig. Le degré de résistance des plantes aux pathogènes dépend de l’amplitude de ces deux lignes de défense, ainsi que de l’intensité de l’attaque. Malgré son élégance, le modèle zigzag repose sur des hypothèses qui, pour la plupart, n’ont pas été démontrées systématiquement. En particulier, l’identité des acteurs du système immunitaire demeure largement inconnue, mis à part certains groupes de protéines (principalement des récepteurs). De plus, les interactions physiques que les protéines de l’immunité établissent entre elles et avec les effecteurs pathogéniques ont été peu étudiées. |
L’approche interactomique Aujourd’hui, il apparaît clair que les interactions physiques entre protéines forment des réseaux complexes et hautement dynamiques (interactomes), qui sous-tendent les relations génotype-phénotype [2]. La description expérimentale de ces réseaux (cartographie) est indispensable pour une compréhension globale des systèmes biologiques - tels que l’immunité - et des mécanismes moléculaires correspondants. L’établissement de cartes interactomiques a offert une foison de ressources dans les espèces non végétales. Malgré une abondance de connaissances moléculaires et génétiques, il existe un manque notoire de données expérimentales décrivant les interactions entre protéines pour l’Arabette des dames (et pas uniquement entre protéines de l’immunité), et plus généralement pour les espèces du monde végétal. |
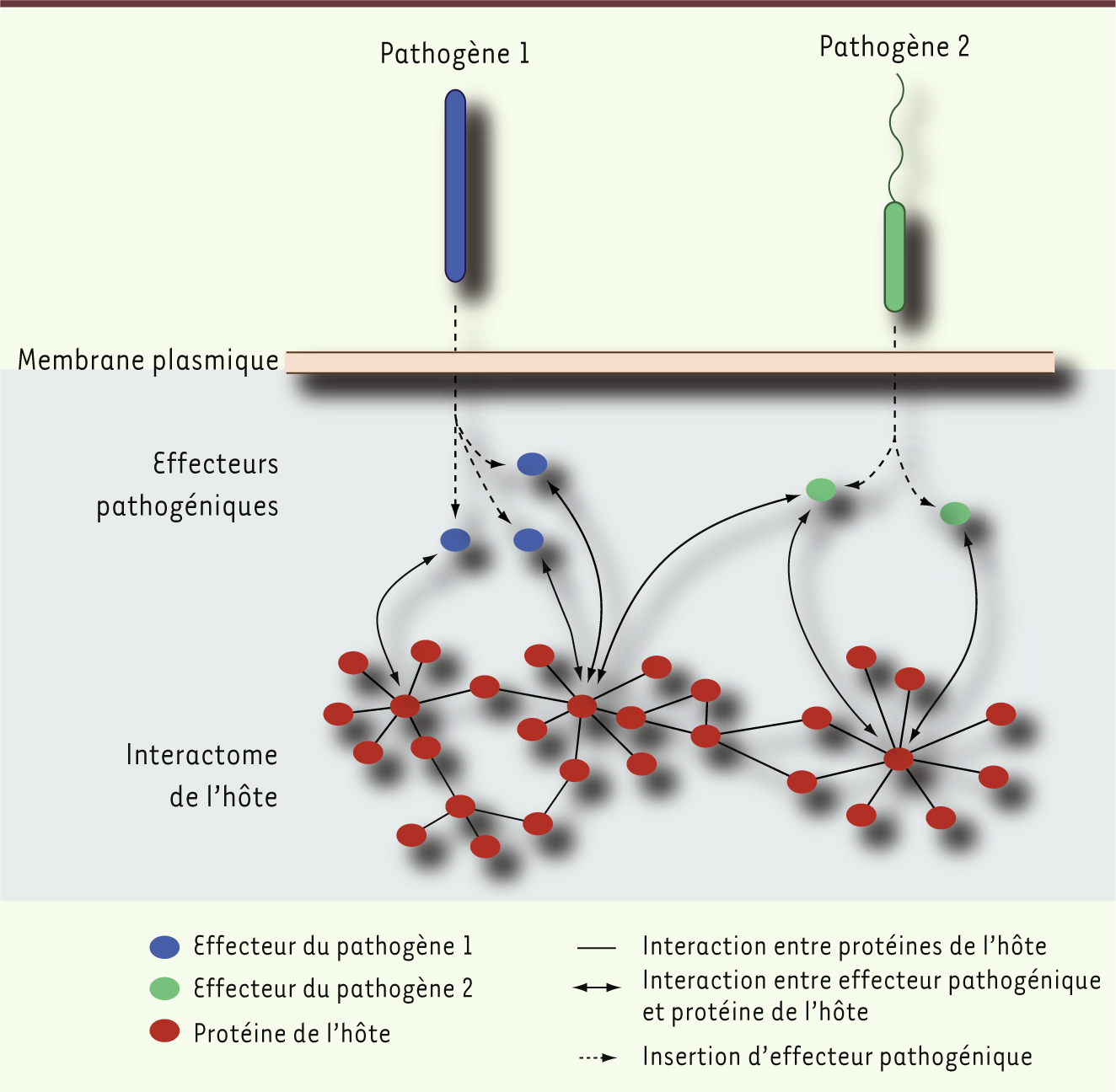
L’approche interactomique appliquée aux interactions entre plantes et phytopathogènes Nous avons donc construit deux cartes interactomiques pour l’Arabette des dames en utilisant la méthode du double hybride en levure. La première [3], établie en testant systématiquement plus de 35 millions de paires de protéines de la plante, a permis de détecter environ 6 200 interactions entre 2 700 protéines. Nous estimons que cette carte couvre 2 % de l’interactome complet de l’Arabette des dames. La seconde carte [4] est focalisée sur le système immunitaire et ses interactions avec les effecteurs de deux phytopathogènes : la bactérie Gram-negative Pseudomonas syringae (Psy) et l’oomycète Hyaloperonospora arabidopsidis (Hpa). Cette carte comporte 3 000 interactions entre 900 protéines, dont des effecteurs pathogéniques, des protéines préalablement connues du système immunitaire, ainsi que d’autres protéines de l’hôte que nous avons identifiées comme interagissant avec l’un ou l’autre de ces groupes de protéines (et qui représentent donc probablement de nouveaux acteurs de l’immunité) (Figure 1). L’analyse combinée de ces deux cartes nous a permis de mettre en évidence certains principes fondamentaux des relations hôte-pathogène chez l’Arabette des dames.
 | Figure 1.
Ciblage des hubs (nœuds) de l’interactome protéique de l’hôte lors d’une attaque de pathogènes (ici Psy et Hpa).
|
Attaques ciblées Si l’on adopte une métaphore militaire pour décrire les relations hôte pathogène, les effecteurs pathogéniques se livreraient à des attaques ciblées (Figure 1) contre les protéines clés de l’hôte, dans le but de prendre le contrôle de la cellule et d’affaiblir ses défenses. Même si les théories évolutives et les connaissances actuelles appuient ce modèle, il n’a pour l’instant pas été réellement démontré. Nos simulations prédisent que, si les effecteurs établissaient le même nombre de connexions mais avec des protéines de l’hôte choisies au hasard dans la première carte, ils interagiraient en moyenne avec 320 protéines de l’hôte, dont environ 1 % seraient communes à Hpa et Psy. En réalité, nos résultats expérimentaux montrent que les protéines effectrices ont ciblé de manière répétitive seulement 165 protéines de l’hôte, dont 10 % partagées par Hpa et Psy. Un tel degré de convergence de la part de deux pathogènes éloignés d’environ un milliard d’années d’évolution apporte un argument fort en faveur de l’hypothèse des attaques ciblées. Défenses gardées Le modèle zigzag repose sur une autre hypothèse, elle aussi aux consonances militaires, selon laquelle certains récepteurs intracellulaires sont capables de détecter le soi modifié et de déclencher une réponse immunitaire de forte amplitude, comme les gardes d’une citadelle [ 5]. Cette hypothèse s’oppose au modèle « gène pour gène », selon lequel la plante aurait développé des récepteurs intracellulaires pour chaque protéine effectrice pathogénique possible. Selon ce second modèle, les récepteurs intracellulaires devraient interagir directement avec les protéines effectrices, alors que selon l’hypothèse des défenses gardées, ces interactions seraient indirectes. Les interactions entre protéines effectrices et récepteurs intracellulaires que nous avons expérimentalement détectées se sont avérées majoritairement indirectes, donc en accord avec l’hypothèse des défenses gardées. |
Immunité et science des réseaux Indépendamment de ces mécanismes physiologiques complexes, la science des réseaux propose une élégante prédiction. Dans les réseaux biologiques, un petit nombre de composants, surnommés hubs (nœuds), établissent de nombreuses connexions tandis que la plupart des autres composants en établissent peu. En conséquence, la structure de ces réseaux est robuste et résiste aux défaillances aléatoires de ses composants, mais elle est en revanche très sensible aux attaques dirigées contre les hubs [6]. La science des réseaux et la mécanistique moléculaire se rejoignent donc dans la question fascinante des interactions hôte-pathogène, en prédisant que les pathogènes pourraient maximiser leur virulence en ciblant les hubs (Figure 1). Nos expériences de cartographie interactomique confirment que les effecteurs de pathogènes interagissent préférentiellement avec des protéines de l’hôte qui sont des hubs. Nous avons également testé expérimentalement la réponse immunitaire de plantes Arabette des dames mutées pour 16 hubs qui interagissent avec les effecteurs Hpa et Psy. Neuf de ces mutants sont significativement plus sensibles à l’infection que la plante sauvage, et sept sont plus résistants. Sept mutants choisis au hasard ont également été testés, et aucun n’a présenté de phénotype immunitaire. Nos travaux démontrent que les effecteurs de deux pathogènes, séparés par un milliard d’années d’évolution, ciblent un nombre restreint de protéines très connectées au sein de l’interactome. Il pourrait s’agir d’une stratégie de virulence du pathogène ciblant des protéines clés de l’hôte, ou à l’inverse, d’une stratégie immunitaire de l’hôte qui utiliserait un nombre limité de protéines pour se défendre contre une source variée de pathogènes. D’autres études ont montré que les protéines de pathogènes viraux et bactériens interagissent aussi préférentiellement avec les hubs du réseau interactome humain [7–10]. La question de leur convergence demeure cependant inexplorée. Nos investigations sur l’Arabette des dames pourraient mettre à jour de nouveaux mécanismes de pathologies infectieuses dans le domaine végétal, avec des retombées évidentes en recherche agronomique, mais également en recherche médicale. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Les auteurs remercient les docteurs Thierry Savin, Christelle Anaclet et Nicolas Thierry-Mieg pour leur aide à la rédaction de cette Nouvelle.
|
1. Nishimura MT, Dangl JL, Arabidopsis and the plant immune system . Plant J. 2010; ; 61 : :1053.–1066. 2. Vidal M, Cusick ME, Barabasi AL. Interactome networks and human disease . Cell. 2011; ; 144 : :986.–998. 3. Arabidopsis Interactome Mapping Consortium . Evidence for network evolution in an Arabidopsis interactome map . Science. 2011; ; 333 : :601.–607. 4. Mukhtar MS, Carvunis AR, Dreze M, et al. Independently evolved virulence effectors converge onto hubs in a plant immune system network . Science. 2011; ; 333 : :596.–601. 5. Dangl JL, Jones JD. Plant pathogens and integrated defence responses to infection . Nature. 2001; ; 411: :826.–833. 6. Albert R, Jeong H, Barabasi AL. Error and attack tolerance of complex networks . Nature. 2000; ; 406 : :378.–382. 7. Calderwood MA, Venkatesan K, Xing L, et al. Epstein-Barr virus and virus human protein interaction maps . Proc Natl Acad Sci USA. 2007; ; 104 : :7606.–7611. 8. de Chassey B, Navratil V, Tafforeau L, et al. Hepatitis C virus infection protein network . Mol Syst Biol. 2008; ; 4 : :230.. 9. Dyer MD, Neff C, Dufford M, et al. The human-bacterial pathogen protein interaction networks of Bacillus anthracis, Francisella tularensis, and Yersinia pestis . PLoS One. 2010; ; 5 : :e12089.. 10. Navratil V, de Chassey B, Combe CR, Lotteau V. When the human viral infectome and diseasome networks collide: towards a systems biology platform for the aetiology of human diseases . BMC Syst Biol. 2011; ; 5 : :13.. |