| |
| Med Sci (Paris). 2012 March; 28(3): 245–247. Published online 2012 April 6. doi: 10.1051/medsci/2012283006.Le Yin et le Yang de la sénescence Est-il possible de vieillir sans développer de cancer ? Matthieu Lacroix,1 Laetitia K. Linares,1 and Laurent Le Cam1* 1Institut de recherche en cancérologie de Montpellier, Inserm U896, centre de lutte contre le cancer Paul Lamarque Val d’Aurelle, Montpellier, 34298, France MeSH keywords: Vieillissement, physiologie, Animaux, Apoptose, génétique, Vieillissement de la cellule, Division cellulaire, Transformation cellulaire néoplasique, Cytokines, Susceptibilité à une maladie, Gènes suppresseurs de tumeur, Gènes p16, Humains, Souris, Modèles biologiques, Tumeurs, physiopathologie, prévention et contrôle, Oncogènes, Tacrolimus, analogues et dérivés , usage thérapeutique, Protéine p14(ARF) suppresseur de tumeur |
La sénescence, encore appelée vieillissement cellulaire, se caractérise par un arrêt irréversible de la prolifération cellulaire associé à certains changements morphologiques, métaboliques et sécrétoires (→) [11, 12]. Découvert par Leonard Hayflick dans les années 1960 comme une réponse antiproliférative de la cellule originellement associée au raccourcissement télomérique, il est maintenant établi que ce processus de sénescence peut intervenir dans d’autres conditions de stress : stress génotoxiques, métaboliques, ou oncogéniques. (→) Voir l’article de J.M. Brondello et al., page 288 de ce numéro Si la sénescence fut longtemps considérée comme un artéfact de culture cellulaire in vitro, plusieurs études indépendantes ont permis de démontrer son existence in vivo. Les travaux récents des laboratoires de J.M. Van Deursen [1] et de L. Zender [2] confirment, via des arguments génétiques importants, le rôle in vivo de la sénescence au cours du vieillissement et dans certaines réponses antitumorales. |
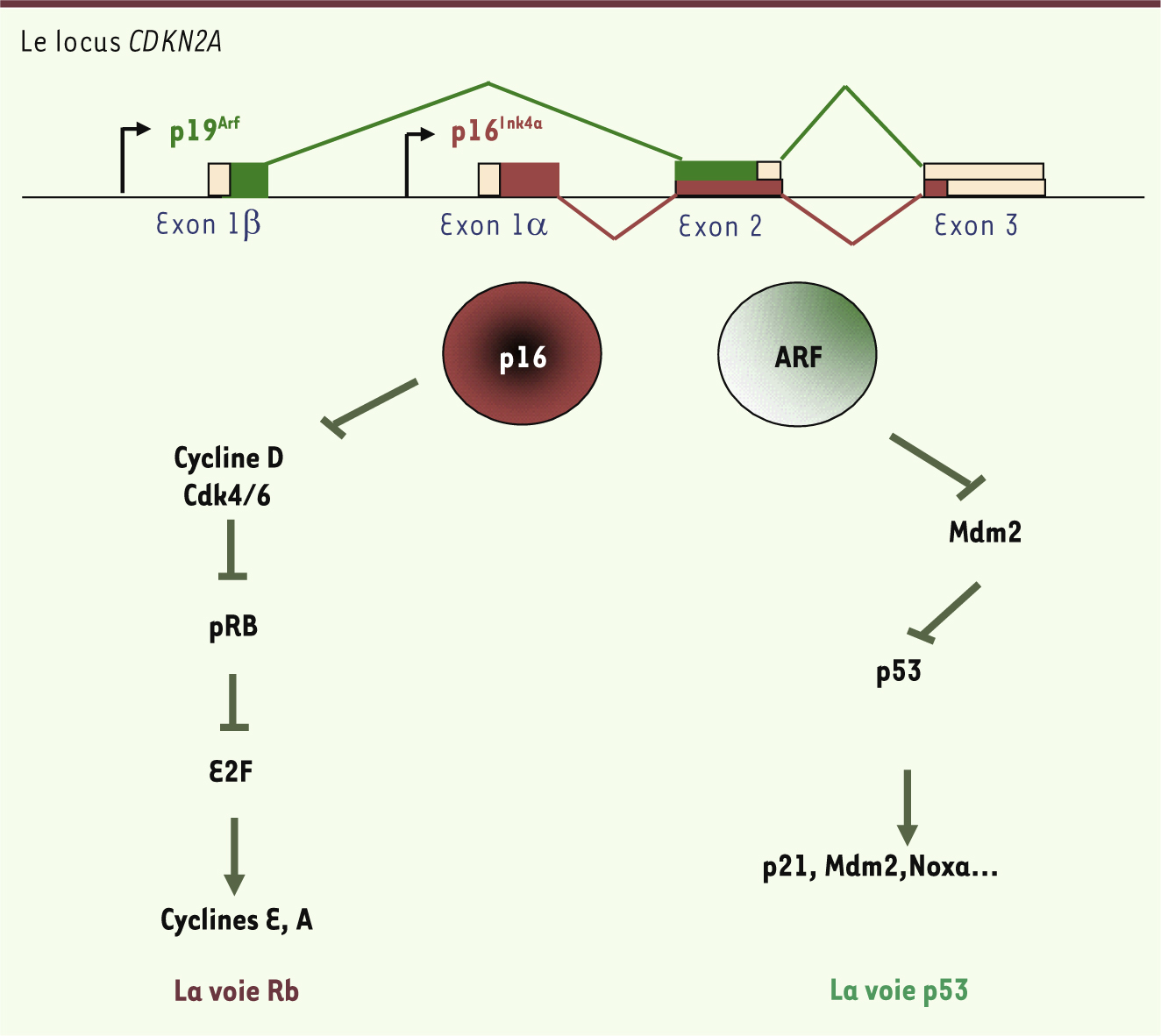
Les cellules sénescentes exprimant p16 participent au vieillissement de l’organisme Un modèle d’élimination sélective des cellules sénescentes Le premier modèle murin génétiquement modifié décrit dans ces études repose sur une approche de type « gène suicide » dont l’expression est restreinte aux cellules sénescentes. Dans ce modèle expérimental, la mort cellulaire intervient spécifiquement dans les cellules sénescentes. Elle est déclenchée par l’administration in vivo d’une drogue, le AP20187, qui active une protéine de fusion constituée par une forme activée de la caspase 8 fusionnée à un fragment de la protéine liant la FK506 (FK506BP). L’expression de cette protéine est placée sous le contrôle d’une partie du promoteur du gène codant pour la protéine p16 Ink4a, un marqueur de la sénescence (Figure 1) [ 1]. Grâce à l’utilisation de deux promoteurs spécifiques et deux phases de lecture distinctes, le locus CDKN2A code pour 2 protéines à activité suppresseur de tumeur : les protéines p16 Ink4a et ARF ( alternative reading frame, p14 Arf chez l’homme ou p19 Arf chez la souris). Ce locus constitue un point de convergence de nombreux signaux de stress conduisant in fine à la modulation des voies impliquant les suppresseurs de tumeur Rb et p53 [ 3]. Ces derniers sont des régulateurs clé de la sénescence, et les voies qu’ils empruntent représentent l’archétype des voies des suppresseurs de tumeurs. De fait, ces voies de signalisation sont inactivées, à un niveau ou à un autre, dans pratiquement toutes les tumeurs.
 | Figure 1.
Représentation schématique du locus CDKN2A. En utilisant deux promoteurs différents et deux phases de lecture ouvertes distinctes, le locus CDKN2A (encore appelé Ink4a/Arf) code pour 2 protéines sans homologie de séquence : p16Ink4a et ARF (alternative reading frame). p16Ink4a est un inhibiteur de certains complexes à activité kinase dépendante des cyclines (cycline-cdk) qui jouent un rôle important dans la progression du cycle cellulaire en amont du suppresseur de tumeur pRb. ARF (p14Arf chez l’homme ou p19Arf chez la souris) est un inhibiteur de Mdm2 (mouse double minute), une protéine à activité ubiquitine E3 ligase impliquée dans la dégradation du suppresseur de tumeur p53. Les voies de signalisation impliquant p16Ink4a et ARF jouent un rôle important au cours de la sénescence et du développement tumoral. |
Cette stratégie originale a permis à Baker et al. [1] de montrer que la destruction des cellules sénescentes exprimant p16Ink4a (et donc le gène suicide) améliorait significativement certains symptômes associés à un vieillissement prématuré dans un modèle murin progéroïde basé sur l’expression d’un allèle hypomorphe de la kinase BubR1 (BubR1Hyp/Hyp) [4]. Ces travaux font écho à de précédentes études démontrant une expression accrue de p16Ink4a et de p19Arf dans différents tissus de ce même modèle murin. L’inactivation génétique de p16Ink4a, alors que l’expression de p19Arf reste intacte, améliore certains des symptômes de vieillissement prématuré dans ce modèle [5]. Cette « cure de jouvence » tissulaire corrèle avec une diminution de l’expression de plusieurs cytokines et chimiokines sécrétées par les cellules sénescentes, dont l’expression inopinée est à l’origine d’une réponse inflammatoire. Cette capacité sécrétrice des cellules sénescentes pourrait avoir des effets délétères en conduisant d’autres cellules, localement ou à plus grande distance, à entrer en sénescence, amplifiant ainsi les défauts tissulaires qui participent au vieillissement [6–8]. Quelles leçons tirer de ces expériences ? Les travaux de cette équipe constituent une des premières preuves génétiques que les cellules sénescentes exprimant p16 Ink4a participent au vieillissement in vivo, et ils ouvrent des perspectives thérapeutiques intéressantes. Cependant, ces études suggèrent également que de telles stratégies ne pourront vraisemblablement pas être mises en œuvre au-delà d’un certain âge, l’installation des phénotypes associés au vieillissement devenant irréversible. De plus, ce modèle expérimental montre aussi que tous les tissus ne vieillissent pas via les mêmes mécanismes moléculaires. C’est le cas notamment de certaines arythmies cardiaques ou de l’épaississement des parois vasculaires observés dans ce modèle expérimental et qui ne sont pas améliorés par l’élimination des cellules exprimant p16 Ink4a. Ainsi, il n’existe vraisemblablement pas un seul mécanisme de vieillissement universel et il semble même que selon les organes, certains des acteurs clés de la sénescence pourraient avoir des effets paradoxaux sur le vieillissement [ 9, 10]. Ces résultats nous amènent également à nous interroger sur certains des mécanismes impliqués dans le vieillissement. En effet, selon un modèle assez couramment admis, le vieillissement impliquerait, du moins en partie, un dysfonctionnement du compartiment des cellules souches adultes, dont l’altération fonctionnelle participerait aux défauts de renouvellement ou de réparation tissulaires associés au vieillissement (→) [12]. Le modèle génétique utilisé par l’équipe de J.M. Van Deursen, basé sur une approche de « gène suicide » remet en question cette hypothèse, au moins en partie. En effet, si la sénescence des cellules souches était un élément déclencheur et majeur du processus de vieillissement, la destruction des cellules souches exprimant p16Ink4a via l’activation du gène suicide dans ce modèle murin devrait conduire, au même titre que leur dysfonctionnement, à des défauts tissulaires semblables à ceux qui interviennent au cours du vieillissement. Cette simple déduction repose la question des mécanismes cellulaires et moléculaires conduisant in fine à l’altération de la fonctionnalité des cellules souches ou de certains progéniteurs immatures au cours du vieillissement, et suggère que ces défauts interviennent tardivement mais ne constituent vraisemblablement pas l’évènement initial du vieillissement. (→) Voir l’article de S. Galas et al., page 297 de ce numéro |
La sénescence constitue une barrière antitumorale efficace Ces travaux prometteurs ouvrent la voie au développement de nouvelles stratégies antivieillissement. Cependant, les études récentes de l’équipe de L. Zender laissent présager que si l’objectif de telles stratégies était de moduler les capacités sécrétrices des cellules sénescentes, il ne faudrait pas qu’elles perturbent la réponse immunitaire dirigée contre ces cellules sénescentes, ce qui risquerait d’accroître la survenue de certaines tumeurs [2]. En effet, plusieurs modèles génétiques murins renforcent maintenant l’idée que la sénescence, en particulier la sénescence induite par les oncogènes (oncogene-induced senescence ou OIS), est un mécanisme qui bloque la prolifération anarchique des cellules dont certaines voies oncogéniques sont activées de façon incontrôlée. Les phénotypes sécrétoires de ces cellules sénescentes constituent une arme à double tranchant : certaines des cytokines et chimiokines sécrétées participent à l’établissement et au maintien de la sénescence, alors que d’autres induisent une réponse inflammatoire qui permet d’éliminer de l’organisme ces cellules prénéoplasiques. Ce mécanisme de surveillance antitumoral fait appel, au moins dans le cas des hépatocytes activés par l’oncogène Ras - modèle utilisé par l’auteur - aux lymphocytes T CD4 Th1 et aux monocytes. L’ablation de cette réponse immune permet aux hépatocytes sénescents d’échapper à cette surveillance antitumorale, conduisant in fine au développement d’hépatocarcinomes cellulaires (HCC). Il semble que ce mécanisme soit conservé chez l’homme puisque chez les patients immunodéprimés par un traitement immunosuppresseur après une greffe d’organes ou parce qu’ils sont infectés par le VIH, le nombre d’hépatocytes sénescents est augmenté et la prévalence d’HCC en réponse à une infection par le virus de l’hépatite C est plus élevée [2].
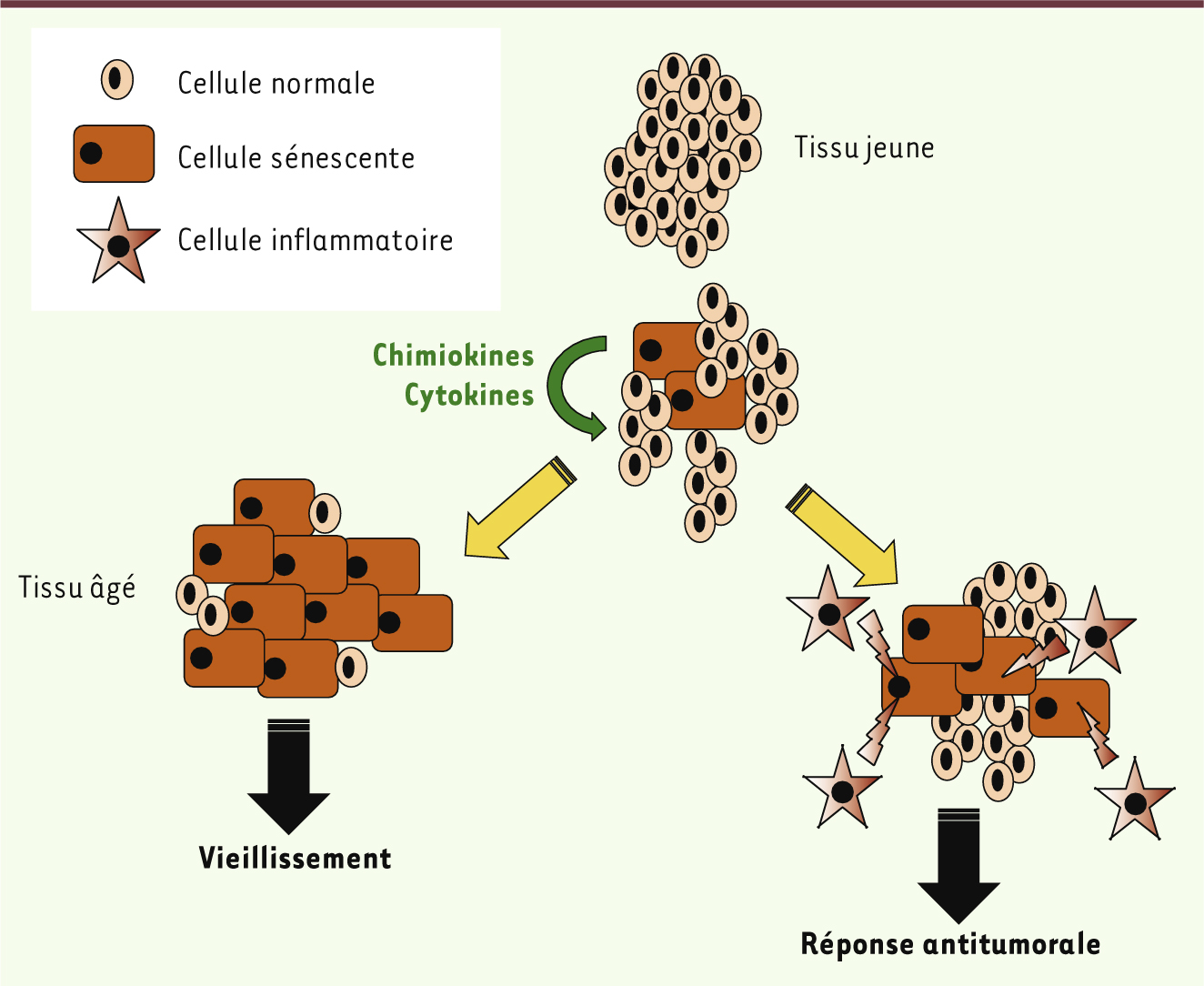
 | Figure 2.
Rôles paradoxaux du phénotype sécrétoire des cellules sénescentes. Les cellules sénescentes sécrètent des cytokines et chimiokines pouvant influencer le vieillissement et la surveillance immune antitumorale. Certaines de ces molécules sécrétées par les cellules sénescentes (par exemple les IGFBP (insulin-like growth factor binding protein) ou l’interleukine [IL]-6) interviennent directement dans la sénescence des cellules environnantes, amorçant une boucle vicieuse participant au dysfonctionnement et au vieillissement tissulaires. À l’inverse, les cytokines (notamment celles de la famille de l’interféron ou de l’IL-1) sécrétées par les cellules sénescentes sont à l’origine d’une réponse inflammatoire et immune permettant l’élimination des cellules sénescentes. L’échappement à ce mécanisme de surveillance antitumoral permettrait le passage vers des stades de transformation plus avancés. |
|
L’ensemble de ces résultats expérimentaux révèle l’intérêt potentiel de stratégies visant à éliminer les cellules sénescentes pour ralentir le vieillissement, mais souligne la nécessité de mieux comprendre les mécanismes moléculaires mis en œuvre pour s’affranchir d’effets néfastes en termes de développement tumoral. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Baker DJ, Wijshake T, Tchkonia T, et al. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders . Nature. 2011; ; 479 : :232.–236. 2. Kang TW, Yevsa T, Woller N, et al. Senescence surveillance of pre-malignant hepatocytes limits liver cancer development . Nature. 2011; ; 479 : :547.–551. 3. Lanigan F, Geraghty JG, Bracken AP. Transcriptional regulation of cellular senescence . Oncogene. 2011; ; 30 : :2901.–2911. 4. Baker DJ, Jeganathan KB, Cameron JD, et al. BuRb1 insufficiency causes early onset of aging-associated phenotypes and infertility in mice . Nat Genet. 2004; ; 36 : :744.–749. 5. Baker DJ, Perez-Terzic C, Jin F, et al. Opposing roles for p16Ink4a and p19Arf in senescence and ageing caused by BubR1 insufficiency . Nat Cell Biol. 2008; ; 10 : :825.–836. 6. Wajapeyee N, Serra RW, Zhu X, et al. Role for IGFBP7 in senescence induction by BRAF . Cell. 2010; ; 141 : :746.–747. 7. Kuilman T, Michaloglou C, Vredeveld LC, et al. Oncogene-induced senescence relayed by an interleukin-dependent inflammatory network . Cell. 2008; ; 133 : :1019.–1031. 8. Rodier F, Coppé JP, Patil CK, et al. Persistent DNA damage signalling triggers senescence-associated inflammatory cytokine secretion . Nat Cell Biol. 2009; ; 11 : :973.–979. 9. Baker DJ, Perez-Terzic C, Jin F, et al. Opposing roles for p16Ink4a and p19Arf in senescence and ageing caused by BubR1 insufficiency . Nat Cell Biol. 2008; ; 10 : :825.–836. 10. Matheu A, Maraver A, Klatt P, et al. Delayed ageing through damage protection by the Arf/p53 pathway . Nature. 2007; ; 448 : :375.–379. 11. Brondello JM, Prieur A, Philippot D, et al. La sénescence cellulaire : un nouveau mythe de Janus ? Med Sci (Paris). 2012; ; 28 : :288.–296. 12. Galas S, Château MT., Pomiès P, et al. Nouvelles pistes ouvertes par les modèles animaux dédiés à l’étude du vieillissement . Med Sci (Paris). 2012; ; 28 : :297.–304. |