| |
| Med Sci (Paris). 2012 March; 28(3): 255–258. Published online 2012 April 6. doi: 10.1051/medsci/2012283009.Le récepteur d’aryl d’hydrocarbone, lien moléculaire entre alimentation et immunité Cédric Vonarbourg* Institut für Medizinische Mikrobiologie und Hygiene, Uniklinik Freiburg, Hermann-Herder-Strasse 11, D-79102Freiburg, Allemagne MeSH keywords: Animaux, Facteurs de transcription à motif basique hélice-boucle-hélice, physiologie, Régime alimentaire, Aliments, Régulation de l'expression des gènes, Produits dangereux, pharmacocinétique, Homéostasie, Humains, Immunité, Intestins, immunologie, microbiologie, Cellules tueuses naturelles, Tissu lymphoïde, Souris, Souris knockout, Modèles biologiques, Modèles immunologiques, Membre-3 du groupe F de la sous-famille-1 de récepteurs nucléaires, Récepteurs à hydrocarbure aromatique, Autotolérance, Xénobiotique |
Depuis quelques années, la recherche sur le système immunitaire des muqueuses intestinales connaît un vif regain d’intérêt. Longtemps, les immunologistes ont cherché à résoudre le mécanisme de la reconnaissance par le système immunitaire du « soi », par définition inoffensif, et du « non-soi », pathogène. Depuis peu, ils s’attachent à comprendre comment cette reconnaissance est contrôlée dans l’intestin. Chaque jour en effet, les cellules immunitaires intestinales entrent en contact avec, et reconnaissent, une myriade de molécules issues de l’alimentation et de la flore microbienne, sans qu’aucune inflammation ne soit détectée. Ceci implique la coévolution, au cours des millénaires, de la flore bactérienne indigène et des cellules de l’hôte, en particulier des cellules immunitaires, vers un mutualisme commun au sein de l’intestin. Ce processus est d’autant plus important que tout déséquilibre dans ce mutualisme est associé à la survenue d’infections, de maladies chroniques inflammatoires et de cancers [1]. |
Immunité intestinale : le rôle des cellules inductrices de tissus lymphoïdes et des cellules NKR +RORγt +Le système immunitaire intestinal est constitué de cellules immunitaires dont une partie est regroupée dans des tissus lymphoïdes et l’autre dispersée dans l’intestin lui-même (Figure 1).
 | Figure 1.
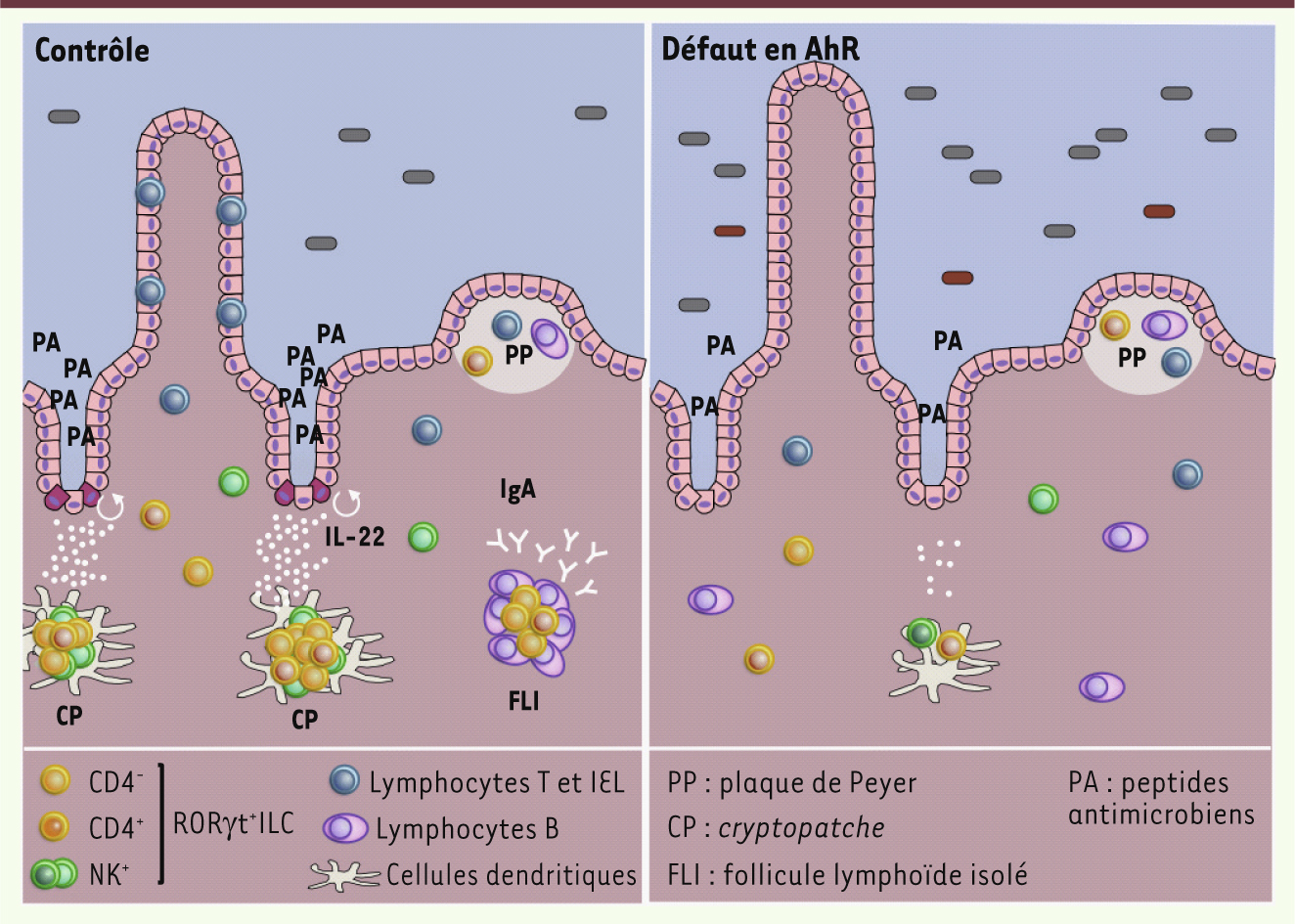
L’absence de AhR induit un changement profond de l’homéostasie intestinale. Dans l’intestin, les lymphocytes intraépithéliaux (IEL) ainsi que les RORγt+ILC jouent un rôle primordial dans le maintien de l’homéostasie. Lorsque le facteur de transcription AhR est génétiquement invalidé, le nombre de RORγt+ILC et IEL chute entraînant l’absence de formation de tissus lymphoïdes tels que les cryptopatches (CP) et les follicules lymphoïdes isolés (FLI). L’IL-22 est une cytokine secrétée par les cellules RORγt+ILC et IEL. Cette cytokine est importante pour la modulation des réponses des tissus à l’état stationnaire ou lors d’épisodes inflammatoires. Dans les tissus intestinaux, l’IL-22 induit dans les cellules cibles la sécrétion de peptides antimicrobiens (PA) et de protéines impliquées dans la formation de mucus. Elle protège également ces cellules contre l’apoptose et stimule leur prolifération protégeant ainsi les tissus. Lors d’un défaut en AhR, le microbiome serait également modifié, avec une augmentation de la population bactérienne et une sensibilité accrue aux infections pathogènes. |
Les ganglions lymphatiques mésentériques - qui drainent l’intestin - et les plaques de Peyer sont des tissus lymphoïdes dont la spécification intervient durant l’embryogenèse. Leur formation est induite par les cellules inductrices de tissus lymphoïdes ou LTi (lymphoid tissue inducer cells) (Figures 1 et 2). Ces cellules ne possèdent aucun des marqueurs cellulaires habituellement associés à une lignée cellulaire donnée (par exemple, lymphocytes T ou B, cellules myéloïdes), mais elles expriment le facteur de transcription RORγt [2]. Après la naissance, les LTi se regroupent dans la lamina propria en follicules appelés cryptopatches (CP) puis avec le temps, évoluent en follicules lymphoïdes isolés (FLI) dans lesquels des lymphocytes B sont recrutés, conséquence de la colonisation de l’intestin par la flore bactérienne (Figures 1 et 2) [2]. Nous avons montré récemment que ces cellules peuvent également se différencier en cellules NKR+RORγt+ en exprimant des récepteurs normalement associés aux cellules natural killer (NK) [3]. Les cellules LTi et NKR+RORγt+ sont regroupées sous le terme de cellules lymphoïdes innées exprimant RORγt (RORγt+ILC : RORγt-expressing innate lymphoid cells) (Figure 1). Une des fonctions clés des RORγt+ILC tient à leur capacité de sécréter de l’interleukine-22 (IL-22) qui est un régulateur majeur de l’homéostasie intestinale et protège contre les infections intestinales [4]. L’IL-22 induit dans les cellules épithéliales la production de peptides antimicrobiens et l’expression de molécules impliquées dans la réparation des tissus (Figure 1). En particulier, les RORγt+ILC ont démontré leur importance dans la résistance à l’infection par la bactérie Citrobacter rodentium, qui est un modèle murin des infections à Escherichia coli survenant chez l’homme. L’IL-22 est également impliquée dans la protection contre plusieurs formes de colites [4]. Au sein de l’épithélium intestinal, plusieurs types de lymphocytes ont été décrits, majoritairement des lymphocytes T, de TCR γδ ; ces lymphocytes intraépithéliaux (IEL) jouent un rôle important dans la protection de l’épithélium contre les pathogènes et la maintenance des cellules épithéliales. |
AhR et modulation du système immunitaire intestinal Le récepteur d’aryl d’hydrocarbone (AhR : aryl hydrocarbon receptor) est un facteur de transcription hautement conservé. Au contraire de son rôle dans la réponse aux toxines environnementales, largement décrit, son rôle sur le système immunitaire des muqueuses n’est pas clairement défini. AhR est exprimé dans de nombreux tissus. Toutefois, son niveau d’expression est relativement bas dans la majorité des lymphocytes, et seuls les lymphocytes T Th17 pro-inflammatoires ont été décrits comme exprimant des taux élevés de AhR, ce qui favorise leur différenciation et la sécrétion d’IL-22 [5, 6]. Depuis quelques années, notre laboratoire s’attache à caractériser les cellules RORγt+ILC intestinales. Nous avons remarqué qu’elles expriment également un niveau élevé de AhR. Afin d’en comprendre l’importance, nous avons analysé des souris génétiquement invalidées pour le gène AhR. Chez ces souris, le nombre de RORγt+ILC est nettement réduit et il n’y a pas de formation de cryptopatches ni de follicules lymphoïdes isolés [7]. La déplétion spécifique de AhR dans les cellules exprimant RORγt nous a permis de montrer que ce facteur avait un effet intrinsèque sur la prolifération post-natale des cellules RORγt+ILC, mais n’influençait pas leur développement [7]. En parallèle de nos travaux, une équipe anglaise s’est aussi intéressée au rôle de AhR dans les IEL. Le nombre d’IEL est drastiquement diminué dans les souris déficientes pour AhR [8], et, comme nous l’avons décrit pour les cellules RORγt+ILC, AhR agit sur les IEL bien qu’il n’ait aucun rôle dans leur développement. Dans ces deux études, AhR semble donc contrôler la survie des RORγt+ILC et des IEL [7, 8]. L’analyse des altérations associées à l’absence de AhR a révélé que les RORγt+ILC, comme les lymphocytes Th17 et les T γδ, ne peuvent plus produire d’IL-22 en quantité normale [6–8]. Il en résulte une baisse de la production de peptides antimicrobiens par l’épithélium intestinal et, en conséquence, une augmentation de la quantité de bactéries dans l’intestin grêle (en particulier des bactéries du genre des bacteroïdes) (Figure 1) [8], ainsi qu’une sensibilité accrue à l’infection par C. rodentium et au développement d’une colite induite par l’administration dans l’eau de boisson de sel de dextran sodium sulfate (DSS) (un modèle murin de colite) [7, 8]. |
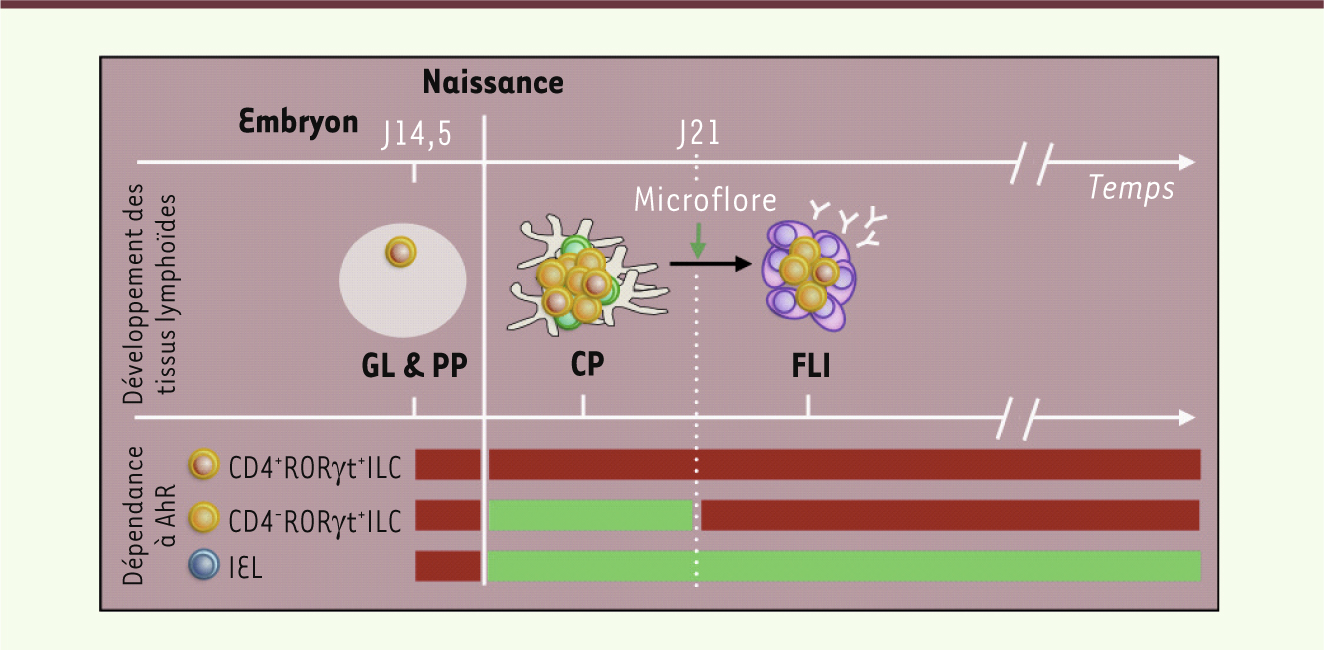
Reconnaissance de composants alimentaires par AhR Compte tenu de l’importance de AhR pour la survie des RORγt+ILC, il était important de comprendre de quelle manière AhR était régulé et en quoi ce facteur de transcription pouvait intervenir dans la survie de ces cellules. Les molécules agonistes de AhR appartiennent à une famille diversifiée de ligands qui inclut des toxines environnementales telles que la dioxine, mais aussi des molécules endogènes et alimentaires (par exemple, les flavonoïdes, les glucosinolates). Dans un environnement stérile, les souris sans flore bactérienne présentent un nombre normal de cryptopatches, arguant contre le rôle des agonistes de AhR d’origine bactérienne dans cette formation. En revanche, la nourriture des souris est une source d’agonistes : composée essentiellement de graines, elle contient des concentrations élevées de molécules phytochimiques telles que les polyphénols et les glucosinolates contenus également dans les légumes de la famille des Brassicacées (par exemple, le brocoli, les choux de Bruxelles) [7]. Or, nous avons observé que lorsque des souris sont soumises à un régime pauvre en molécules phytochimiques dès leur naissance, leur phénotype est le même que celui des souris ayant un défaut de AhR. La formation des follicules lymphoïdes y est retardée par un faible nombre de cellules RORγt+ILC. Ce régime n’a toutefois aucun effet sur les follicules lymphoïdes si ils sont déjà formés. En effet, le rôle de AhR sur les RORγt+ILC ne semble s’exercer que dans une fenêtre temporelle restreinte, allant de la naissance jusqu’à la colonisation de l’intestin par les bactéries (deux à trois semaines après la naissance), au moment où le régime alimentaire est déterminant car il n’y a pas encore d’apport d’agonistes d’origine bactérienne. Par la suite, ces agonistes d’origine bactérienne compensent certainement le manque d’agonistes de AhR d’origine alimentaire (Figure 2). De fait, lorsque le régime est supplémenté avec un agoniste de AhR avant la colonisation bactérienne, le nombre de RORγt+ILC et la formation des follicules intestinaux sont restaurés [7].
 | Figure 2.
Dépendance des LTi et IEL aux agonistes de AhR au cours du temps. Au cours de l’embryogenèse, les cellules inductrices de tissus lymphoïdes (LTi) induisent le développement des ganglions lymphatiques (GL) et des plaques de Peyer (PP). Cette étape est indépendante de la fonction du facteur de transcription AhR (rouge). Après la naissance, les LTi interviennent dans le développement des follicules lymphoïdes intestinaux (FLI). C’est au cours de cette période, avant que l’intestin ne soit colonisé par la microflore bactérienne, que les agonistes de AhR ont un rôle majeur sur la survie et la prolifération des LTi, et par conséquent sur la formation normale des follicules lymphoïdes intestinaux. De manière intéressante, les IEL semblent être sensibles à la présence des agonistes à AhR sur la durée, indépendamment de la présence de la flore microbienne (vert). |
Les gènes cibles de AhR ne sont pas complètement connus. Cependant, nous avons montré que Kit - le récepteur du SCF (stem cell factor) - qui est exprimé sur les RORγt+ ILC, est une cible directe de AhR et est probablement impliqué dans le maintien du réservoir de cellules RORγt+ILC. En effet, la voie de signalisation Kit intervient dans la prolifération et la croissance cellulaires [7]. Toutefois, le (ou les) gène(s) régulé(s) par AhR et impliqué(s) dans la survie des lymphocytes intraépithéliaux reste à définir. Récemment un nouvel article a confirmé nos résultats sur le rôle de AhR dans les RORγt+ILC [9]. L’étude porte en particulier sur les cellules NKR+RORγt+, dont le nombre est très réduit chez les souris déficientes pour AhR. Cependant, contre toute attente, aucun lien n’a été identifié dans cette étude entre le récepteur AhR dans ces cellules et des composants alimentaires [9]. Nous proposons deux explications à ce résultat : premièrement, la nourriture utilisée dans cette étude comporte de l’huile de soja, qui contient des agonistes de l’AhR. Deuxièmement, le régime utilisé dans cette étude l’a été chez des souris d’âge adulte. Or, si les follicules lymphoïdes sont formés, un régime pauvre en agonistes de AhR n’a aucune conséquence. |
Régulation de l’immunité intestinale par la composante alimentaire Pour la première fois, notre travail et celui d’une autre équipe mettent en lumière l’importance de l’alimentation pour le développement de tissus lymphoïdes intestinaux et le maintien de l’homéostasie intestinale [7, 8]. Notre étude montre que les produits d’hydrolyse des glucosinolates conduisent à l’expansion postnatale des cellules RORγt+ILC, requises pour la formation des follicules lymphoïdes intestinaux et acteurs importants de l’homéostasie intestinale. Fait intéressant, les glucosinolates joueraient aussi un rôle important dans l’immunité des plantes, suggérant une fonction évolutive conservée dans les voies de défense immunitaire [7], comme le suggèrent Anne-Ruxandra Carvunis et Matija Dreze dans ce numéro (→) [11]. Ainsi, les cellules RORγt+ILC et IEL jouent un rôle majeur et complémentaire dans l’homéostasie intestinale et chacune de ces populations est capable de répondre à la présence d’agonistes de AhR dans l’alimentation. Il reste cependant plusieurs questions en suspens.
-
La plupart des résultats obtenus l’ont été chez les souris déficientes pour AhR, dans lesquelles les fonctions des RORγt+ILC et IEL sont toutes les deux absentes. Il faudra donc déterminer la part relative de ces populations dans l’homéostasie intestinale. Les expériences de déplétion spécifique de AhR dans les cellules exprimant RORγt ou RAG1 (recombination activating gene) ciblent malheureusement à la fois les lymphocytes T et les RORγt+ILC [7, 10]. Dans le modèle d’infection par C. rodentium, nous avons toutefois pu directement montrer le rôle essentiel de AhR des RORγt+ILC car l’immunité induite contre cette infection ne fait intervenir les lymphocytes T qu’après plusieurs semaines d’infection [7].
-
Les gènes régulés par AhR pourraient également être différents suivant la population cellulaire étudiée.
-
De manière intéressante, les régimes pauvres en agonistes de AhR agissent différemment sur les RORγt+ILC et les IEL [7, 8]. La provenance, et donc la nature, des aliments donnés aux souris pourraient expliquer ces différences.
-
La recherche d’autres agonistes dans l’alimentation est également importante. Leur nature modifie-t-elle l’activité de AhR? Les gènes transcrits sont-ils alors différemment régulés ? Le futur des traitements des maladies inflammatoires intestinales se dessinera certainement en fonction de notre meilleure connaissance des agonistes de AhR et de notre compréhension de leur fonction sur l’immunité intestinale.
|
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Saleh M, Trinchieri G. Innate immune mechanisms of colitis and colitis-associated colorectal cancer . Nat Rev Immunol. 2011; ; 11 : :9.–20. 2. Mortha A, Diefenbach A. Natural killer cell receptor-expressing innate lymphocytes: more than just NK cells . Cell Mol Life Sci. 2011; ; 68 : :3541.–3555. 3. Vonarbourg C, Mortha A, Bui VL, et al. Regulated expression of nuclear receptor rorgammat confers distinct functional fates to NK cell receptor-expressing rorgammat+ innate lymphocytes . Immunity. 2010; ; 33 : :736.–751. 4. Sonnenberg GF, Fouser LA, Artis D. Border patrol: regulation of immunity, inflammation and tissue homeostasis at barrier surfaces by IL-22 . Nat Immunol. 2011; ; 12 : :383.–390. 5. Martin B, Hirota K, Cua DJ, et al. Interleukin-17-producing gammadelta T cells selectively expand in response to pathogen products and environmental signals . Immunity. 2009; ; 31 : :321.–330. 6. Veldhoen M, Hirota K, Westendorf AM, et al. The aryl hydrocarbon receptor links TH17-cell-mediated autoimmunity to environmental toxins . Nature. 2008; ; 453 : :106.–109. 7. Kiss EA, Vonarbourg C, Kopfmann S, et al. Natural aryl hydrocarbon receptor ligands control organogenesis of intestinal lymphoid follicles . Science. 2011; ; 334 : :1561.–1565. 8. Li Y, Innocentin S, Withers DR, et al. Exogenous stimuli maintain intraepithelial lymphocytes via aryl hydrocarbon receptor activation . Cell. 2011; ; 147 : :629.–640. 9. Lee JS, Cella M, McDonald KG, et al. AHR drives the development of gut ILC22 cells and postnatal lymphoid tissues via pathways dependent on and independent of Notch . Nat Immunol. 2011; ; 13 : :144.–151. 10. Yang Q, Saenz SA, Zlotoff DA, et al. Cutting edge: Natural helper cells derive from lymphoid progenitors . J Immunol. 2011; ; 187 : :5505.–5509. 11. Carvunis AR, Dreze M. Les facteurs de virulence ciblent des protéines clés de l’interactome de l’hôte . Med Sci (Paris). 2012; ; 28 : :237.–239. |