| |
| Med Sci (Paris). 2012 March; 28(3): 262–264. Published online 2012 April 6. doi: 10.1051/medsci/2012283011.Découverte du premier facteur létal de Burkholderia pseudomallei, BLF1 Une avancée majeure pour contrer la mélioïdose Guillaume Hautbergue Department of molecular biology and biotechnology, the university of Sheffield, Firth Court, Western Bank, S10 2TNSheffield, Royaume-Uni MeSH keywords: Substitution d'acide aminé, Animaux, Antinéoplasiques, Toxines bactériennes, génétique, métabolisme, toxicité, Vaccins antibactériens, Guerre biologique, Burkholderia pseudomallei, pathogénicité, Cellules cultivées, effets des médicaments et des substances chimiques, microbiologie, Helicase, antagonistes et inhibiteurs , Facteur-4A d'initiation eucaryote, composition chimique, Exotoxines, physiologie, Humains, Mélioïdose, diagnostic, traitement médicamenteux, Thérapie moléculaire ciblée, Spécificité d'espèce, Virulence |
La mélioïdose est une infection bactérienne chronique souvent mortelle qui sévit de manière endémique en Asie du sud et au nord de l’Australie, et de façon sporadique dans certains pays tropicaux. Plusieurs millions de personnes sont infectées à travers le monde. La maladie est causée par la bactérie Burkholderia pseudomallei [1], aussi appelée bacille de Whitmore du nom de son découvreur en 1911. Cette bactérie aérobie capsulée à Gram négatif vit dans le sol et les eaux de surface des régions d’endémie, et sous une forme intracellulaire invasive dans le cytoplasme des cellules hôtes infectées. Elle est majoritairement transmise via des plaies au contact de l’environnement contaminé, mais aussi par ingestion et inhalation d’eau ou de matières souillées. Comme c’est le cas pour l’anthrax et la peste, la forme inhalée est la plus virulente, expliquant la prédominance des décès lors des saisons de moussons où les tempêtes cycloniques favorisent la formation d’aérosols. Nombre d’enfants travaillant le plus souvent nu-pieds dans les rizières sont infectés, et environ un tiers de la population des zones d’endémie est séropositive pour le pathogène. |
Caractéristiques pathogènes La mélioïdose est extrêmement difficile à diagnostiquer car les différents symptômes miment ceux de la tuberculose, de la fièvre typhoïde et de la malaria : pneumonie et septicémie sévères, abcès cutanés purulents, abcès intra-abdominaux et lésions neurologiques. La bactérie présente jusqu’à sept morphotypes, chacun ayant un pouvoir pathogène spécifique, ce qui complique son identification1. La maladie est d’ailleurs surnommée « la grande imitatrice ». Une multi-antibiothérapie prolongée au moins cinq mois est disponible, mais de nombreuses rechutes infectieuses surviennent chez les survivants. Il n’y a pas de vaccin [2]. Le bacille peut causer une forme aiguë de la maladie au cours des premières semaines d’incubation, tuant jusqu’à 40 % de ses victimes malgré le traitement médical. À l’inverse, il peut persister dormant dans l’organisme humain pendant plusieurs décennies. Entre 1965 et 1972, plus de 200 000 soldats américains engagés dans le conflit vietnamien ont contracté la forme latente du bacille, et de nombreux vétérans restent aujourd’hui infectés sans toutefois que la maladie se soit manifestée cliniquement. La mélioïdose a donc aussi été surnommée « la bombe à retardement du Viêtnam ». Il en avait été de même pour des millions de soldats d’autres nationalités exposés à la bactérie au cours des guerres sinojaponaises (1894-1945) et d’Indochine (1946-1979). |
Une arme de destruction massive Le bacille responsable de la mélioïdose est un agent de guerre biologique potentiel qui pourrait être utilisé par des terroristes puisqu’il prolifère facilement [3] et résiste très bien au froid hors des régions tropicales. Il survit au moins une décennie dans l’eau bidistillée et pourrait être responsable d’une contamination biologique à long terme d’une population et d’un environnement ciblés. Presque tous les animaux domestiques ou sauvages, ainsi que certaines plantes, sont sensibles au pathogène. Burkholderia mallei, le bacille apparenté responsable de la morve des équidés (une maladie contagieuse très proche de la mélioïdose) fut le premier agent de guerre biologique utilisé par les allemands contre les alliés lors de la Première Guerre mondiale (1914-1918) afin d’infecter le bétail et l’homme [4]. L’unité 731 de l’armée impériale japonaise (1932-1945), dont les expérimentations humaines létales sont notoires, a infecté des prisonniers de guerre chinois en contaminant leurs réserves d’eau potable. Plus tard, les soviétiques ont testé un programme d’épandages en champs qui tua involontairement plusieurs de leurs chercheurs. À la fin des années 1970, ils auraient utilisé ce bacille contre les moudjahidines au cours de la guerre d’Afghanistan [5]. |
Caractérisation de la toxine BLF1 L’analyse du génome de Burkholderia pseudomallei révéla l’acquisition par la bactérie d’un grand nombre de gènes codant pour divers facteurs de survie et diverses exotoxines impliquées dans la nécrose des tissus [6], ce qui faisait conclure aux auteurs que cette bactérie est une adepte de l’adaptation. En 2007, l’analyse comparée des protéomes de Burkholderia pseudomallei et de l’espèce non pathogène Burkholderia thailandensis a mis en évidence 14 protéines de fonction inconnue [7]. Nos travaux ont débuté avec l’étude des protéines dont les séquences d’acides aminés ne présentaient pas d’homologie avec d’autres facteurs connus. Parmi ces protéines, nous avons identifié pour la première fois une toxine mortelle de Burkholderia - de nom systématique BPSL1549 -, et défini son mécanisme d’action dans les cellules humaines [8]. Elle fut nommée Burkholderia lethal factor 1 (BLF1). Sa toxicité est très grande puisqu’une injection intrapéritonéale de cent millionièmes de gramme suffit à tuer une souris. Des concentrations nanomolaires de cette toxine tuent également des macrophages en culture, ceux-ci l’absorbant non spécifiquement par pinocytose. La structure tridimensionnelle de BLF1 est quasi identique au domaine glutaminase du facteur cytotoxique nécrosant de certaines bactéries Escherichia coli pathogènes, suggérant que BLF1 est une enzyme impliquée dans la désamination de résidus glutamine dans les protéines cibles. |
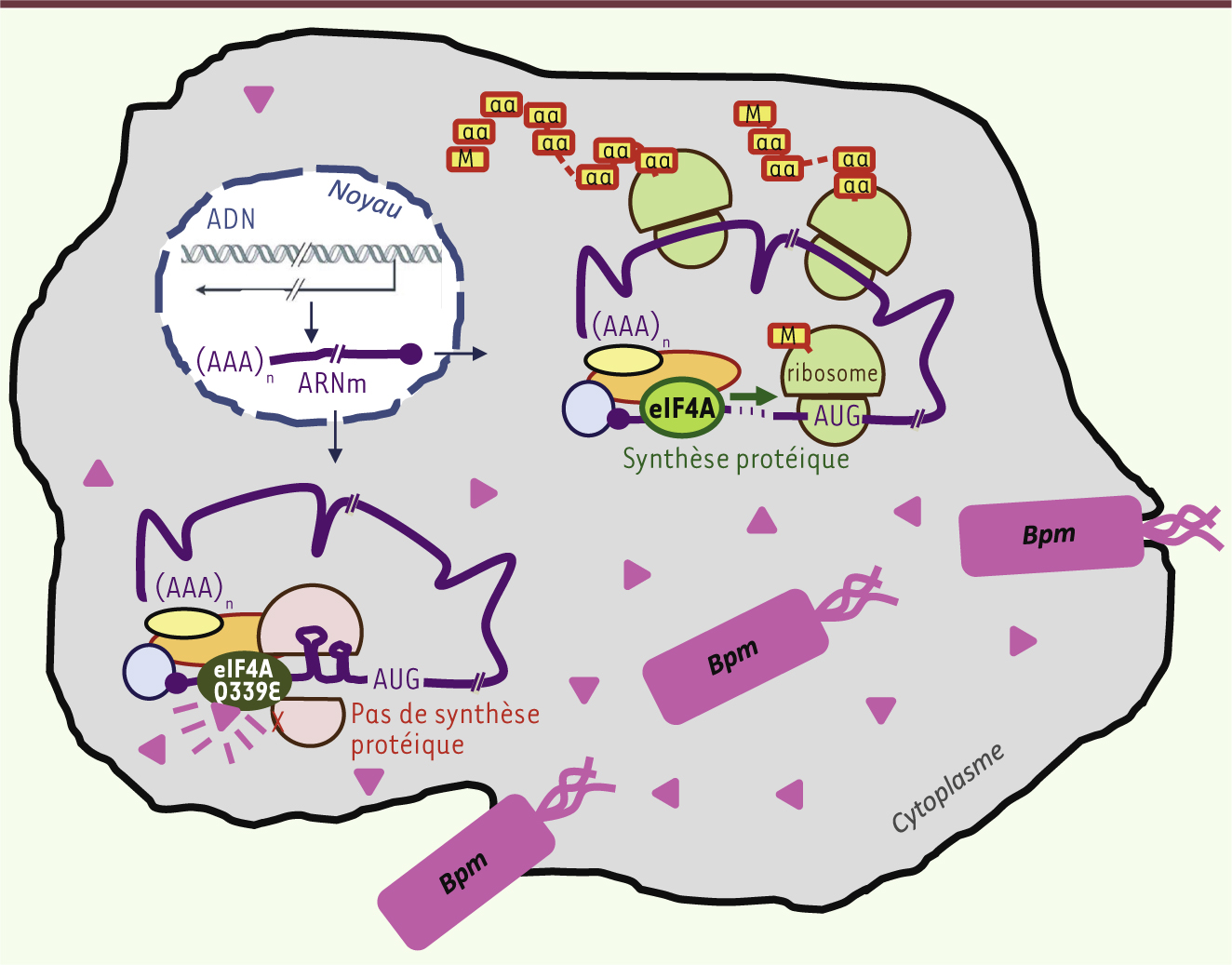
Mécanisme d’action de BLF1 Dans des cultures de cellules humaines infectées par BLF1, l’expression protéique de gènes rapporteurs est réduite, de même que l’incorporation d’un acide aminé radioactif au sein de protéines néosynthétisées. La protéine cible de BLF1 a été copurifiée de façon stœchiométrique avec la toxine : il s’agit du facteur d’initiation de la traduction eucaryote (eIF4A) essentiel à la biosynthèse des protéines [8]. L’activité de eIF4A requiert l’assemblage de ribosomes pour permettre la polymérisation des acides aminés en protéines selon l’ordre défini par les codons de l’ARN messager. Ce dernier est souvent parcouru simultanément par plusieurs autres ribosomes en phase d’élongation, formant des structures appelées polysomes. La sédimentation analytique d’extraits de cultures cellulaires infectées a révélé une accumulation de ribosomes associée à une forte diminution de polysomes, montrant que l’inhibition de la traduction résulte d’un blocage de l’étape d’initiation. Plus précisément, la toxine modifie la glutamine 339 du facteur eIF4A et lui substitue un acide aspartique (mutation Q339E), inactivant l’activité ARN hélicase qui est requise pour la dénaturation des structures secondaires de l’ARN messager au cours de l’initiation de la traduction (Figure 1).
 | Figure 1. Schéma d’une cellule humaine infectée par la forme invasive de la bactérie Burkholderia pseudomallei (Bpm). Bpm sécrète de nombreux facteurs de virulence, dont la toxine BLF1 représentée par des triangles roses. Dans le noyau de la cellule hôte, la transcription de l’ADN des gènes conduit à l’export nucléaire d’ARN messagers matures (ARNm) qui sont ensuite traduits en protéines dans le cytoplasme. L’ARNm circularisé par un complexe riboprotéique d’initiation comporte de nombreuses structures secondaires. Leur détection par l’activité hélicase du facteur eIF4A permet l’assemblage de l’ARNm avec des ribosomes actifs pour la synthèse des protéines (polymérisation d’acides aminés [aa] au niveau de la méthionine initiatrice [M]). La désamination de la glutamine 339 du facteur eIF4A par la toxine BLF1 (mutation Q339E de la séquence protéique) entraîne la perte de l’activité hélicase et la séquestration des ARNm et des sous-unités ribosomiques dans des complexes d’initiation figés. Une molécule de toxine peut inactiver 700 molécules eIF4A par minute. La mort de la cellule est provoquée par l’arrêt de la synthèse protéique lorsque les ribosomes ont été inactivés. |
|
Espoirs thérapeutiques nés de cette découverte La caractérisation de la base moléculaire de l’action de la toxine de la mélioïdose devrait permettre le développement de molécules inhibant l’interaction de la toxine avec eIF4A pour le traitement de la maladie. Le criblage de plusieurs milliers de composés chimiques altérant potentiellement cette interaction ainsi que la détermination de la structure de l’interface eIF4A:BLF1 sont actuellement privilégiés. Un autre axe important de recherche consiste à inactiver cette nouvelle toxine pour permettre l’élaboration d’un vaccin qui n’a pas encore été formulé malgré de très nombreux essais [2]. Une autre application pourrait être suggérée : on sait que plusieurs inhibiteurs de la traduction sont également de bons agents anticancéreux [9]. Or, le facteur mutant eIF4A Q339E résultant de l’action de la toxine exerce une fonction de dominant négatif extrêmement toxique pour la synthèse protéique, ce qui entraîne la mort de tous les types cellulaires immortalisés testés. Il représente donc potentiellement, avec la toxine BLF1, un nouvel outil pour le traitement chimiothérapeutique ciblé de tumeurs. Beaucoup d’efforts seront nécessaires avant que ne soit mis au point un système fiable de délivrance médicamenteux utilisant la micro-injection de particules, la thérapie génique sous contrôle d’un promoteur oncogène activé dans les cellules tumorales ou l’injection d’anticorps couplés reconnaissant les cellules cancéreuses. D’autre part, l’activité de BLF1 est conservée dans les macrophages, et ceux-ci pourraient servir ponctuellement à convoyer la protéine toxique vers les tumeurs [10]. Un brevet a été déposé pour les utilisations thérapeutiques de mutants eIF4A et de la toxine BLF1. |
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. Wiersinga WJ, van der Poll T, White NJ, et al. Melioidosis: insights into the pathogenicity of Burkholderia pseudomallei . Nat Rev Microbiol. 2006; ; 4 : :272.–282. 2. Patel N, Conejero L, De Reynal M, et al. Development of vaccines against burkholderia pseudomallei . Front Microbiol. 2011; ; 2 : :198.. 3. Stone R. Infectious disease. Racing to defuse a bacterial time bomb . Science. 2007; ; 317 : :1022.–1024. 4. Wheelis M. First shots fired in biological warfare . Nature. 1998; ; 395 : :213.. 5. Estes DM, Dow SW, Scheizer HP, Torres AG. Present and future therapeutic strategies for melioidosis and glanders . In: Fong IW, Alibek K, eds. Bioterrorism and infectious agents. A new dilemma for the 21st century . New York: : Springer; , 2005 : :99.–145. 6. Holden MT, Titball RW, Peacock SJ, et al. Genomic plasticity of the causative agent of melioidosis, Burkholderia pseudomallei . Proc Natl Acad Sci USA. 2004; ; 101 : :14240.–14245. 7. Wongtrakoongate P, Mongkoldhumrongkul N, Chaijan S, et al. Comparative proteomic profiles and the potential markers between Burkholderia pseudomallei and Burkholderia thailandensis . Mol Cell Probes. 2007; ; 21 : :81.–91. 8. Cruz-Migoni A, Hautbergue GM, Artymiuk PJ, et al. A Burkholderia pseudomallei toxin inhibits helicase activity of translation factor eIF4A . Science. 2011; ; 334 : :821.–824. 9. Malina A, Cencic R, Pelletier J. Targeting translation dependence in cancer . Oncotarget. 2011; ; 2 : :76.–88. 10. Batrakova EV, Gendelman HE, Kabanov AV. Cell-mediated drug delivery . Expert Opin Drug Deliv. 2011; ; 8 : :415.–433. |