| |
| Med Sci (Paris). 2012 March; 28(3): 267–269. Published online 2012 April 6. doi: 10.1051/medsci/2012283013.Le trafic membranaire, un nouvel acteur du guidage axonal Kathleen Zylbersztejn1,2 and Thierry Galli1,2* 1Université Paris Diderot, Sorbonne Paris Cité, institut Jacques Monod, CNRS UMR7592, programme développement et neurobiologie, Paris, 75013France 2Inserm ERL U950, trafic membranaire dans la morphogenèse neuronale et épithéliale, Paris, 75013France MeSH keywords: Animaux, Axones, physiologie, Transport biologique, Membrane cellulaire, Mouvement cellulaire, Cytosquelette, ultrastructure, Endocytose, Cônes de croissance, Souris, Modèles biologiques, Facteurs de croissance nerveuse, Système nerveux, embryologie, Protéines SNARE, Sémaphorine-3A, Protéine SNAP-25, Syntaxine-1, Protéines suppresseurs de tumeurs, Synaptobrévine-2 |
Les molécules de guidage contrôlent la migration des neurones et la trajectoire des axones en croissance par attraction et répulsion. La signalisation se fait au niveau du cône de croissance où la molécule de guidage se lie à son récepteur. Le rôle du trafic membranaire dans ce mécanisme est encore largement inconnu. Les SNARE (soluble NSF attachment protein receptors), protéines essentielles à la fusion membranaire, ont été récemment impliquées dans le guidage axonal au travers de leurs rôles dans le trafic de molécules régulant l’homéostasie du cône de croissance et dans le trafic des récepteurs de guidage. Nous faisons ici la synthèses des données les plus récentes, notamment sur le rôle des SNARE vésiculaires synaptobrévine-2 et TI-VAMP (tetanus neurotoxin insensitive vesicle-associated membrane protein) dans la répulsion et l’attraction axonales. |
Régulation du guidage axonal Lors du développement embryonnaire du système nerveux, la migration des neurones et la trajectoire des axones et dendrites en croissance sont contrôlées par les molécules de guidage. Ces protéines peuvent être attractives (nétrines et sémaphorines) ou répulsives (nétrines, sémaphorines, éphrines et slit) [1]. La signalisation des molécules de guidage se fait au niveau du cône de croissance situé à l’extrémité apicale de l’axone. Les molécules de guidage se lient à leurs récepteurs spécifiques, activant ainsi une cascade de signalisation impliquant les petites GTPases de la famille des Rho et/ou le calcium intracellulaire. Par la suite, les seconds messagers agissent sur le cytosquelette d’actine et de microtubules du cône de croissance, induisant un changement de sa morphologie en direction ou à l’opposé de la source de molécules. Le rôle du trafic membranaire dans ce processus reste encore mal établi [2]. Le trafic membranaire se divise en trois étapes majeures : (1) la formation et la fission d’une vésicule à partir d’un compartiment donneur, (2) le transport de cette vésicule sur le cytosquelette et, enfin, (3) l’ancrage de cette vésicule à un compartiment cible et sa fusion avec la membrane acceptrice [12]. La dernière étape implique une famille de protéines essentielles : les SNARE. Il existe deux types de SNARE : les v-SNARE (v pour vesicular) localisées sur les vésicules, et les t-SNARE (t pour target) localisées à la membrane cible. Deux v-SNARE ont été impliquées dans le guidage axonal : Syb2 qui cible des neurotoxines botulique et tétanique, et TI-VAMP qui est insensible aux neurotoxines. Deux rôles potentiels des SNARE dans le guidage axonal ont été proposés : (1) un rôle indirect dans le trafic de protéines régulant la réponse du cône de croissance au signal de guidage ; (2) un rôle direct dans le trafic de membrane et des récepteurs de guidage. Ces deux hypothèses ne sont pas exclusives et peuvent être deux facettes d’un système plus complexe qui impliquerait d’autres éléments régulateurs dans l’espace et le temps. |
Rôles indirects des SNARE dans le guidage axonal Synaptosomal-associated protein of 25kD (SNAP-25), la syntaxine-1 et Syb2 sont impliquées dans le trafic de canaux ioniques qui, eux mêmes, influencent la signalisation dépendante des sémaphorines (Séma) [2]. Ainsi, SNAP-25 interagit directement avec le canal calcique Ca(v)2.1, et potentiellement avec Ca(v)2.3. Or, ces canaux sont nécessaires à la signalisation de Séma3A et Séma2A, ainsi qu’à la mise en place du réseau neuronal. Syb2 interagit aussi avec TRPC3 (transient receptor potential cation channel, subfamily, member 3) qui est un canal non sélectif perméable aux cations. Syb2 et TI-VAMP interviennent par ailleurs dans le trafic de molécules d’adhésion qui affectent la réponse du cône de croissance aux signaux de guidage. Syb2 est ainsi impliquée dans le trafic de l’intégrine β1, qui est nécessaire à la répulsion induite par la molécule MAG (myelin associated glycoprotein). TI-VAMP, quant à elle, est impliquée dans le trafic de L1-CAM (L1-cell adhesion molecule), cette dernière régulant la réponse attractive ou répulsive induite par la Séma3A [3, 4]. |
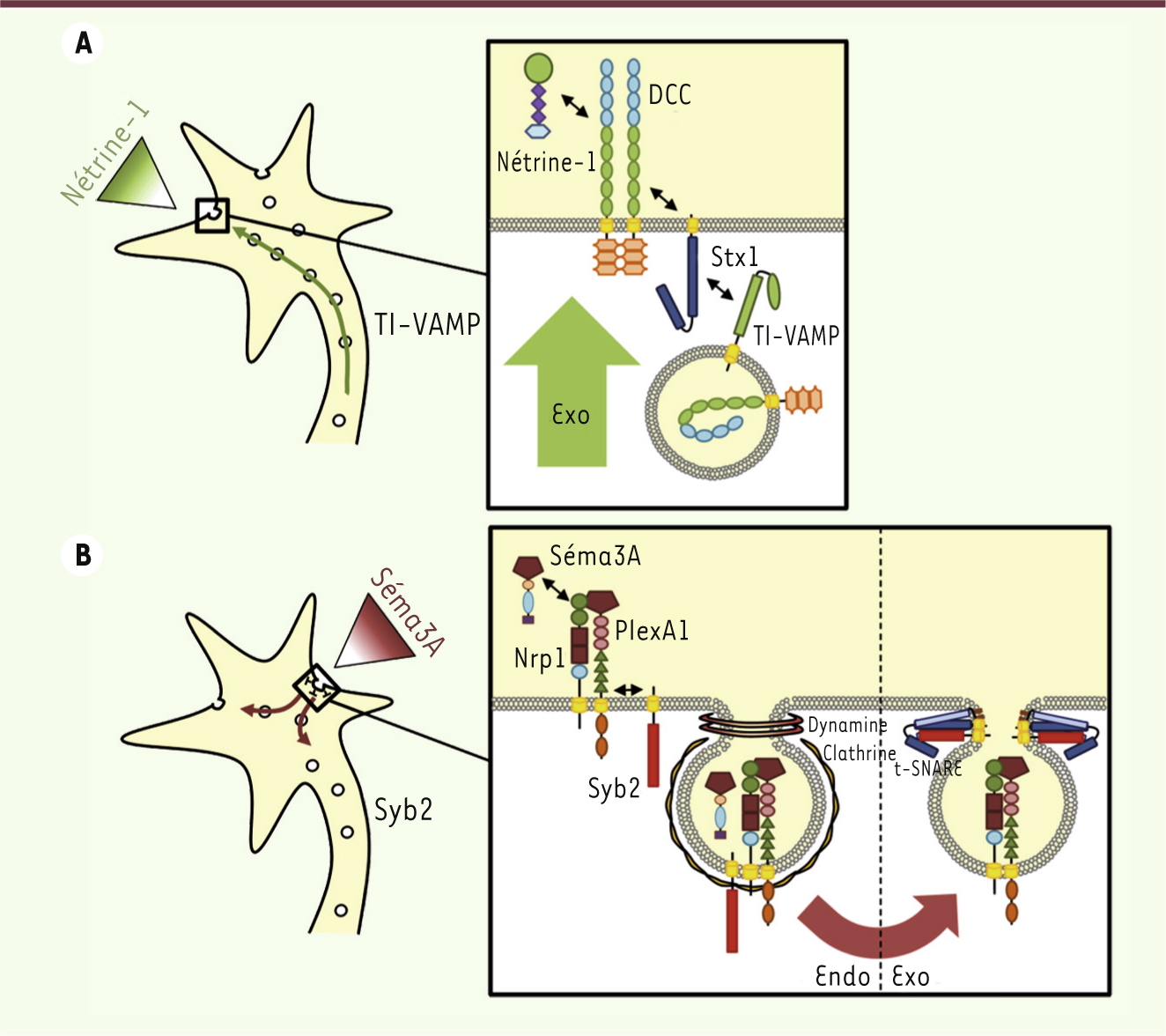
Rôle direct de TI-VAMP dans le guidage attractif Deux équipes ont montré que la formation de groupes de récepteurs DCC (deleted in colorectal cancer) induite par la nétrine-1 à la surface membranaire des axones, est dépendante d’une exocytose insensible à la toxine tétanique [5, 6]. Activé par la nétrine-1, DCC entraîne l’interaction de TI-VAMP avec la syntaxine-1 (Stx1), une t-SNARE partenaire de TI-VAMP. Les vésicules contenant TI-VAMP et DCC fusionnent alors avec les domaines membranaires enrichis en syntaxine-1 et DCC, augmentant ainsi la quantité de récepteurs et de membrane en direction de la source de nétrine-1 [7] (Figure 1A).
 | Figure 1. Rôles de TI-VAMP et Syb2 dans le trafic des récepteurs lors du guidage axonal dépendant de la nétrine-1 et de la sémaphorine-3A. A. L’attraction dépendante de la nétrine-1 induit un virage du cône de croissance par exocytose de membrane et de récepteurs. La nétrine-1 active son récepteur DCC qui se lie à la syntaxine-1. Les vésicules contenant TI-VAMP et riches en DCC subissent une endocytose en réponse à l’interaction entre la syntaxine-1 et TI-VAMP. B. La répulsion dépendante de la sémaphorine-3A induit un virage du cône de croissance par une endocytose de membrane et de récepteurs. La sémaphorine-3A se lie à son récepteur neuropiline-1/plexine-A1 qui interagit avec Syb2. Le complexe subit ensuite une endocytose par la voie dépendante de la clathrine. Le récepteur est ensuite recyclé à la membrane au sein d’un domaine membranaire exempt de Séma3A. Syb2 est nécessaire à l’endocytose et au recyclage du récepteur. Séma3A : sémaphorine-3A ; Nrp1 : neuropiline-1 ; PlexA1 : plexine-A1 ; Stx1 : yntaxine-1 ; Syb2 : synaptobrévine-2 ; DCC : deleted in colorectal cancer. |
|
Rôle direct de Syb2 dans le guidage répulsif Nous venons de montrer que Syb2 est nécessaire au guidage répulsif induit par Séma3A, mais n’est pas impliquée dans le guidage attractif induit par Séma3C [8]. De plus, dans les embryons génétiquement invalidés (knock-out) pour Syb2, les axones frontaux du corps calleux sont désorganisés et défasciculés comme dans le modèle d’invalidation de Séma3A, ces effets n’étant pas retrouvés après l’invalidation de Séma3C. Nos travaux ont aussi montré que Syb2 interagissait directement avec le récepteur de Séma3A, le complexe neuropiline-1/plexine-A1 (Nrp1/PlexA1), via leur domaine juxtatransmembranaire. Cette interaction entre Syb2 et le récepteur de Séma3A a été confirmée à la fois dans le cerveau embryonnaire et dans les cellules épithéliales HEK, un système hétérologue complémentaire. Par ailleurs, sous l’action de Séma3A, le récepteur et une grande quantité de membranes subissent une endocytose provoquant une réduction de la longueur axonale, une diminution de la quantité de plexine-A1 au niveau du cône de croissance et son accumulation dans le corps cellulaire. Lorsque des axones sont dépourvus de Syb2, ces phénomènes sont abolis, révélant un lien étroit entre l’expression de Syb2 et le trafic du récepteur de Séma3A. Séma3A inhibe aussi l’exocytose dépendante de Syb2 dans un système hétérologue constitué de cellules Cos7 exprimant Syb2 et le récepteur de Séma3A (Nrp1/PlexA1). Pris dans leur ensemble, ces résultats permettent de conclure que Syb2 est nécessaire au trafic du complexe Nrp1/PlexA1 au cours de la répulsion axonale induite par Séma3A, et ce en régulant l’équilibre exocytose/endocytose du récepteur [8] (Figure 1B). Au regard de ces récentes découvertes sur TI-VAMP et Syb2, nous suggérons qu’un des rôles des v-SNARE dans le développement est de réguler la réponse du cône de croissance aux molécules de guidage et ce en contrôlant l’expression des récepteurs à la surface cellulaire via la modulation de la balance exocytose/endocytose. |
Afin d’approfondir ces résultats, il serait intéressant de déterminer si TI-VAMP et Syb2 sont respectivement responsables de l’attraction et de la répulsion axonale générale ou s’ils sont impliqués dans des guidages spécifiques, impliquant nétrine-1 et sémaphorine-3A, respectivement. Les applications thérapeutiques potentielles sont d’une grande portée puisque les molécules de guidage sont aussi impliquées dans le développement de maladies neurodégénératives, de lésions nerveuses et de cancers [9, 10]. L’utilisation des neurotoxines clostridiales pourrait être envisagée pour stimuler la régénération neuronale après une lésion nerveuse (en retirant la sensibilité aux molécules répulsives), pour bloquer le développement et la migration de cellules cancéreuses, comme nous l’avions proposé dans des travaux antérieurs [11]. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
Nous remercions Marie-Christine Simmler pour la relecture de ce manuscrit. Ce travail a été soutenu par des financements provenant de l’Inserm, l’Association française contre les myopathies (AFM), l’Association pour la recherche sur le cancer (ARC), la mairie de Paris (programme recherche médicale et santé), la Fondation pour la recherche médicale (FRM), l’École des neurosciences de Paris (ENP) (pour T. Galli). K. Zylbersztejn a reçu le soutien d’une bourse de docteur ingénieur du CNRS et d’une bourse de fin d’étude de la FRM.
|
1. Huber AB, Kolodkin AL, Ginty DD, Cloutier JF. Signaling at the growth cone: ligand-receptor complexes and the control of axon growth and guidance . Annu Rev Neurosci. 2003; ; 26 : :509.–563. 2. Zylbersztejn K, Galli T. Vesicular traffic in cell navigation . FEBS J. 2011; ; 278 : :4497.–4505. 3. Alberts P, Rudge R, Hinners I, et al. Cross talk between tetanus neurotoxin-insensitive vesicle-associated membrane protein-mediated transport and L1-mediated adhesion . Mol Biol Cell. 2003; ; 14 : :4207.–4220. 4. Castellani V, Chedotal A, Schachner M, et al. Analysis of the L1-deficient mouse phenotype reveals cross-talk between Sema3A and L1 signaling pathways in axonal guidance . Neuron. 2000; ; 27 : :237.–249. 5. Matsumoto H, Nagashima M. Netrin-1 elevates the level and induces cluster formation of its receptor DCC at the surface of cortical axon shafts in an exocytosis-dependent manner . Neurosci Res. 2010; ; 67 : :99.–107. 6. Bouchard JF, Moore SW, Tritsch NX, et al. Protein kinase A activation promotes plasma membrane insertion of DCC from an intracellular pool: A novel mechanism regulating commissural axon extension . J Neurosci. 2004; ; 24 : :3040.–3050. 7. Cotrufo T, Perez-Branguli F, Muhaisen A, et al. A signaling mechanism coupling netrin-1/deleted in colorectal cancer chemoattraction to SNARE-mediated exocytosis in axonal growth cones . J Neurosci. 2011; ; 31 : :14463.–14480. 8. Zylbersztejn K, Petkovic M, Burgo A, et al. A vesicular SNARE required for Semaphorin 3A axonal repulsion . J Cell Biol. 2012; ; 196 : :37.–46. 9. Pasterkamp RJ, Giger RJ. Semaphorin function in neural plasticity and disease . Curr Opin Neurobiol. 2009; ; 19 : :263.–274. 10. Rizzolio S, Tamagnone L. Multifaceted role of neuropilins in cancer . Curr Med Chem. 2011; ; 18 : :3563.–3575. 11. Proux-Gillardeaux V, Galli T. Rôle du trafic membranaire dans la migration cellulaire : Une nouvelle application pour les neurotoxines clostridiales ? Med Sci (Paris). 2005; ; 21 : :789.. 12. Tareste D. Énergie libérée par la machinerie de fusion SNAREpin . Med Sci (Paris). 2008; ; 24 : :142.–143. |