| |
| Med Sci (Paris). 2012 March; 28(3): 269–271. Published online 2012 April 6. doi: 10.1051/medsci/2012283014.Le silence parlant de la sirtuine 1 dans la stéatose et le cancer du foie Hélène Gilgenkrantz1* and Christine Perret1 1Institut Cochin, Inserm U1016, CNRS UMR 8104, université Paris-Descartes, 24 rue du faubourg Saint-Jacques, 75005Paris, France MeSH keywords: Animaux, Carcinome hépatocellulaire, étiologie, Protéines de transport, physiologie, Altération de l'ADN, Évolution de la maladie, Jeûne, Stéatose hépatique, métabolisme, Gènes suppresseurs de tumeur, Néoglucogenèse, Humains, Hyperglycémie, génétique, Inflammation, Insuline, Insulinorésistance, Tumeurs du foie, Tumeurs expérimentales du foie, Macrophages, Souris, Souris obèse, Souris transgéniques, Protéines tumorales, Stress oxydatif, Sirtuine-1, déficit |
Les sirtuines sont des déacétylases dépendantes du NAD+ dont les substrats sont impliqués dans de nombreux phénomènes biologiques aussi variés que la croissance, l’apoptose, la sénescence, l’autophagie, l’adaptation à la restriction calorique et le métabolisme. Chez les mammifères, la protéine sirtuine 1 (Sirt1) est, parmi les sept membres de la famille des Sirtuines, celle qui se rapproche le plus du produit du gène silencing information regulator 2 ou Sir2 dont la mutation diminue la longévité chez le ver et la mouche. Cependant, si différents travaux ont démontré des effets positifs de Sirt1 dans les maladies associées à l’âge, aucune preuve directe n’a permis de démontrer que Sirt1 pouvait influer sur la longévité des mammifères. Ne disposant pas d’un domaine de liaison à l’ADN, Sirt1 module l’expression de nombreux gènes par l’intermédiaire de facteurs de transcription et modifie certaines marques épigénétiques en s’associant à des régions d’hétérochromatine ou en déacétylant certaines histones. C’est sans doute sur le métabolisme que les effets de Sirt1 ont été les plus étudiés. Ainsi, Sirt1 peut être considérée comme un senseur métabolique faisant le lien entre la réponse au stress oxydant et métabolique de la cellule, sa structure chromatinienne et son expression génique, autant d’éléments modulés au cours du développement tumoral. |
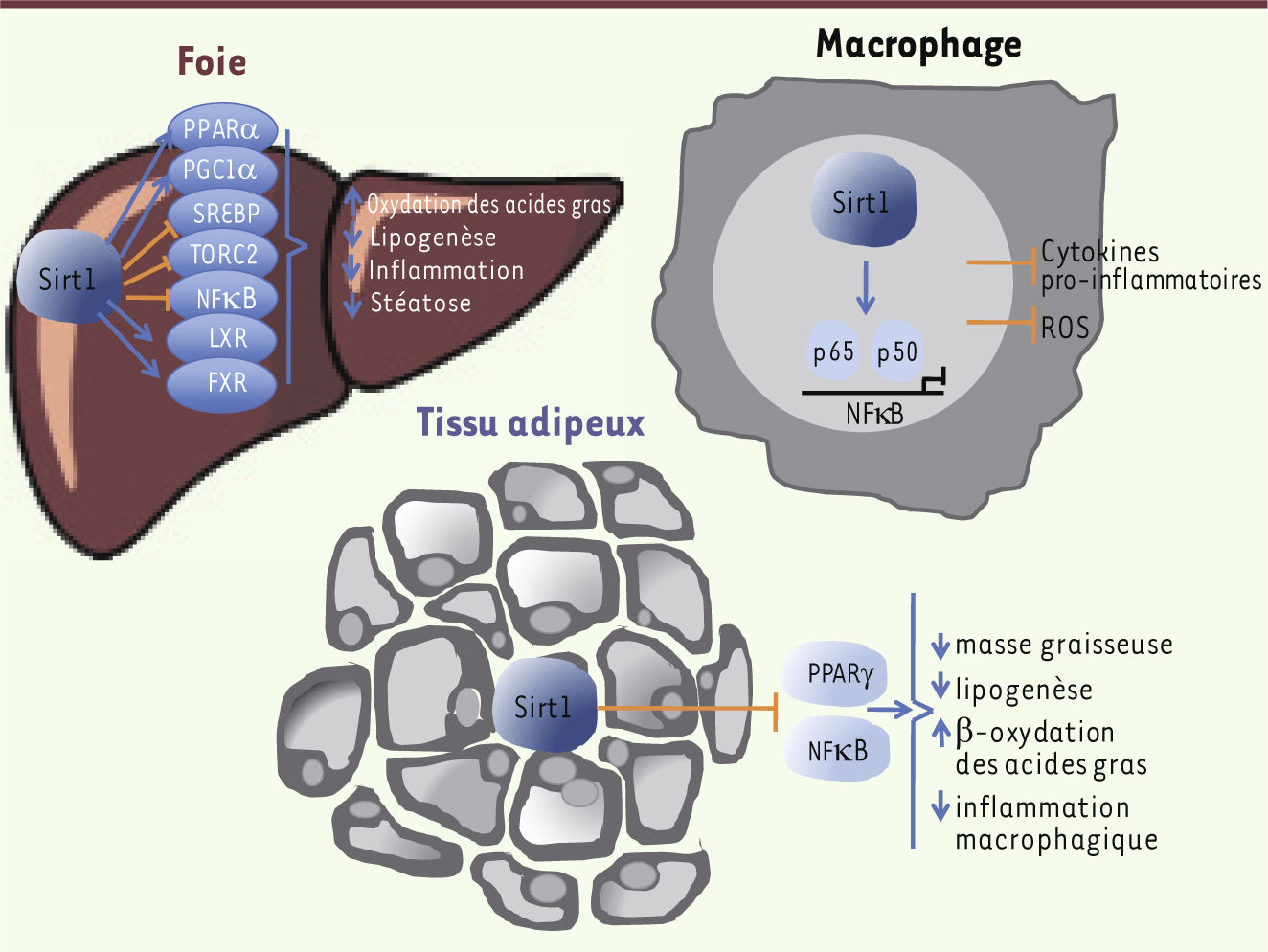
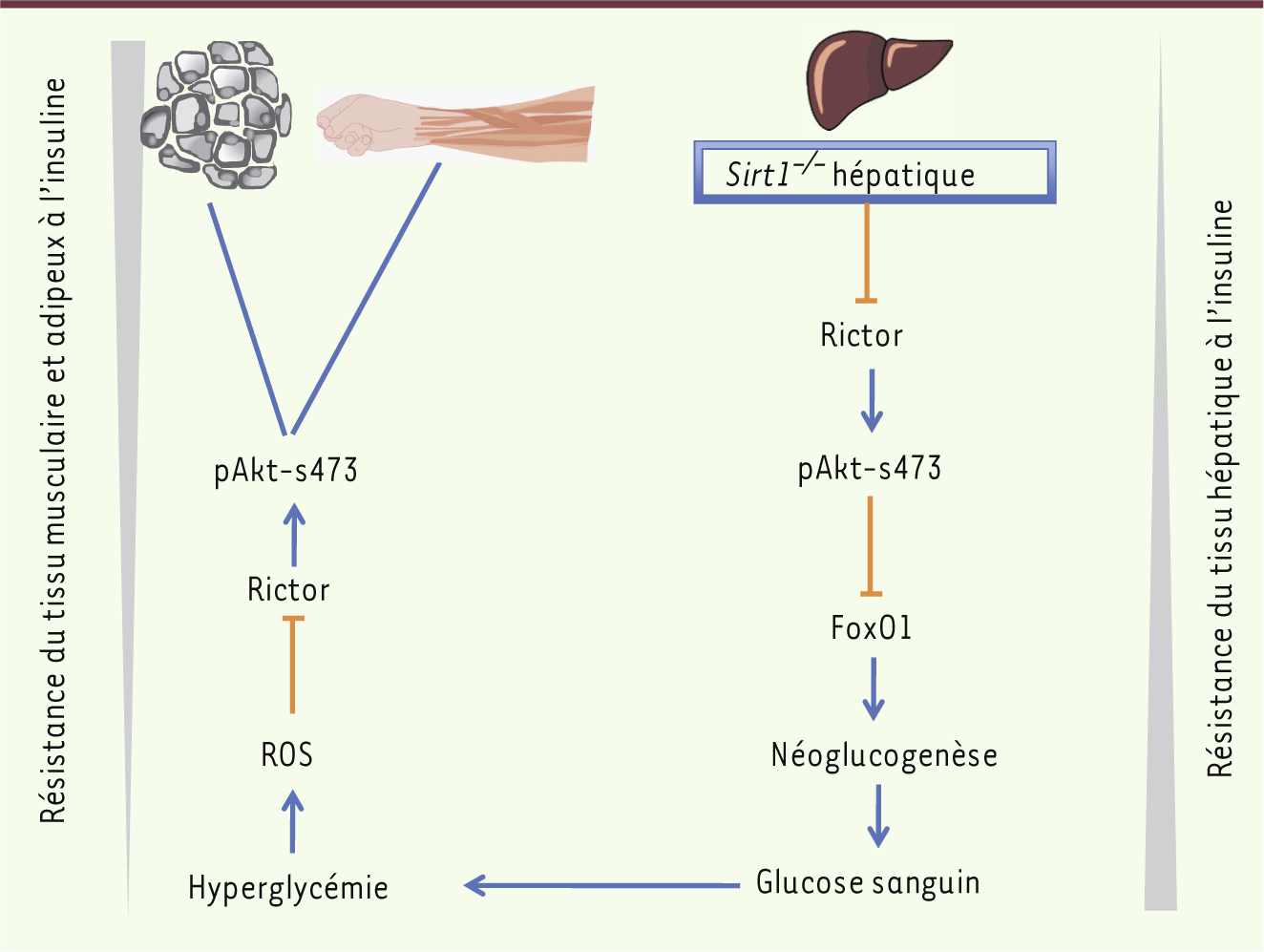
Sirt1 et stéatose hépatique Sirt1 est connue pour son implication dans la gluconéogenèse hépatique, la régulation de la prise alimentaire par l’hypothalamus, la mobilisation des graisses du tissu adipeux blanc, la sécrétion pancréatique d’insuline et l’activité de l’horloge circadienne dans les tissus métaboliques. Ainsi, l’augmentation de l’expression de Sirt1, qu’elle soit restreinte aux cellules β du pancréas, au tissu adipeux ou qu’elle touche l’ensemble de l’organisme [1], protège les souris contre le diabète et contre la stéatose hépatique - une accumulation anormale et délétère de triglycérides dans les hépatocytes. Les souris transgéniques surexprimant Sirt1 sont plus minces que leurs homologues contrôles, métaboliquement plus actives et ont des taux sériques réduits de cholestérol, d’adipokines, d’insuline et de glucose. De même, l’activation hépatique de Sirt1 induite par le jeûne diminue la glycémie, l’insulinémie, le stress du réticulum endoplasmique ainsi que la stéatose hépatique de la souris obèse [2]. Par ailleurs, les différentes invalidations de Sirt1 sélectivement dans le lignage myéloïde ou les neurones pro-opiomélanocortines qui contrôlent la prise alimentaire [3], induisent une susceptibilité accrue à la stéatose et une intolérance au glucose. Néanmoins, la délétion - spécifiquement dans le foie - de l’exon 4 du gène Sirt1 a induit des réponses contradictoires à une diète riche en graisses, accélérant la stéatose hépatique dans un cas [4], l’inhibant dans l’autre [5]. Plus récemment, une délétion des exons 5 et 6 du même gène a permis de conforter la notion d’un rôle protecteur de Sirt1 contre la stéatose hépatique en conditions normales d’alimentation [6]. Quelles sont les pistes moléculaires en jeu dans cette action pléiotrope qui concourt au développement d’une stéatose en cas de déficience ? La délétion de Sirt1 induit un défaut de signalisation de la voie du peroxisome proliferator activated receptor α (PPARα) et diminue la β-oxydation des acides gras [4], en partie via son coactivateur, le proliferator activated receptor γ coactivator 1α (PGC1α), qui est aussi une cible directe de Sirt1 [7]. Sirt1, qui est activée dans le foie par le jeûne, régule également le métabolisme du cholestérol via la déacétylation des liver X receptors (LXR) [8], du farnesoid X receptor (FXR) [9] et de la sterol regulatory element-binding protein (SREBP) [10]. Dans le tissu adipeux, l’augmentation de Sirt1 diminue le stockage des graisses et augmente la lipolyse peut-être via la répression de PPARγ, un récepteur nucléaire qui joue un rôle essentiel dans le stockage des acides gras (Figure 1). Plus récemment, il a été démontré que Sirt1 contrôlait positivement Rictor, induisant une cascade de phosphorylations de la serine/threonine protein kinase Akt et de la forkhead box protein O1 (FoxO1) [11]. Ainsi, le défaut de Sirt1 induit une production accrue de glucose hépatique, une hyperglycémie chronique et une production augmentée d’espèces réactives de l’oxygène. Ce stress oxydant inhibe la voie de signalisation de la mammalian target of rapamycin C2 (mTORC2)/Akt dans les autres organes sensibles à l’insuline, mettant à nouveau le stress oxydant au centre de la maladie métabolique du foie (Figure 2). À l’inverse, l’augmentation de la Sirt1 musculaire induite par la restriction calorique (en inactivant par déacétylation le facteur de transcription signal transducer and activator of transcription 3 [STAT3]) diminue l’expression de la phosphatidylinositol 3-kinase (PI3K) et augmente la sensibilité du muscle à l’insuline [12]. Enfin, Sirt1 contrôle positivement l’expression d’une autre sirtuine, Sirt6, via son interaction avec FoxO1 et le nuclear respiratory factor 1 (NRF1). Or, la délétion de Sirt6 s’accompagne également d’une stéatose hépatique, caractérisée par une augmentation de la synthèse des triglycérides et une diminution de la β-oxydation [13]. L’expression de ces deux sirtuines, Sirt1 et Sirt6, est diminuée dans les échantillons de foie humain stéatosique, corroborant le rôle inhibiteur de ces deux sirtuines dans la formation du foie gras. Mais toutes ces cibles ne se limitent pas au foie et au tissu adipeux. En effet, au cours de la stéatose hépatique, l’inflammation et le stress oxydant jouent un rôle synergique conduisant à une maladie hépatique plus grave, la stéato-hépatite non alcoolique (NASH). Or, Sirt1 lie, déacétyle et inhibe NF-ƘB notamment au niveau macrophagique, réduisant la production cytokinique de ces cellules et, par conséquent, la réponse inflammatoire (Figure 1).
 | Figure 1.
Les différentes voies de signalisation modulées par Sirt1. Sirt1 peut exercer un effet protecteur vis-à-vis de la stéatose hépatique en modulant différentes voies de signalisation. Ainsi, Sirt1 contrôle de nombreuses voies métaboliques au niveau du tissu adipeux et du foie. Par ailleurs, elle inhibe au niveau macrophagique la production de cytokines pro-inflammatoires et la production d’espèces réactives de l’oxygène. En son absence, inflammation et stress oxydant contribuent au développement de la stéato-hépatite. ROS : reactive oxygen species. |
 | Figure 2.
Rôle de Sirt1 dans la résistance à l’insuline au niveau hépatique et périphérique. Le défaut de Sirt1 induit la néoglucogenèse via la voie Akt. L’hyperglycémie qui en résulte génère des espèces réactives de l’oxygène qui, en inhibant la même voie PI3K/Akt, sont responsables d’une résistance à l’insuline au niveau du muscle. Rictor : protéine associée à mTOR insensible à la rapamycine. |
|
Sirt1 et carcinome hépatocellulaire Pour un oncologue, Sirt1 a un visage de Janus. Son rôle dans la restriction calorique ou dans l’inhibition de la signalisation insulinique et de l’insulin-growth factor-1 (IGF-1) la place plutôt parmi les gènes suppresseurs de tumeur. Ainsi, l’incidence des cancers diminue chez les souris surexprimant Sirt1, bien qu’elle soit limitée aux carcinomes et aux sarcomes [14]. À l’inverse, les actions proangiogénique et proliférative de Sirt1, ainsi que sa fonction antiapoptotique, font plutôt de cette protéine un oncogène. Si ce rôle très controversé de Sirt1 dans la carcinogenèse dépend du contexte cellulaire, qu’en est-il au niveau hépatique ? Les souris transgéniques surexprimant Sirt1 sont protégées du carcinome hépatocellulaire induit par l’action combinée d’un régime riche en graisses et d’un carcinogène hépatique [15]. Au moins trois des fonctions de Sirt1 pourraient contribuer à cet effet suppresseur de tumeur [14]. En premier lieu, Sirt1 est un gardien de l’intégrité du génome et ce, à plusieurs titres : lors d’un dommage de l’ADN induit par un défaut de p53, Sirt1 se relocalise au niveau des sites lésés, réprimant alors la transcription. On sait par ailleurs que l’absence de Sirt1 s’accompagne d’un défaut de réparation des cassures d’ADN double brin. Enfin, tel un horloger du temps qui passe, Sirt1 ralentit l’érosion télomérique in vivo. Le second mécanisme passerait par son activité anti-inflammatoire et sa capacité de réduction du stress oxydant puisque l’on sait que l’inflammation forme le trait d’union entre obésité/stéatose et cancer du foie (voir m/s 2010, n° 5 , pp 477). L’analyse du foie des animaux transgéniques surexprimant Sirt1 confirme non seulement leur protection vis-à-vis des lésions de l’ADN, mais aussi une inflammation dépendante de la voie NF-ƘB moins marquée. Enfin, le troisième et dernier mécanisme, qui jusqu’à présent n’a été démontré que dans l’intestin, pourrait peut-être s’appliquer au foie. Sirt1, par déacétylation de la β-caténine, inhibe la tumorigenèse intestinale induite par l’activation de cette voie. Or, la voie Wnt/β-caténine est activée dans près de 50 % des carcinomes hépatocellulaires. Différentes signatures moléculaires ont déjà permis de rendre compte de l’hétérogénéité de ces carcinomes. Il sera donc intéressant, à l’avenir, d’inclure les sirtuines dans ces classifications complexes. Le rôle des autres sirtuines a en effet été beaucoup moins étudié. Sirt2 semble agir comme un suppresseur de tumeur. Sirt6 est principalement localisée au niveau de la mitochondrie et jouerait un double jeu puisque capable, comme Sirt1, d’induire à la fois l’apoptose en conditions normales ou la survie en conditions de stress. S’il reste encore beaucoup à apprendre sur les mécanismes d’action des sirtuines dans la carcinogenèse, les différents rôles de Sirt1 que nous venons de décrire dans le foie sont une nouvelle preuve que métabolisme et cancer sont intimement liés ! |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Schug TT, Li X. Sirtuin 1 in lipid metabolism an obesity . Ann Med. 2011; ; 43 : :198.–211. 2. Li Y, Xu S, Giles A, et al. Hepatic overexpression of SIRT1 in mice attenuates endoplasmic reticulum stress and insulin resistance in the liver . FASEB J. 2011; ; 25 : :1664.–1679. 3. Ramadori G, Fujikawa T, Fukuda M, et al. SIRT1 deacetylase in POMC neurons is required for homeostatic defenses against diet-induced obesity . Cell Metab. 2008; ; 12 : :78.–87. 4. Purushotham A, Schug TT, Xu Q, et al. Hepatocyte-specific deletion of SIRT1 alters fattyacid metabolism and results in hepatic steatosis and inflammation . Cell Metab. 2009; ; 9 : :327.–338. 5. Chen D, Bruno J, Easlon E, et al. Tissue-specific regulation of SIRT1 by calorie restriction. Genes Dev. 2008; ; 22 : :1753.–1757. 6. Wang RH, Li C, Deng CX. Liver steatosis and increased ChREBP expression in mice carrying a liver specific SIRT1 null mutation under a normal feeding condition . Int J Biol Sci. 2010; ; 6 : :682.–690. 7. Li S, Liu C, Li N, et al. Genome-wide coactivation analysis of PGC-1a identifies BAF60a as a regulator of hepatic lipid metabolism . Cell Metab. 2008; ; 8 : :105.–117. 8. Li X, Zhang S, Blander G, et al. SIRT1 deacetylates and positively regulates the nuclear receptor LXR . Mol Cell. 2007; ; 28 : :91.–106. 9. Kemper JK, Xiao Z, Ponugoti B, et al. FXR acetylation is normally dynamically regulated by p300 and SIRT1 but constitutively elevated in metabolic disease states . Cell Metab. 2009; ; 10 : :392.–404. 10. Walker AK, Yang F, Jiang K, et al. Conserved role of SIRT1 orthologs in fasting-dependent inhibition of the lipid/cholesterol regulator SREBP . Genes Dev. 2010; ; 24 : :1403.–1417. 11. Wang RH, Kim HS, Xiao C, et al. Hepatic Sirt1 deficiency in mice impairs mTorc2/Akt signaling and results in hyperglycemia, oxidative damage, and insulin résistance . J Clin Invest. 2011; ; 121 : :4477.–4490. 12. Schenk S, McCurdy CE, Philip A, et al. Sirt1 enhances skeletal muscle insulin sensitivity in mice during caloric restriction . J Clin Invest. 2011; ; 121 : :4281.–4288. 13. Kim HS, Xiao C, Wang RH, et al. Hepatic specific disruption of SIRT6 in mice results in fatty liver formation due to enhanced glycolysis and triglyceride synthesis . Cell Metab. 2010; ; 12 : :224.–236. 14. Herranz D, Munoz-Martin M, Canamero M, et al. Sirt1 improves healthy ageing and protects from metabolic syndrome-associated cancer . Nat Commun. 2010; ; 1 : :1.–8. 15. Bosch-Presegué, Vaquero A. The dual role of sirtuins in cancer . Genes Cancer. 2011; ; 2 : :648.–662. |