| |
| Med Sci (Paris). 2012 March; 28(3): 311–315. Published online 2012 April 6. doi: 10.1051/medsci/2012283020.L’homéostasie métabolique au cœur du vieillissement Catherine Terret1 and Florence Solari2,3,4,5* 1Centre Léon Bérard, 69000Lyon, France 2Université Lyon 1, 69000Lyon, France 3Inserm U1052, Centre de Recherche en Cancérologie de Lyon, 69000Lyon, France 4CNRS UMR5286, centre de recherche en cancérologie de Lyon, 69008Lyon, France 5Adresse actuelle : CNRS UMR 5534, Centre de Génétique et de Physiologie Moléculaire et Cellulaire, 69622Villeurbanne, France |
La longévité est déterminée par des facteurs génétiques et environnementaux Le contrôle génétique de la longévité a été révélé par les travaux pionniers de Thomas Johnson et Cynthia Kenyon au début des années 1990 [1, 2]. Ces auteurs ont en effet montré pour la première fois que la mutation d’un seul gène, age-1 ou daf-2, était suffisante pour doubler la durée de vie du nématode (→) [38]. Le gène age-1 code pour la sous-unité catalytique de la phosphatidylinositol 3-kinase (PI3K). AGE-1 agit dans la voie de signalisation de DAF-2, homologue unique chez C. elegans des récepteurs à l’insuline et à l’IGF (insulin growth factor)-1 (I/IGF1-R) de mammifères, qui jouent un rôle clé dans la régulation de la croissance et du métabolisme. Dix ans plus tard, la conservation du rôle des I/IGF1-R dans la régulation de la durée de vie a été mise en évidence chez la drosophile et la souris [3–5]. Des études ultérieures ont montré que cette voie de signalisation agissait principalement dans le système nerveux pour réguler la longévité chez le nématode [6], mais aussi chez la drosophile [7] et la souris [8]. Ces observations ont ensuite été renforcées par la mise en évidence du contrôle de la longévité par la sérine thréonine kinase TOR (target of rapamycin). TOR est un effecteur important de la voie de signalisation des I/IGF1-R, qui agit en aval de la PI3K. L’inactivation de TOR, par mutation du gène ou par un traitement à la rapamycine, allonge la durée de vie de la levure, du nématode, de la drosophile et de la souris [9]. L’activité de TOR peut aussi être modulée indépendamment du récepteur de l’I/IGF-1, en réponse à la disponibilité en nutriments. Ainsi, l’inhibition de TOR joue un rôle majeur dans l’allongement de la durée de vie en condition de restriction calorique [9]. (→) Voir l’article de A. Brunet, page 316 de ce numéro L’effet d’une restriction en nourriture sur la longévité a été décrit dès 1935 par C.M. McCay [10]. Cet auteur a rapporté que des rats soumis à un régime hypocalorique vivaient plus longtemps que des rats nourris à volonté (ad libitum). Ces travaux démontraient pour la première fois que la longévité d’un individu ne dépendait pas uniquement de son patrimoine génétique, mais qu’elle pouvait aussi être sensiblement accrue par une modification de son environnement. Les travaux ultérieurs menés chez d’autres espèces ont montré le caractère quasi universel des effets bénéfiques d’une restriction calorique sans dénutrition [11, 12], qui consiste généralement à réduire l’apport alimentaire de 30 % par rapport à la ration ad libitum [13]. Il est aussi possible d’allonger la durée de vie en modifiant l’apport en certains nutriments, notamment en modifiant le ratio des acides aminés, sans diminuer la quantité totale d’aliments ingérée [13]. Ainsi l’allongement de la durée de vie en réponse à la restriction calorique ne résulte pas d’un simple ralentissement du métabolisme lié à une réduction de l’apport en calories, mais fait intervenir une réponse dynamique relayée par des voies de signalisation spécifiques. Par exemple, l’inactivation du facteur de transcription de type FOXA, appelé PHA-4 chez C. elegans, raccourcit la durée de vie des vers soumis à une restriction calorique, mais ne modifie pas celle des vers nourris ad libitum ou des vers mutants pour daf-2 [14]. La voie de signalisation de l’I/IGF1-R serait aussi impliquée dans les effets bénéfiques de la restriction calorique chez les mammifères. En effet, la restriction calorique induit une baisse des niveaux circulants d’insuline et d’IGF-1. De plus, la suppression du gène codant pour le récepteur à l’hormone de croissance, qui engendre notamment une baisse des niveaux d’IGF-1 et d’insuline plasmatiques, augmente la durée de vie des souris, mais celles-ci ne vivent pas plus longtemps lorsqu’elles sont soumises à une restriction calorique [15]. Ainsi l’inactivation de la voie de l’I/IGF1-R et la restriction calorique pourraient affecter la durée de vie à la fois par des mécanismes communs et indépendants. En résumé, l’ensemble de ces données montre que la durée de vie peut être modulée par des voies de signalisation conservées au cours de l’évolution et impliquées dans le contrôle du métabolisme, ces modulations pouvant être de nature génétique ou environnementale. |
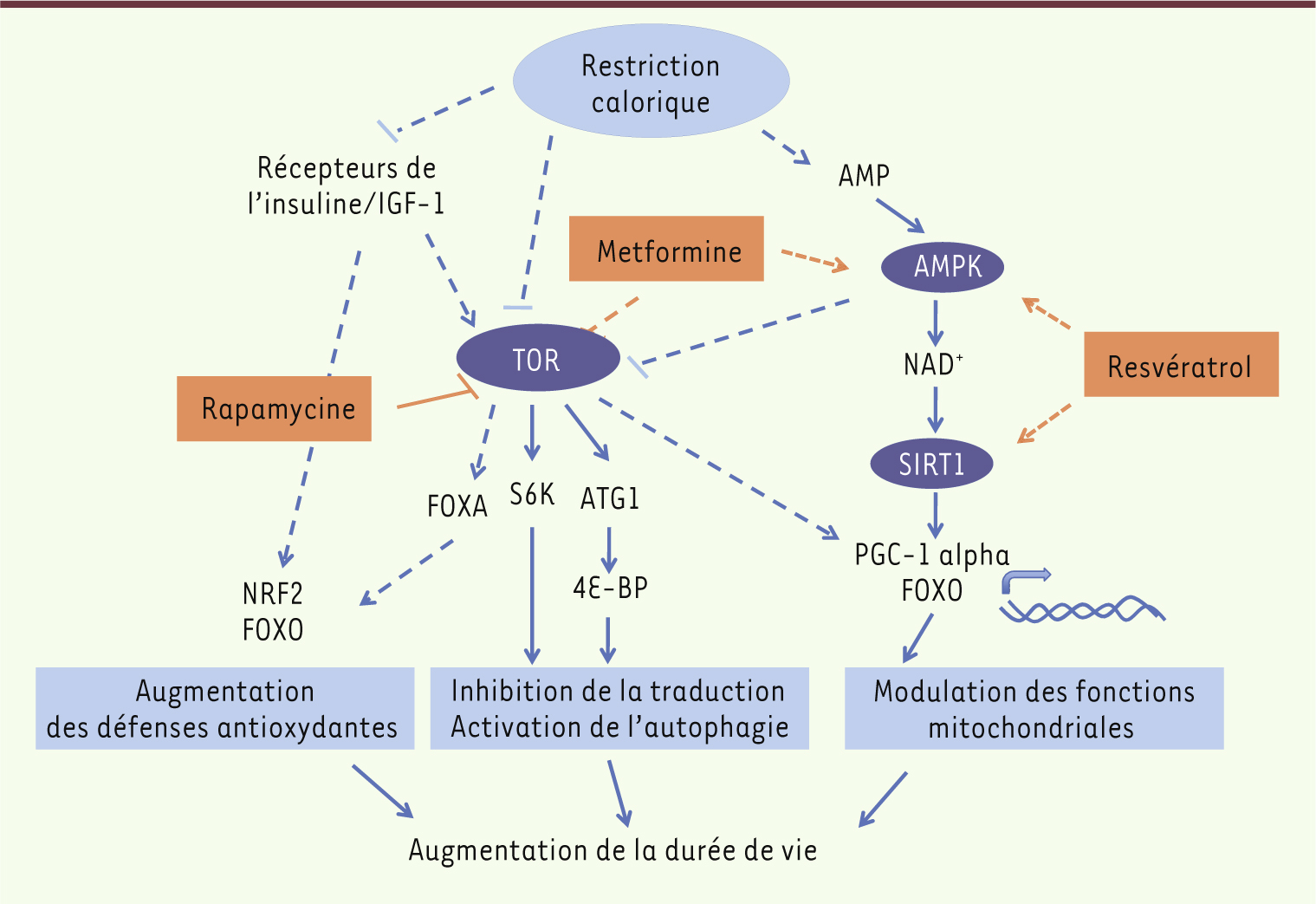
Effet de la restriction calorique sur la longévité : des gènes aux mécanismes Le vieillissement s’accompagne d’un déclin des fonctions cellulaires dû notamment à l’accumulation progressive de dommages à l’ADN, d’agrégats formés de protéines mal conformées et d’altérations des structures cellulaires qui résultent d’une exposition chronique à des stress environnementaux et endogènes. Comment la restriction calorique peut-elle protéger contre tous ces effets ? Afin de répondre à cette question, des cribles génétiques ont été réalisés pour identifier des gènes dont la mutation supprime l’allongement de la durée de vie induite par la restriction calorique. En effet, le génotype d’un individu peut aussi affecter sa réponse à une restriction calorique, pouvant abolir complètement l’allongement de la durée de vie [16]. Parmi les gènes identifiés, plusieurs codent pour des senseurs énergétiques conservés au cours de l’évolution (Figure 1) tels que l’AMP kinase (AMPK) [17] - dont l’activation dépend des niveaux d’ATP, d’AMP et d’ADP -, la déacétylase SIRT1 (sirtuine, homologue chez la levure de silent information regulator 2 [Sir2]) [18] - qui a pour cofacteur le NAD -, et la sérine thréonine kinase TOR (target of rapamycin) [19]. Ces protéines sont sensibles aux variations de nutriments et orchestrent une réponse adaptative pour ajuster le métabolisme et la réponse cellulaire aux conditions nutritionnelles. Ainsi, l’inactivation de TOR en réponse à une carence en nutriments va induire une augmentation de l’autophagie et une diminution de la traduction globale, permettant ainsi de maintenir un équilibre protéique. Cet effet permettrait de prévenir l’accumulation de protéines altérées qui résulte notamment d’une baisse de l’activité d’autophagie au cours du vieillissement [20]. Par ailleurs les protéines TOR, AMPK et SIRT1 sont capables d’activer PGC-1 alpha (peroxisome proliferator-activated receptor-γ coactivator), un cofacteur de différents récepteurs hormonaux nucléaires et autres facteurs de transcription qui est impliqué dans la biogenèse et l’activité mitochondriale [21]. La modification des mitochondries permettrait de réduire la quantité de radicaux libres générés qui, en combinaison avec la modification de l’activité d’enzymes de détoxication, telles que les superoxyde dismutases [22], confèrerait ainsi à l’organisme une protection contre le stress oxydant.
 | Figure 1.
Principaux effecteurs de la restriction calorique impliqués dans la régulation de la durée de vie. Ce schéma donne une représentation simplifiée des voies de signalisation mises en jeu. Les lignes pointillées représentent des interactions indirectes. Seuls certains des effecteurs majeurs, pour lesquels il existe des évidences directes en faveur de leur rôle dans la longévité, sont mentionnés. Ces voies de signalisation peuvent être modulées, d’une part avec la rapamycine qui inhibe TOR, et d’autre part avec la metformine et le resvératrol (dont les cibles directes restent encore discutées). |
Par ailleurs, des mutations dans les facteurs de transcription FOXA⁄PHA-4 [14], NRF2⁄SKN-1 [23], FOXO⁄DAF-16 [17], HSF1⁄HSF-1 (heat shock factor protein 1) [24] et HIF1/HIF-1 (hypoxia-inducible factor 1) [25] suppriment aussi les effets de différents protocoles de restriction calorique sur la longévité chez C. elegans. À l’heure actuelle, les interactions entre les différents effecteurs, les tissus dans lesquels ils fonctionnent et leur lien avec les modifications métaboliques au cours de la réponse à la restriction calorique ne sont pas totalement élucidés. Cependant, une caractéristique commune à tous ces effecteurs est leur implication dans la(les) réponse(s) cellulaire(s) à différents stress (protéique, oxydant, hypoxique, etc.), depuis leur détection jusqu’à la mise en place d’un programme de transcription et de modifications post-traductionnelles permettant à la cellule de s’y adapter. |
Restriction calorique et cancer La restriction calorique réduit aussi l’incidence du cancer. Des travaux publiés dès les années 1980 décrivaient que des souris soumises à une restriction calorique montraient non seulement un allongement de leur durée de vie mais aussi une réduction de 50 % de l’incidence des cancers spontanés [26]. Plus récemment, une étude longitudinale ayant duré 20 ans chez des singes Rhésus a rapporté des résultats similaires [11]. Les mécanismes moléculaires et cellulaires mis en jeu dans l’inhibition de la croissance tumorale sont encore inconnus. Cependant les travaux récents réalisés au sein de notre laboratoire ouvrent des pistes intéressantes. |
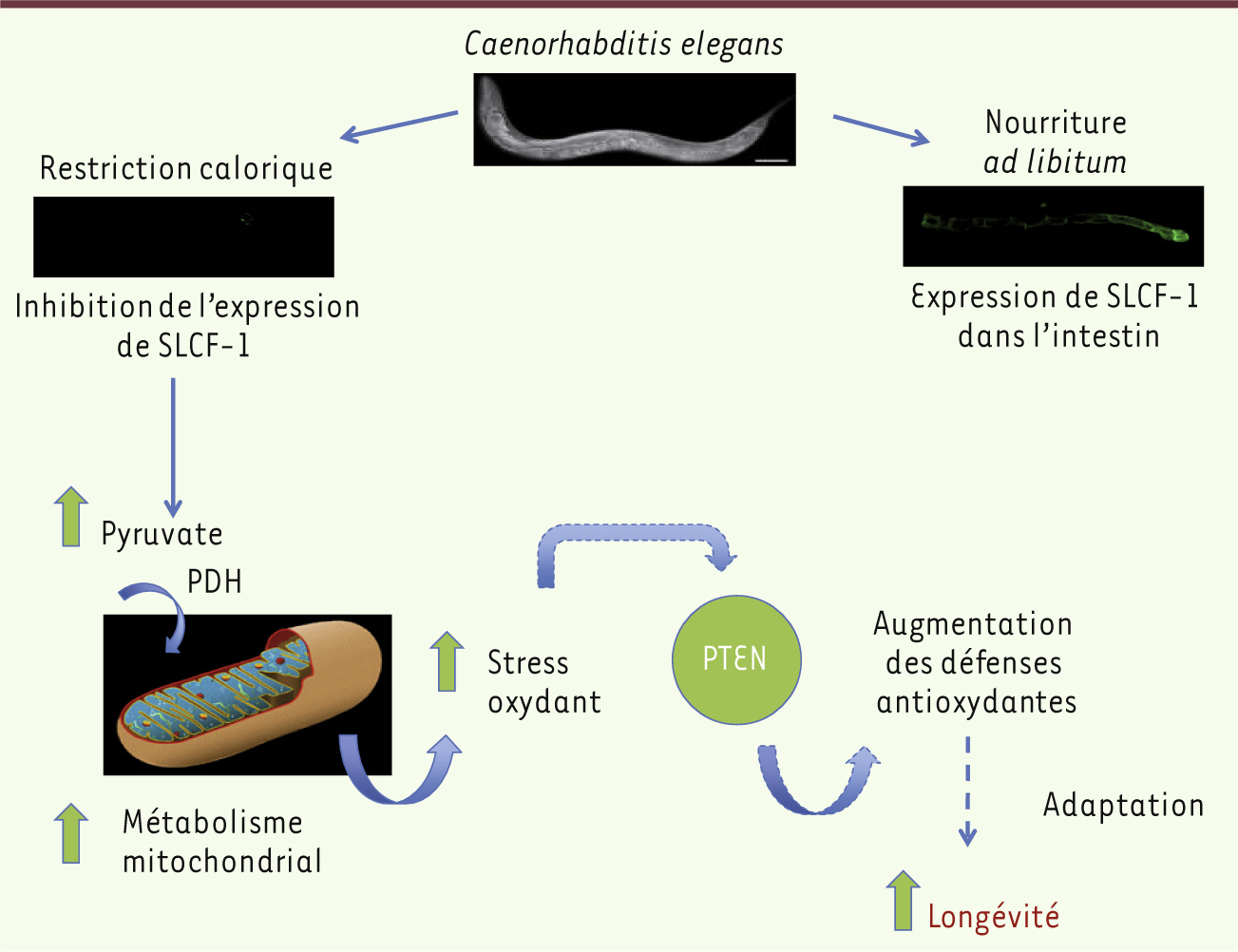
Le gène slcf-1, un nouvel acteur de l’allongement de la durée de vie de C. elegansAfin d’examiner le lien entre cancer et vieillissement au sein d’un organisme entier, notre équipe étudie depuis plusieurs années le rôle de la phosphatase PTEN (phosphatase and tensin homolog) dans la régulation de la durée de vie de C. elegans. PTEN est le deuxième gène le plus fréquemment muté, après p53, dans les tumeurs solides humaines. Nos travaux ont permis de montrer que les domaines de régulation de la protéine PTEN, qui sont importants pour son rôle dans la tumorigenèse, sont aussi impliqués dans la modulation de la longévité chez C. elegans [27]. La régulation de la durée de vie par PTEN fait intervenir notamment la régulation négative de la voie de signalisation des I/IGF1-R mais aussi, de façon indépendante, son interaction fonctionnelle avec P53, FOXO et la sérine thréonine kinase SMG-1 [28]. Nos travaux ont par ailleurs révélé l’implication de PTEN dans l’allongement de la durée de vie en réponse à la restriction calorique. En effet, un crible visant à identifier les autres voies contrôlées par PTEN qui interviennent dans l’allongement de la durée de vie nous a permis d’identifier un nouvel acteur de ce processus, le gène slcf-1 qui code pour un transporteur putatif de pyruvate. L’expression de slcf-1 est inactivée lorsque des vers sauvages sont soumis à une restriction calorique et sa mutation augmente la durée de vie moyenne des vers de 40 % en mimant les effets de la restriction calorique alors que les vers mutants ont un régime ad libitum [29]. Nous avons observé que les mutants slcf-1, malgré leur longévité augmentée, montrent une accumulation de peroxyde d’hydrogène au stade jeune adulte et une sensibilité accrue à un stress oxydant exogène. Qui plus est, un traitement avec un antioxydant supprime l’allongement de leur durée de vie ! Cependant, à un âge plus avancé, les mutants slcf-1 deviennent plus résistants au stress que les vers sauvages. Finalement, des études plus poussées ont révélé que l’allongement de la durée de vie induite par la restriction calorique fait intervenir un stress modéré générant une réponse adaptative qui, in fine, rend les vers plus résistants au stress oxydant. Nos résultats révèlent un changement du métabolisme mitochondrial au cours de cette adaptation et l’implication de l’axe PTEN/TOR, mais aussi celle d’autres effecteurs intervenant au cours de la restriction calorique et évoqués précédemment [29 et données non publiées] (Figure 2). De façon très intéressante, PTEN est aussi impliquée dans la régulation de la croissance tumorale en réponse à la restriction calorique chez la souris [30]. Ainsi les mécanismes que nous avons décrits chez C. elegans s’appliquent-ils probablement aux mammifères.
 | Figure 2.
L’effet de la restriction calorique sur la longévité dépend d’une réponse adaptative à un stress modéré qui requiert la protéine oncosuppressive PTEN. La limitation de l’apport alimentaire provoque l’inhibition de l’expression du transporteur SLCF-1 dans les cellules intestinales, entraînant une augmentation du niveau de pyruvate. Ce haut niveau de pyruvate est associé à une activation constitutive de la pyruvate déshydrogénase (PDH) qui régule le flux de pyruvate entrant dans la mitochondrie. Le métabolisme mitochondrial est augmenté, provoquant l’accumulation de radicaux libres. Ce stress oxydant modéré induit une réponse adaptative dite « hormétique » à l’origine d’une meilleure résistance des vers et une augmentation de leur longévité. La protéine oncosuppressive PTEN est essentielle pour la mise en place de cette réponse. |
|
Effets de la restriction calorique sur l’inhibition du développement tumoral : quelques hypothèses Cependant, ces résultats ont été obtenus dans un organisme entier et il sera important par la suite de déterminer si les différents effecteurs agissent de façon tissu-spécifique et/ou s’ils font intervenir des signaux secondaires de tissus à tissus. De la même façon, on peut s’interroger sur les effets de la restriction calorique sur l’inhibition du développement tumoral : s’agit-il d’un effet direct sur les cellules tumorales et/ou d’un effet systémique à l’échelle de l’organisme ? Nos résultats montrant qu’un stress oxydant modéré accompagne la restriction calorique suggèrent l’hypothèse d’un effet direct. La cellule cancéreuse ne pourrait pas s’adapter à cette situation nutritionnelle car elle doit déjà faire face à des conditions de stress extrême. En effet, on sait qu’une des caractéristiques des cellules cancéreuses, comparées aux cellules normales, est la persistance d’un état pro-oxydant qui peut engendrer un stress oxydant endogène [31]. En effet, les cellules cancéreuses ont une activité métabolique augmentée et ont des besoins élevés en nucléotides, lipides, acides aminés nécessaires pour maintenir une croissance cellulaire et une prolifération très actives. En présence d’une demande forte et rapide en énergie, une reprogrammation métabolique est nécessaire. Contrairement à la cellule normale différenciée dont l’énergie provient principalement des phosphorylations oxydatives mitochondriales, la plupart des cellules cancéreuses utilisent la glycolyse, même en présence d’oxygène (glycolyse aérobie). On parle d’« effet Warburg » en référence à Otto Warburg qui a décrit ce phénomène pour la première fois en 1924. Bien que la glycolyse produise moins d’ATP, cette voie métabolique faciliterait l’incorporation d’éléments nécessaires au renouvellement cellulaire. Au lieu d’entrer dans la mitochondrie pour y être transformé en acétyl-coenzyme A par la PDH (pyruvate déshydrogénase), lors de l’effet Warburg le pyruvate est préférentiellement transformé en lactate par la LDH (lactate déshydrogénase) cytoplasmique. Nos résultats montrent qu’une augmentation du flux de pyruvate au travers de la mitochondrie est nécessaire au processus d’adaptation à la restriction calorique. Cette dernière pourrait ainsi entraîner la mort des cellules cancéreuses, en inhibant leur reprogrammation métabolique. Ces observations sont donc en faveur d’un effet direct de la restriction calorique sur la cellule tumorale. Toutefois, l’utilisation de la glycolyse par les cellules cancéreuses entraîne une augmentation significative des besoins en glucose. La restriction calorique pourrait aussi agir sur la tumeur via une action systémique en réduisant le taux de glucose sanguin et en entraînant ainsi une diminution du glucose disponible pour la tumeur, ce qui « l’affamerait ». |
Cibler le métabolisme pour soigner les pathologies associées à l’âge ? Chez l’homme comme chez le rat, la restriction calorique réduit différents marqueurs cliniques associés au cancer [32]. Cependant, son efficacité dans la prévention du cancer chez l’homme reste encore à prouver. Il faut de plus rester prudent, car un régime alimentaire trop drastique ou mal adapté peut aussi entraîner des effets délétères. Mais des médicaments qui miment tout ou partie des effets bénéfiques de la restriction calorique [33] ont déjà fait leur preuve dans le traitement des pathologies associées à l’âge. Des dérivés de la rapamycine, un inhibiteur de TOR (Figure 1) sont prescrits dans le traitement de certains cancers [34, 39]. La metformine (Figure 1) quant à elle est utilisée depuis de nombreuses années dans le traitement du diabète de type II. De façon intéressante, des études épidémiologiques ont montré une réduction de l’incidence des cancers chez les patients traités par la metformine1 [40], et des essais cliniques testent actuellement son efficacité potentielle dans le traitement de différents cancers [35]. De plus, un autre médicament antidiabétique a aussi montré un effet bénéfique dans des modèles d’autres pathologies associées à l’âge telles que la maladie d’Alzheimer [36]. L’impact du métabolisme du glucose sur les maladies neurodégénératives est notamment illustré par des travaux réalisés chez la souris dans des modèles d’agrégation protéique [37]. En conclusion, le vieillissement de la population s’accompagne de l’augmentation de l’incidence du diabète de type II, des maladies neurodégénératives et des cancers. Ces événements suggèrent que l’émergence et l’évolution de ces maladies partagent des mécanismes communs avec le vieillissement. Les observations rassemblées dans cette revue suggèrent que le métabolisme est au cœur de ces mécanismes. Dès lors se pose la question du rôle du « terrain métabolique » dans le développement des pathologies du sujet âgé et, au-delà, de la place d’approches thérapeutiques complémentaires à celles qui ciblent les organes lésés qui permettraient une meilleure prise en charge globale du patient âgé. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. Johnson TE. Increased life-span of age-1 mutants in Caenorhabditis elegans and lower Gompertz rate of aging . Science. 1990; ; 249 : :908.–912. 2. Kenyon C, Chang J, Gensch E, et al. A C. elegans mutant that lives twice as long as wild type . Nature. 1993; ; 366 : :461.–464. 3. Blüher M, Kahn BB, Kahn CR. Extended longevity in mice lacking the insulin receptor in adipose tissue . Science. 2003; ; 299 : :572.–574. 4. Holzenberger M, Dupont J, Ducos B, et al. IGF-1 receptor regulates lifespan and resistance to oxidative stress in mice . Nature. 2003; ; 421 : :182.–187. 5. Garofalo RS. Genetic analysis of insulin signaling in Drosophila . Trends Endocrinol Metab. 2002; ; 13 : :156.–162. 6. Wolkow CA, Kimura KD, Lee MS, Ruvkun G. Regulation of C. elegans life-span by insulinlike signaling in the nervous system . Science. 2000; ; 290 : :147.–150. 7. Hwangbo DS, Gershman B, Gersham B, et al. Drosophila dFOXO controls lifespan and regulates insulin signalling in brain and fat body . Nature. 2004; ; 429 : :562.–566. 8. Kappeler L, De Magalhaes Filho C, Dupont J, et al. Brain IGF-1 receptors control mammalian growth and lifespan through a neuroendocrine mechanism . PLoS Biol. 2008; ; 6 : :e254.. 9. Kapahi P, Chen D, Rogers AN, et al. With TOR, less is more: a key role for the conserved nutrient-sensing TOR pathway in aging . Cell Metab. 2010; ; 11 : :453.–465. 10. McCay CM, Maynard LA. The effect of retarded growth upon the length of life span and upon the ultimate body size . Nutrition. 1935; ; 5 : :155.–172. 11. Colman RJ, Anderson RM, Johnson SC, et al. Caloric Restriction delays disease onset and mortality in Rhesus monkeys . Science. 2009; ; 325 : :201.–204. 12. Mair W, Dillin A. Aging and survival: the genetics of life span extension by dietary restriction . Annu Rev Biochem. 2008; ; 77 : :727.–754. 13. Piper MDW, Bartke A. Diet and aging . Cell Metab. 2008; ; 8 : :99.–104. 14. Panowski SH, Wolff S, Aguilaniu H, et al. PHA-4/Foxa mediates diet-restriction-induced longevity of C. elegans . Nature. 2007; ; 447 : :550.–555. 15. Bonkowski MS, Rocha JS, Masternak MM, et al. Targeted disruption of growth hormone receptor interferes with the beneficial actions of calorie restriction . Proc Natl Acad Sci USA. 2006; ; 103 : :7901.–7905. 16. Liao CY, Rikke BA, Johnson TE, et al. Genetic variation in the murine lifespan response to dietary restriction: from life extension to life shortening . Aging Cell. ; 9 : :92.–95. 17. Greer EL, Dowlatshahi D, Banko MR, et al. An AMPK-FOXO pathway mediates longevity induced by a novel method of dietary restriction in C. elegans . Curr Biol. 2007; ; 17 : :1646.–1656. 18. Bordone L, Cohen D, Robinson A, et al. SIRT1 transgenic mice show phenotypes resembling calorie restriction . Aging Cell. 2007; ; 6 : :759.–767. 19. Harrison DE, Strong R, Sharp ZD, et al. Rapamycin fed late in life extends lifespan in genetically heterogeneous mice . Nature. 2009; ; 460 : :392.–395. 20. Cuervo AM, Wong ES, Martinez-Vicente M. Protein degradation, aggregation, and misfolding . Mov Disord. 2010; ; 25 : (suppl 1) : :S49.–S54. 21. Lopez-Lluch G, Hunt N, Jones B, et al. Calorie restriction induces mitochondrial biogenesis and bioenergetic efficiency . Proc Natl Acad Sci USA. 2006; ; 103 : :1768.–1773. 22. Qiu X, Brown K, Hirschey MD, et al. Calorie restriction reduces oxidative stress by SIRT3-mediated SOD2 activation . Cell Metab. 2010; ; 12 : :662.–667. 23. Bishop NA, Guarente L. Two neurons mediate diet-restriction-induced longevity in C. elegans . Nature. 2007; ; 447 : :545.–549. 24. Steinkraus KA, Smith ED, Davis C, et al. Dietary restriction suppresses proteotoxicity and enhances longevity by an hsf-1-dependent mechanism in Caenorhabditis elegans . Aging Cell. 2008; ; 7 : :394.–404. 25. Chen D, Thomas EL, Kapahi P. HIF-1 modulates dietary restriction-mediated lifespan extension via IRE-1 in Caenorhabditis elegans . PLoS Genet. 2009; ; 5 : :e1000486.. 26. Weindruch R, Walford RL. Dietary restriction in mice beginning at 1 year of age: effect on life-span and spontaneous cancer incidence . Science. 1982; ; 215 : :1415.–1418. 27. Solari F, Bourbon-Piffaut A, Masse I, et al. The human tumour suppressor PTEN regulates longevity and dauer formation in Caenorhabditis elegans . Oncogene. 2005; ; 24 : :20.–27. 28. Masse I, Molin L, Mouchiroud L, et al. A novel role for the SMG-1 kinase in lifespan and oxidative stress resistance in Caenorhabditis elegans . PLoS One. 2008; ; 3 : :e3354.. 29. Mouchiroud L, Molin L, Kasturi P, et al. Pyruvate imbalance mediates metabolic reprogramming and mimics lifespan extension by dietary restriction in Caenorhabditis elegans . Aging Cell. 2011; ; 10 : :39.–54. 30. Kalaany NY, Sabatini DM. Tumours with PI3K activation are resistant to dietary restriction . Nature. 2009; ; 458 : :725.–731. 31. Pelicano H, Carney D, Huang P. ROS stress in cancer cells and therapeutic implications . Drug Resist Updat. 2004; ; 7 : :97.–110. 32. Fontana L, Partridge L, Longo VD. Extending healthy life span: from yeast to humans . Science. 2010; ; 328 : :321.–326. 33. Mouchiroud L, Molin L, Dalliere N, Solari F. Life span extension by resveratrol, rapamycin, and metformin: the promise of dietary restriction mimetics for an healthy aging . Biofactors. 2010; ; 36 : :377.–382. 34. Zask A, Verheijen JC, Richard DJ. Recent advances in the discovery of small-molecule ATP competitive mTOR inhibitors: a patent review . Expert Opin Ther Pat. 2011; ; 21 : :1109.–1127. 35. Belda-Iniesta C, Pernia O, Simo R. Metformin: a new option in cancer treatment . Clin Transl Oncol. 2011; ; 13 : :363.–367. 36. McClean PL, Parthsarathy V, Faivre E, Holscher C. The diabetes drug liraglutide prevents degenerative processes in a mouse model of Alzheimer’s disease . J Neurosci. 2011; ; 31 : :6587.–6594. 37. Cohen E, Paulsson JF, Blinder P, et al. Reduced IGF-1 signaling delays age-associated proteotoxicity in mice . Cell. 2009; ; 139 : :1157.–1169. 38. Brunet A. Bien vieillir : la voie de signalisation insuline-FOXO et la longévité . Med Sci (Paris). 2012; ; 28 : :316.–320. 39. Pallet N, Beaune P, Thervet E, Legendre C, Anglicheau D. Inhibiteurs des mTOR : des antiprolifératifs pléiotropiques . Med Sci (Paris). 2006; ; 22 : :947.–952. 40. Foretz M, Guigas B, Viollet B. Du cancer au traitement du diabète : le suppresseur de tumeur LKB1 comme nouvelle cible pharmacologique . Med Sci (Paris). 2006; ; 22 : :348.–350. |