| |
| Med Sci (Paris). 2012 April; 28(4): 370–372. Published online 2012 April 25. doi: 10.1051/medsci/2012284013.Contribution de cellules ES au chimérisme post-natal Échec chez le singe Laure Coulombel1* 1médecine/sciences, 2, rue d’Alésia, 75014Paris, France MeSH keywords: Animaux, Animaux nouveau-nés, Blastocyste, métabolisme, physiologie, Différenciation cellulaire, génétique, Chimère, croissance et développement, Cellules souches embryonnaires, Femelle, Humains, Macaca mulatta, Souris, Modèles biologiques |
Classiquement, une définition stricte de la pluripotence d’une cellule implique qu’elle puisse contribuer in vivo à des chimères post-natales. Cela signifie que des cellules greffées dans un embryon préimplantatoire hôte ensuite transféré dans l’utérus d’une femelle pseudogestante, contribueront - au même titre que les cellules endogènes de l’embryon-hôte - aux tissus des animaux qui naîtront, y compris à la lignée germinale [1]. On sait depuis longtemps que les cellules souches embryonnaires (CSE) dérivées de la masse interne de blastocystes de souris - et maintenant de rats comme nous l’écrivait récemment M. Cohen-Tannoudji [2] - ont cette capacité, qui caractérise aussi les cellules iPS (induced pluripotent stem cells) [1, 3]. CSE et iPS sont aussi capables de former à elles seules des embryons viables, par complémentation tétraploïde, comme nous l’avons déjà discuté dans ces colonnes [1]. Mais ces tests de pluripotence in vivo ne sont évidemment pas applicables à des CSE et iPS humaines. Plusieurs arguments moléculaires et fonctionnels suggèrent que le potentiel de ces dernières serait plus proche de celui de cellules pluripotentes murines de type EpiSC, dérivées de l’épiblaste de blastocystes tardifs, et dont la capacité de participer à des chimères post-natales - en particulier à la lignée germinale - est déjà très restreinte [4]. L’équipe de Shoukhrat Mitalipov, du centre de primatologie de l’Orégon (États-Unis), apporte un argument de poids à cette hypothèse en montrant l’incapacité de CSE de singes Rhésus de contribuer à des chimères post-natales après leur injection dans des blastocystes de primates [5]. Cette équipe est une des seules au monde capables de manipulations embryonnaires de ce type chez le primate non humain : elle a précédemment obtenu des lignées de CSE après transfert de noyaux somatiques dans des ovocytes de singes (sans toutefois obtenir de naissances après transfert in utero de ces embryons), et, plus récemment, a décrit - toujours chez le singe - une approche de transfert nucléaire thérapeutique dans les maladies mitochondriales dont nous nous sommes fait l’écho [6]. |
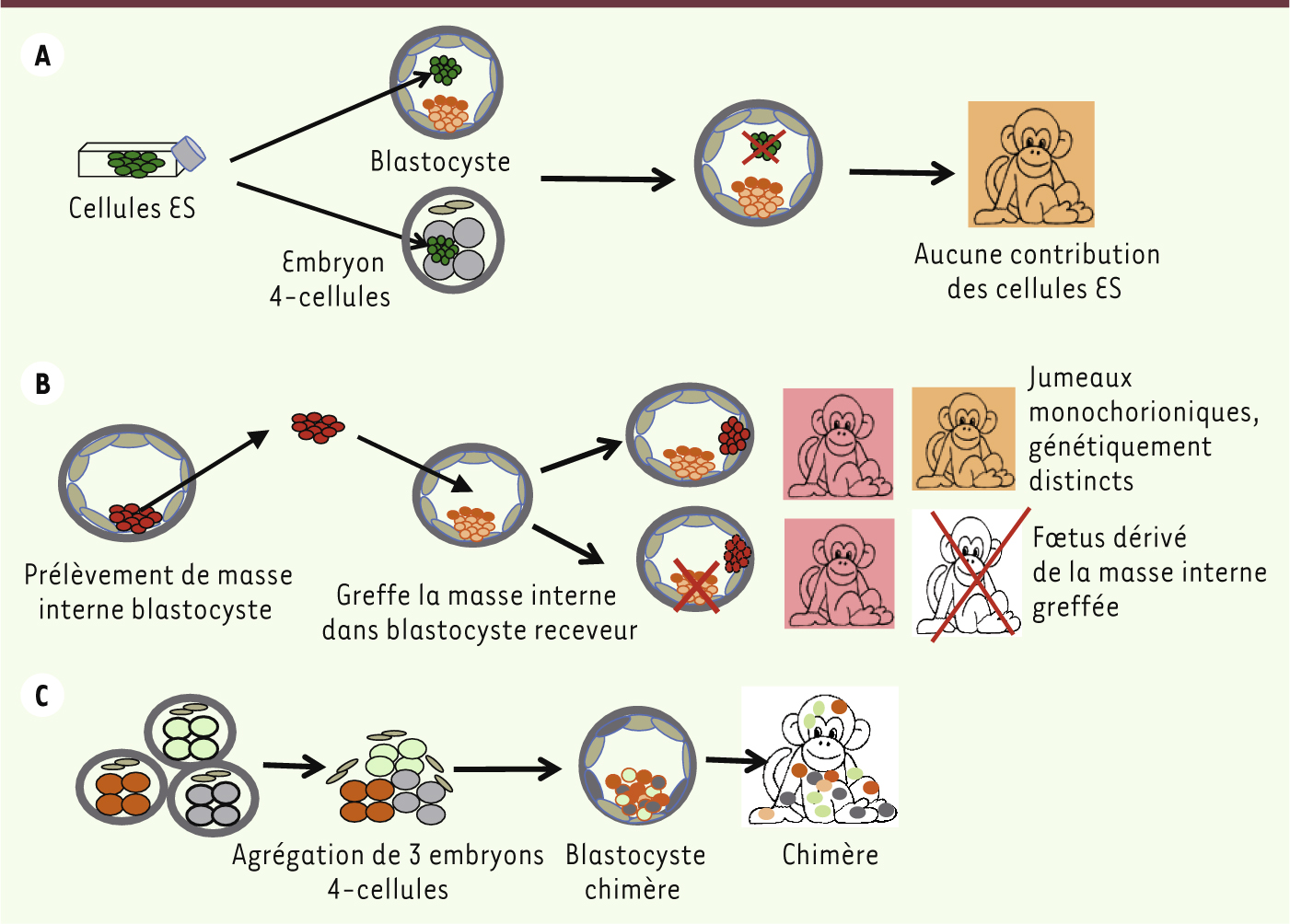
Échec de l’intégration de CSE dans des blastocystes hôtes Dans une première approche, les auteurs ont appliqué la technique utilisée chez la souris et injecté 20 à 30 CSE dissociées dans un blastocyste hôte, jouxtant la masse interne. Vingt-six blastocystes ainsi traités ont été transférés dans l’utérus de sept femelles. Quatre grossesses ont été obtenues, mais aucun des sept embryons analysés à mi-gestation n’exprimait de chimérisme. De même, aucune contribution des CSE de singes aux fœtus n’a été détectée après l’injection des CSE dans des embryons de 4-cellules, à un stade précédant le stade blastocyste (Figure 1A)
 | Figure 1. Stratégies expérimentales utilisées par l’équipe de S. Mitalipov pour obtenir des singes chimères à partir de cellules embryonnaires. A. Des CSE dérivée de la masse interne de blastocystes sont injectées dans un blastocyste singe hôte, ou dans un embryon 4-cellules, et les blastocystes sont ensuite transférés dans l’utérus de femelles. Les fœtus ont été analysés à mi-gestation. Aucune chimérisme n’a été observé. B. La masse interne complète prélevée sur des blastocystes a été implantée dans des blastocystes hôtes, ensuite transférés dans l’utérus de femelles. Parmi les 3 fœtus analysés, deux provenaient du développement de la masse interne greffée. C. La seule stratégie résultant en un taux de chimérisme important consiste à agréger plusieurs embryons 4-cellules, ce qui aboutit à la formation de blastocystes qui peuvent être transférés dans l’utérus de femelles, et poursuivre leur développement jusqu’à la naissance de singes viables. |
La dissociation des cellules pouvait être en cause : on sait que si les CSE murines la tolèrent, tel n’est pas le cas des CSE humaines. Pour tester ce paramètre, les auteurs ont donc injecté, sans les dissocier, les masses internes prélevées sur des blastocystes dans 44 blastocystes hôtes transférés ensuite chez 11 femelles. Trois furent enceintes : l’une d’entre elles portait des jumeaux monochorioniques mais non chimériques, correspondant au développement séparé des deux masses internes, celle de l’hôte et celle du donneur (Figure 1B). Un chimérisme était présent seulement dans le foie et la rate des jumeaux et témoignait probablement de l’échange de cellules lors des anastomoses vasculaires, mais pas d’un vrai chimérisme. Cela démontre certes la réceptivité de l’embryon hôte et la « pluripotence » globale de la masse interne, mais pas celle des cellules individuelles qui la composent (dont dérivent les CSE). Il faut souligner que c’est la première fois qu’un individu viable est obtenu à partir de la greffe d’une masse interne non dissociée dans un blastocyste. Autre explication possible de l’échec : le stade de maturation trop tardif des CSE. Pour le tester, les auteurs ont remplacé deux blastomères d’un embryon 4-cellules par deux blastomères d’un autre embryon. Des 29 embryons 4-cellules obtenus, 19 ont atteint le stade blastocyste et 10 contenaient un nombre normal de cellules, suggérant un chimérisme qui n’a pas été prouvé en l’absence de marqueur distinctif. Finalement, un chimérisme clair et net a été observé après agrégation de multiples embryons pris très précocement - 3 à 6 embryons de 4 à 6-cellules pour chaque test - bien avant l’individualisation de la masse interne (Figure 1C). Vingtneuf embryons chimériques ont été obtenus, et 14 de ces blastocystes chimériques ont été transplantés chez cinq femelles receveuses. Toutes ont été enceintes : la grossesse a été terminée par les chercheurs avant terme chez trois d’entre elles, et l’analyse des fœtus a confirmé le chimérisme de tous les tissus y compris de la lignée germinale. Les deux autres femelles ont donné naissance à Roku et Hex (jumeaux) et à Chimero, trois singes normaux et également chimériques. |
Différences d’incorporation des CSE dans un blastocyste hôte chez la souris ou le singe : quelles hypothèses ? Si ces résultats confirment la différence entre les systèmes du singe Rhésus (et probablement de l’homme) et de souris, l’histoire ne dit pas pourquoi les CSE de Rhésus ne contribuent pas au développement embryonnaire : incompétence des CSE, non-permissivité de l’embryon hôte ou autre facteur de restriction sans aucun rapport avec le potentiel des cellules et qui, s’il était identifié, pourrait être contourné. Les auteurs formulent au moins deux hypothèses : Les blastocystes hôtes, comme les CSE injectées, sont peut-être au-delà de la fenêtre de permissivité propice à l’établissement du chimérisme. La compétence des CSE de primates (et d’homme) reflète en effet l’état de maturation de la masse interne dont elles sont issues. Or, l’analyse fine des masses internes des blastocystes hôtes a révèlé qu’à ce stade, une organisation en deux feuillets distincts, épiblaste et endoderme primitif, est déjà décelable. Cette ségrégation en 2 feuillets s’oppose peut-être à l’incorporation de CSE immatures étrangères. Rappelons que chez la souris, cette ségrégation apparaît au jour 4,5, mais que la greffe de CSE est faite au jour 3,5 ; plus tard, elle est inefficace. D’autre part, les auteurs démontrent, en suivant grâce à un traceur les CSE injectées dans les embryons 4-cellules, qu’elles se différencient très rapidement et certainement avant d’avoir pu s’intégrer sous une forme encore immature pluripotente dans les embryons 4-cellules. Il faut cependant remarquer que les CSE de singes Rhésus ont tous les autres attributs de la pluripotence : formation de tératomes, production de cellules différenciées fonctionnelles de multiples tissus in vitro (comme nous l’avons décrit à propos des travaux de M. Pucéat et P. Ménasché [7]), signature moléculaire. Est-ce que des CSE dérivées non pas de la masse interne, mais de blastomères (embryons 4-8 cellules) d’embryons de singes pourraient, elles, contribuer in vivo à des chimères ? Cela vaut peut-être d’être testé. Pourrait-on aussi, par un artifice de culture, induire un état plus « naïf » dans ces CSE qui élargirait leur potentiel in vivo, comme cela a été décrit pour les EpiSC de la souris que l’on peut convertir en CSE naïves [8] ? Comme dans beaucoup de domaines, la souris - modèle d’étude « extra-ordinaire » - ne refléte que très mal la réalité de l’embryologie et de la physiologie humaines ou des primates non humains. Important, à l’heure des discussions éthiques et de la thérapie cellulaire. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Coulombel L. Pluripotence : une définition à géométrie variable . Med Sci (Paris). 2009; ; 25 : :798.–801. 2. Cohen-Tannoudji M, Guénet JL. Une nouvelle ère pour la génétique du rat . Med Sci (Paris). 2011; ; 27 : :387.–390. 3. Coulombel L. Reprogrammation nucléaire d’une cellule différenciée : on efface tout et on recommence . Med Sci (Paris). 2007; ; 23 : :667.–670. 4. Brons IG, Smithers LE, Trotter MW, et al. Derivation of pluripotent epiblast stem cells from mammalian embryos . Nature. 2007; ; 448 : :191.–195. 5. Tachibana M, Sparman M, Ramsey C, et al. Generation of chimeric Rhesus monkeys . Cell. 2012; ; 148 : :1.–11. 6. Häfner S, Coulombel L. Naissance de Mito et Tracker : prélude à la correction des mutations de l’ADN mitochondrial chez l’homme ? Med Sci (Paris). 2009; ; 25 : :802.–803. 7. Coulombel L. Coup de cœur pour un progéniteur multipotent mésodermique dérivé de cellules souches embryonnaires humaines . Med Sci (Paris). 2010; ; 26 : :439.–441. 8. Nichols J, Smith A. Naive and primed pluripotent states . Cell Stem Cell. 2009; ; 4 : :487.–492. |