| |
| Med Sci (Paris). 2012 April; 28(4): 388–394. Published online 2012 April 25. doi: 10.1051/medsci/2012284016.Le virus de la rougeole Un futur traitement en cancérologie ? Yann Touchefeu,1,2* Ulrike Schick,1 and Kevin J. Harrington1 1The Institute of cancer research, division of cancer biology, targeted therapy laboratory, 237 Fulham road, LondonSW3 6JB, Royaume Uni 2Institut des maladies de l’appareil digestif, Inserm U948, centre hospitalo-universitaire de Nantes, 1, place Alexis Ricordeau, 44093Nantes Cedex 1, France |
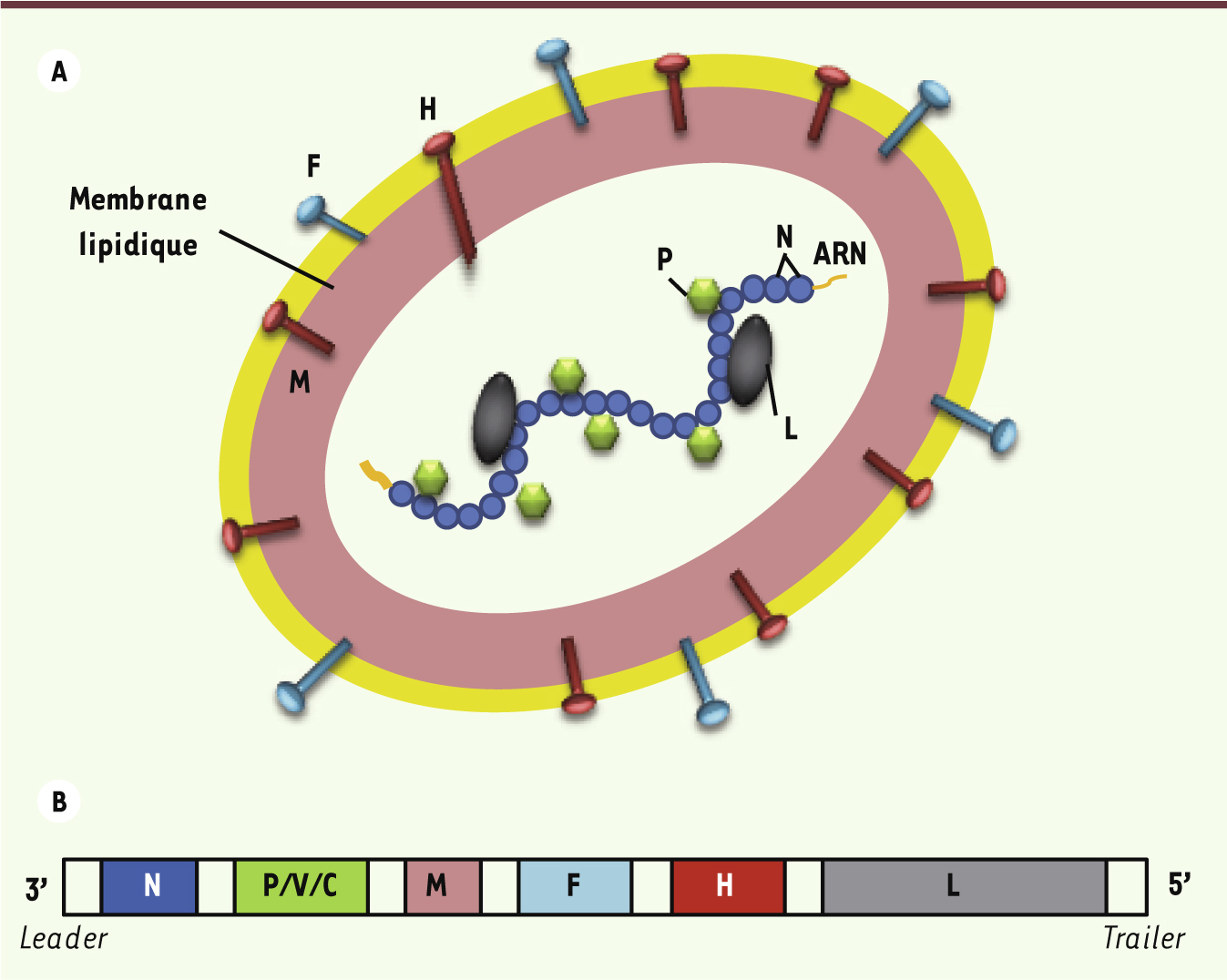
La rougeole est une maladie le plus souvent bénigne mais dont les complications peuvent être mortelles. Sont particulièrement redoutées l’encéphalite postvirale et les complications infectieuses liées à l’immunosuppression induite par le virus. Ces complications justifient une stratégie vaccinale visant à l’éradication du virus. Grâce aux programmes mondiaux de vaccination de l’organisation mondiale de la santé (OMS) et de the United Nations children’s fund (UNICEF), le nombre estimé de décès attribués au virus de la rougeole a diminué de 733 000 en 2000 à 164 000 en 2008. Ces décès surviennent très majoritairement dans les pays pauvres à faible couverture vaccinale [1]. En France, depuis 2008, sévit une épidémie de rougeole, et la nécessité d’une couverture vaccinale optimale pour protéger l’ensemble de la population doit être réaffirmée. Le premier isolat viral a été identifié en 1954 chez un patient, David Edmonston [2]. Plusieurs passages en culture de ce virus d’Edmonston dans différentes lignées cellulaires ont entraîné un glissement génétique du virus permettant d’isoler des souches dont le pouvoir pathogène est atténué, utilisables dans la préparation de vaccins. Les vaccins utilisés depuis les années 1960 contre la rougeole sont des vaccins vivants atténués. Le vaccin est sûr, efficace et très bon marché. Le virus de la rougeole est un morbillivirus de la famille des paramyxoviridae. C’est un virus enveloppé à ARN simple brin de polarité négative dont le diamètre est compris entre 150 et 350 nm. Le génome contient 15 894 nucléotides, 6 gènes (N, P, M, F, H, L) codant pour 8 protéines (N, P, M, F, H, L, V, C). Le gène P code pour la phosphoprotéine P et deux autres protéines non structurales (V et C) via un processus d’édition de l’ARN et un cadre de lecture alternatif. L’organisation du virus est illustrée dans la Figure 1. Les protéines H, F et M sont des protéines membranaires. La protéine F est une protéine de fusion enchâssée dans la membrane lipidique. La glycoprotéine H (hémagglutinine) est transmembranaire et responsable de l’attachement du virus à l’un des trois récepteurs cellulaires connus : les clusters de différenciation CD150 et CD46, et la molécule d’adhésion cellulaire nectine-4 [3, 4, 40] (→). Après fixation de la protéine H à l’un de ses récepteurs, la protéine F change de conformation et engage la fusion à pH neutre de la membrane virale avec la membrane cellulaire. La membrane virale est tapissée à sa face interne par une matrice constituée de protéine M. Les protéines N, P et L sont les protéines de la capside nucléaire. L’ARN est complexé à la nucléoprotéine N. Pour être fonctionnelle, la polymérase virale L a besoin d’être intégrée dans un complexe de transcription formé par les protéines N, P et L. Les protéines non structurales V et C jouent un rôle dans l’immunosuppression induite par le virus. (→) Voir la Nouvelle de M. Mateo et M. Lopez, page 363 de ce numéro
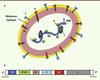 | Figure 1.
Le virus de la rougeole. A. Représentation schématique. L’enveloppe est constituée par la membrane lipidique tapissée par la matrice (protéine M), les glycoprotéines H (se liant aux récepteurs cellulaires du virus) et les protéines de fusion F. La nucléocapside est constituée de l’ARN viral encapsidé dans un polymère de nucléoprotéines N auquel sont associées les phosphoprotéines P et les polymérases virales L. B. Représentation du génome viral. Les six gènes N, P, M, M, H et L sont représentés. Le gène P code pour la protéine P mais aussi pour les protéines non structurales V et C. |
|
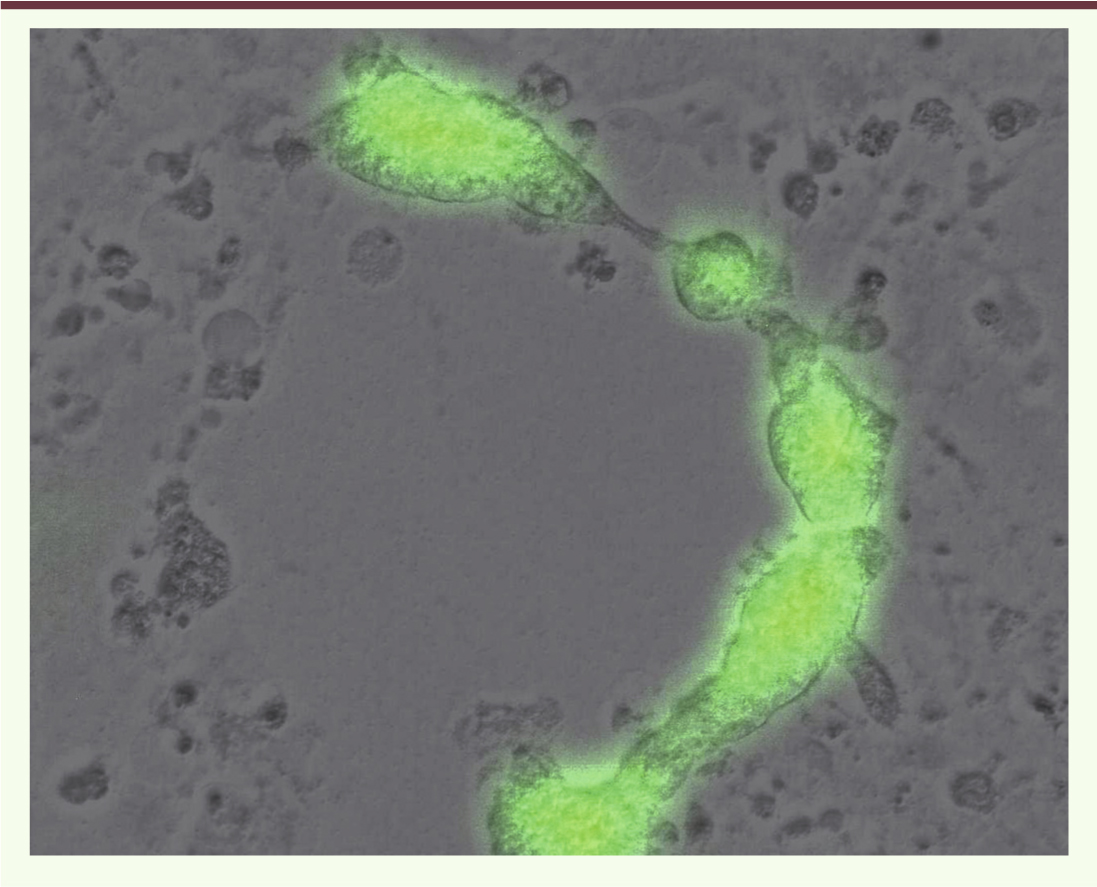
Justification de l’utilisation du virus de la rougeole en cancérologie L’infection par le virus de la rougeole entraîne la fusion de la cellule infectée avec des cellules voisines pour former des cellules géantes multinucléées (syncytium) pouvant contenir une centaine de noyaux (Figure 2). Les cellules infectées meurent ensuite par apoptose. Dans les années 1970, plusieurs cas de régression de lymphomes après une infection rougeoleuse ont été publiés [5–8], suscitant un intérêt pour l’utilisation du virus dans un but thérapeutique (→) [41]. Une étude clinique de phase 1 a inclus cinq patients atteints d’un lymphome cutané T qui ont été traités par injections intratumorales de virus de la rougeole (souche Edmonston-Zagreb) après un prétraitement systémique par l’interféron-α. La réponse au traitement a été mineure chez un patient, partielle chez trois patients, et complète chez le dernier [9]. Ces résultats ont été obtenus avec de faibles doses de virus associées à un traitement par interféron visant à limiter la propagation virale. Même si le faible effectif de patients et/ou le traitement par interféron avaient pu biaiser les conclusions, cette étude a suscité un grand intérêt. Plus récemment, l’utilisation du virus de la rougeole codant pour l’antigène carcinoembryonnaire (MeV-ACE) a été testée cliniquement. Une étude de phase 1 a inclus 21 patientes ayant un cancer de l’ovaire progressif, en échec thérapeutique après chimiothérapie par l’association paclitaxel et sels de platine (tumeur persistante ou récurrente). Les patientes ont été traitées par injections intrapéritonéales répétées de MeV-ACE. L’ACE a été détecté dans le liquide péritonéal chez trois patientes. Une élévation de la concentration d’ACE a été mesurée dans le sang chez les trois patientes traitées avec les plus fortes doses. Aucune toxicité limitante n’a été observée et la survie médiane a été de 12 mois, avec un effet bénéfique variable selon la dose virale. Il y a eu neuf stabilisations tumorales chez les neuf patientes traitées avec les plus fortes doses, et cinq chez les 12 patientes traitées avec les faibles doses [10]. Ces données cliniques soulignent la bonne tolérance du traitement et encouragent la poursuite des recherches sur l’utilisation du virus de la rougeole. (→) Voir l’éditorial de G. Lemay, page 339 de ce numéro
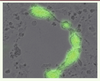 | Figure 2. Effet cytopathique du virus de la rougeole MV-GFP dans des cellules cancéreuses en culture. Image de la fusion de multiples cellules (syncytium) en microscopie optique et en fluorescence pour visualiser l’expression du transgène codant pour la GFP (green fluorescent protein). |
La sélectivité de l’infection virale pour les cellules cancéreuses est primordiale pour justifier de l’utilisation du virus comme agent thérapeutique. Le virus sauvage de la rougeole se lie au récepteur cellulaire CD150 ou SLAM (signaling lymphocyte activation molecule) qui est spécifiquement exprimé à la surface des lymphocytes B et T, expliquant ainsi le lymphotropisme primaire du virus [11]. Les souches vaccinales du virus de la rougeole dérivées de la souche d’Edmonston se lient, elles, préférentiellement au récepteur cellulaire CD46 [12]. CD46 est exprimé à la surface de toutes les cellules nucléées. Cependant, il est surexprimé à la surface des cellules cancéreuses ce qui pourrait expliquer la sélectivité du virus pour les cellules cancéreuses et l’intérêt de cette surexpression pour l’utilisation thérapeutique des souches vaccinales en cancérologie [13]. En 2011, un autre récepteur cellulaire du virus sauvage a été identifié. En effet, la protéine de jonction intercellulaire PVLR4 (poliovirus-receptor-like-4), aussi nommée nectine-4, peut lier le virus (→) [40]. (→) Voir la Nouvelle de M. Mateo et M. Lopez, page 363 de ce numéro Elle est exprimée à la surface des cellules épithéliales, notamment trachéales, ce qui explique le tropisme épithélial secondaire du virus. Elle est aussi surexprimée à la surface des cellules cancéreuses pulmonaires, mammaires, coliques et ovariennes. Cette surexpression peut donc, en partie, expliquer la sélectivité tumorale de l’infection par le virus de la rougeole [3, 4]. Les souches du virus de la rougeole peuvent donc avoir une sélectivité pour les cellules tumorales et exercer un effet cytotoxique principalement au niveau des cellules cancéreuses. Pour envisager une utilisation clinique du virus, plusieurs difficultés doivent cependant être surmontées, comme nous le discutons ci-dessous. |
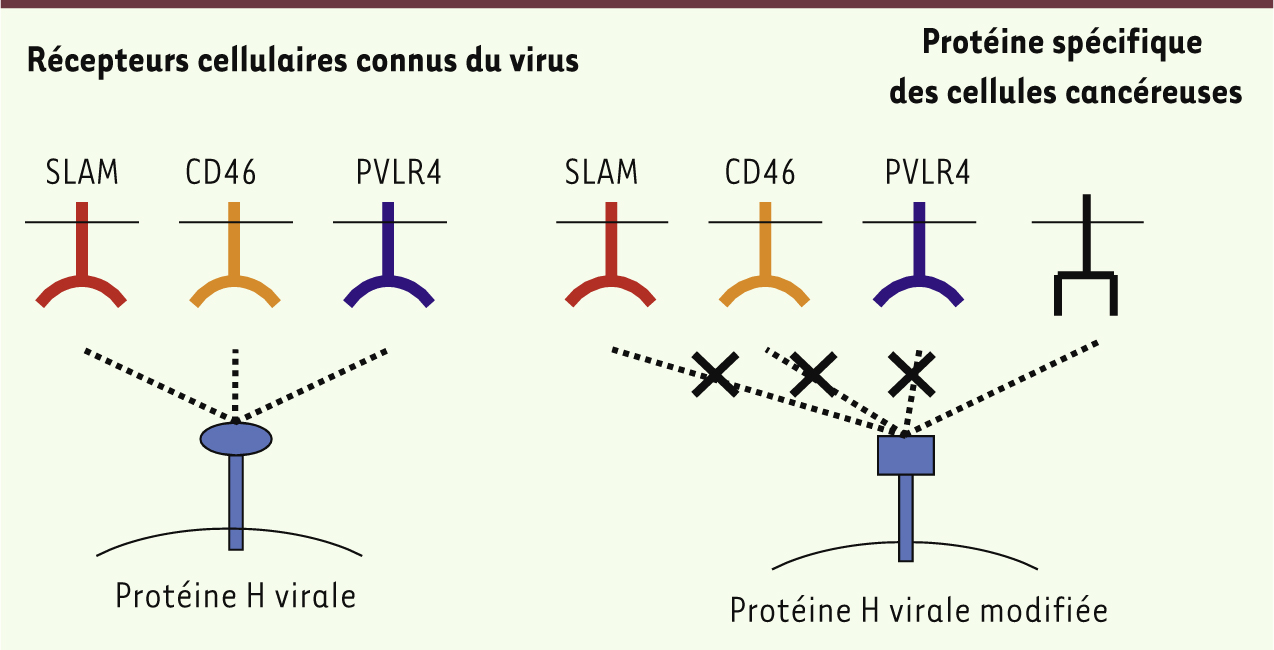
Les enjeux d’une utilisation du virus de la rougeole en cancérologie Améliorer la sélectivité antitumorale Modification de la liaison aux récepteurs (protéine H) La capacité de liaison de la protéine virale H aux récepteurs cellulaires est fondamentale pour la sélectivité de l’infection. Des modifications de cette protéine H peuvent donc améliorer la spécificité de liaison du virus en lui permettant de reconnaître de nouvelles cellules cibles avec ou sans perte d’utilisation des récepteurs CD150/SLAM, CD46 et nectine-4 (Figure 3). Ainsi, des modifications de la protéine H ont permis sa liaison au récepteur PSCA ( prostate stem cell antigen) exprimé sur les cellules cancéreuses prostatiques et pancréatiques [ 14], au prostate- specific membrane antigen (PSMA) surexprimé sur les cellules prostatiques [ 19], à l’ACE exprimé sur les cellules cancéreuses coliques [ 15], au CD20 exprimé par les cellules lymphomateuses [ 16], à une forme mutante (EGFRvIII) du récepteur à l’EGF ( epidermal growth factor) ou au récepteur de l’interleukine-13, tous deux surexprimés par les cellules de gliome [ 17, 18]. Ces changements de la spécificité de reconnaissance par le virus des cellules cibles doit permettre d’augmenter la sécurité du traitement.
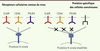 | Figure 3.
Modification de la spécificité de liaison du virus de la rougeole. Les récepteurs connus du virus de la rougeole sont la protéine CD150 ou SLAM (exprimée à la surface de lymphocytes B et T), la protéine CD46 (exprimée à la surface des cellules nucléées, surexprimée dans les cellules cancéreuses) et la protéine PVLR4 (surexprimée dans les tumeurs épithéliales). Pour cibler le virus spécifiquement au sein d’une population cellulaire cancéreuse, la protéine virale H est modifiée afin de se lier à une nouvelle protéine spécifique exprimée à la surface des cellules tumorales. L’acquisition de cette nouvelle propriété peut s’accompagner d’une perte de la liaison de la protéine H à ses récepteurs originels. |
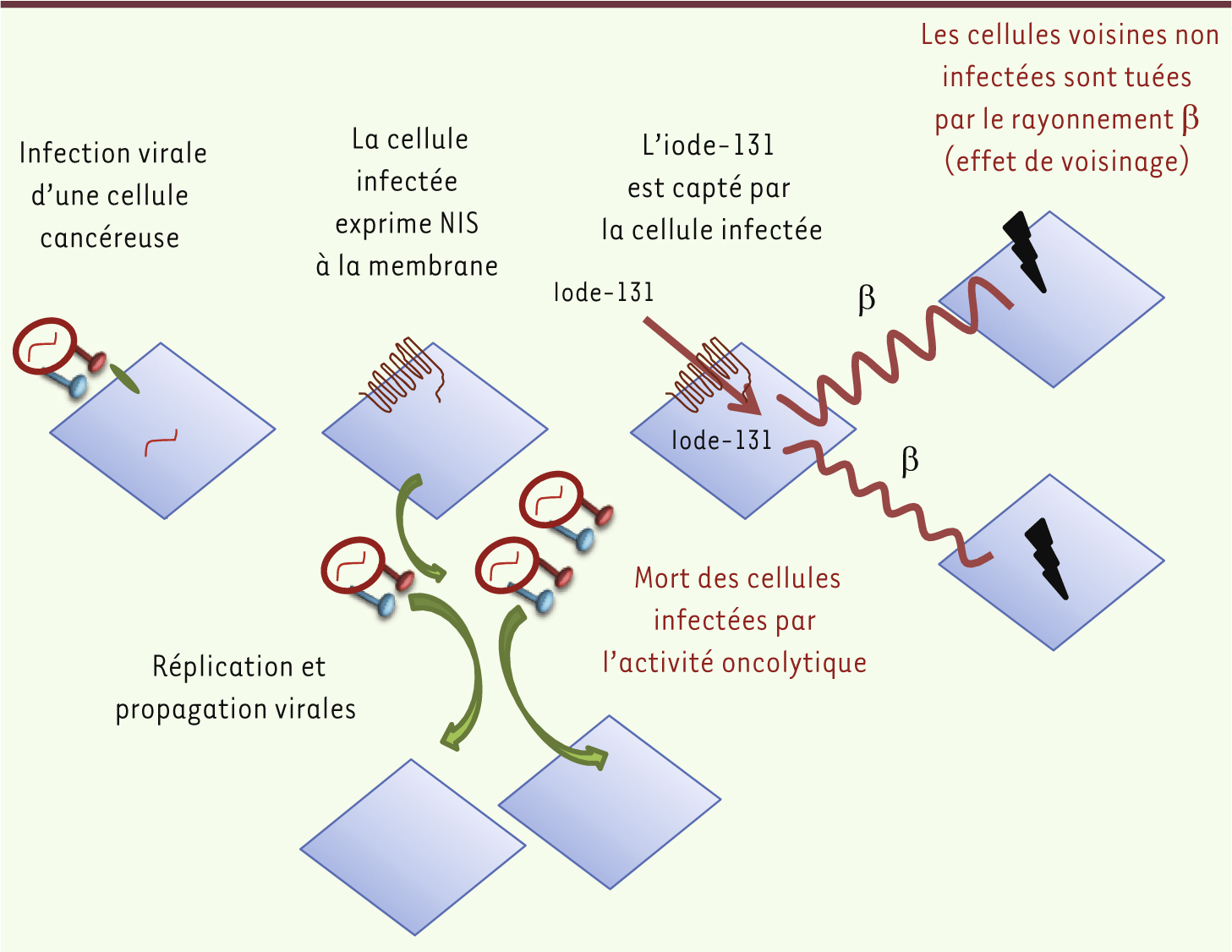
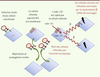 | Figure 4.
Illustration du principe de la radiovirothérapie.
|
Le virus de la rougeole se lie exclusivement à des récepteurs humains, ce qui complique l’étude de sa toxicité chez des animaux qui n’expriment pas de récepteurs pour le virus. Des souris transgéniques exprimant CD46 humain ont été créées pour passer outre cet obstacle, mais la réponse immunitaire innée de la souris est une seconde difficulté car elle peut empêcher l’infection virale. Des souris dépourvues de récepteur de l’interféron, incapables de répondre à ce médiateur de l’immunité innée, ont donc été créées. L’infection virale devient possible, mais l’absence du contrôle physiologique par l’immunité innée peut surestimer la toxicité du virus. Par exemple, dans un modèle de glioblastome chez des souris exprimant CD46 et n’exprimant pas le récepteur à l’interféron, l’injection intracérébrale du virus a entraîné une neurotoxicité majeure. Une modification de ce modèle a été créée : une séquence de type interleukine 13 a été introduite à l’extrémité carboxy-terminale de la protéine H ; comme les cellules de glioblastome surexpriment le récepteur à l’interleukine 13, le virus se liera de façon préférentielle aux cellules tumorales. Dans ce modèle, les animaux traités avec ce virus modifié n’ont présenté aucun signe de toxicité [18]. Modifications de l’activation de la protéine F D’autres méthodes d’amélioration de la sélectivité ont également été évaluées. Les cellules cancéreuses sécrètent souvent des métalloprotéases dans la matrice extracellulaire. Un virus a donc été modifié pour que l’activation de sa protéine F soit dépendante des métalloprotéases sécrétées par les cellules cancéreuses. Comme précédemment, ce virus a une efficacité antitumorale comparable à celle d’un virus non modifié dans un modèle de fibrosarcome, mais n’exerce aucune neurotoxicité dans les souris transgéniques exprimant le CD46 mais dépourvues de récepteur à l’interféron [ 20]. Sélectivité de l’expression du miARN-7 Une autre approche pour majorer la sélectivité du virus a été décrite dans un modèle de glioblastome. L’ARN interférent microARN-7 est régulé négativement dans les cellules de gliome, mais pas dans le tissu cérébral normal. Un virus de la rougeole a été modifié pour que l’expression des gènes viraux et la réplication soient particulièrement sensibles au miARN-7. L’effet du virus est très atténué dans des cellules normales, mais reste intact dans des xénogreffes de glioblastome [ 21]. Limiter le risque de propagation virale Les manipulations du virus peuvent permettre d’améliorer la sélectivité antitumorale pour épargner les cellules saines, mais doivent aussi permettre de limiter la propagation virale à l’entourage du patient traité. L’excrétion de virus infectieux dans les voies respiratoires a été rapportée au moins une fois après vaccination [ 22], d’où un risque potentiel de contagion. Si le risque pour un entourage sain est dérisoire en cas de vaccination, l’administration à visée thérapeutique de fortes doses de virus présente un risque que l’on ne peut ignorer en milieu hospitalier (notamment en cas de contact avec des malades immunodéprimés). Pour empêcher l’excrétion du virus, des mutations délétères pour la liaison du virus au récepteur nectine-4 ont été introduites dans la glycoprotéine H. Le virus muté est incapable d’infecter les cellules épithéliales, prévenant ainsi tout risque de contagion (comme cela a été démontré chez le singe) [ 23]. Contourner l’immunité antivirale S’immuniser contre le virus de la rougeole - via une vaccination ou une infection - pourrait limiter l’efficacité du traitement viral. Trouver des moyens d’échapper à cette immunité est donc essentiel pour développer cette stratégie d’avenir. Transmission du virus via des cellules messagères Incorporer le virus dans une cellule elle-même capable de cibler les cellules cancéreuses est une approche en cours d’évaluation. Ainsi, des monocytes ou des cellules endothéliales infectés par le virus de la rougeole peuvent délivrer le virus aux cellules tumorales avec lesquelles elles vont fusionner (hétérofusion). L’efficacité du traitement viral en cas d’immunisation préexistante peut être évaluée chez des souris passivement immunisées par injection, avant le traitement, de sérum ou d’anticorps neutralisant le virus. Dans un modèle murin de tumeur péritonéale disséminée (greffe de cellules d’hépatome humain HuH7) et de traitement par injections intrapéritonéales du virus, la préincubation du virus avec des anticorps neutralisants abolissait l’infection des tumeurs. En revanche, si le virus était introduit dans des monocytes U-9370 ou dans des cellules endothéliales, l’infection était efficace, même en présence d’anticorps neutralisants [ 24]. Dans un autre modèle de tumeur péritonéale (par greffe de cellules épithéliales ovariennes d’adénocarcinome SKOV3ip.1) induit chez des souris athymiques mais passivement immunisées par injection de sérum antivirus de la rougeole, l’injection intrapéritonéale de cellules souches mésenchymateuses infectées par le virus a permis d’augmenter la survie des souris, contrairement au traitement par le virus seul ou les cellules souches non infectées [ 25]. Plus récemment, des cellules myélomateuses létalement irradiées ont cependant pu être infectées par un virus de la rougeole. Elles ont ensuite pu transmettre le vecteur viral à des cellules de myélome malgré la présence de sérum immun contre le virus de la rougeole. In vivo, dans un modèle de myélome, l’injection intraveineuse du virus n’a eu d’efficacité antitumorale que chez les souris non immunisées. En revanche, l’injection de cellules myélomateuses irradiées infectées par le virus a eu une activité antitumorale chez les souris, qu’elles soient ou non immunisées [ 26]. Association virus et traitement immunosuppresseur Une autre stratégie consiste à associer le traitement viral à un traitement immunosuppresseur. Le cyclophosphamide a montré sa capacité à prolonger l’expression de gènes viraux [ 27]. Dans un modèle murin d’adénocarcinome colique, l’association de cyclophosphamide au virus de la rougeole armé d’un gène suicide a permis de retarder l’apparition d’anticorps neutralisant le virus et d’augmenter la réponse antitumorale jusqu’à obtenir 90 % de réponse complète [ 15]. Une stratégie combinant virus de la rougeole et cyclophosphamide a été évaluée dans une étude préclinique du traitement du myélome [ 28] et un essai clinique de phase 1 est en cours à la Mayo Clinic. Cependant, un cas d’encéphalite aiguë à inclusions a été décrit chez un enfant immunodéprimé ayant reçu une dose vaccinale de virus rougeoleux [ 29]. Il faudra donc sécuriser ce traitement en augmentant par exemple la sélectivité virale. Échappement à la réponse immune par modification de la protéine H Une autre méthode innovante d’échappement au système immunitaire a été récemment décrite. L’enveloppe du virus a pu être modifiée en remplaçant la glycoprotéine originelle H par une glycoprotéine d’un paramyxovirus du chien, le virus de la maladie de Carré. Ce virus pouvait échapper à la neutralisation par des anticorps dirigés contre le virus de rougeole [ 30]. Quelle place dans la stratégie thérapeutique anticancéreuse ? Les modalités optimales du traitement restent à définir. Les injections peuvent être locales (intratumorales), intrapéritonéales, ou systémiques (intraveineuses). Les injections intratumorales sont fréquemment utilisées dans les études précliniques pour leur facilité de réalisation. En clinique, elles peuvent être rendues difficiles ou impossibles par la localisation tumorale, et il est difficile de répéter des injections qui requièrent une anesthésie générale. Elles peuvent cependant être particulièrement intéressantes en cas de tumeurs facilement accessibles. De plus, des effets antitumoraux à distance des tumeurs dans lesquelles le virus a été injecté ont été démontrés dans des essais cliniques utilisant les virus oncolytiques de l’herpès ou de la vaccine [ 31, 32]. Des injections intratumorales pourraient donc rester intéressantes même en cas de maladie disséminée. La voie d’injection systémique a montré une bonne sécurité d’emploi avec différents virus oncolytiques. Elle est donc prometteuse, notamment pour les tumeurs non accessibles ou disséminées. La place du traitement viral dans la stratégie thérapeutique reste également à préciser : elle peut s’intégrer comme une stratégie adjuvante ou néo-adjuvante (précédant une chirurgie) ou dans le cas de maladies non opérables. De nombreuses études précliniques ont démontré l’intérêt d’associer une thérapie virale à une chimiothérapie ou une radiothérapie. La chimiothérapie, en plus de l’effet immunosuppresseur discuté précédemment, peut agir en synergie avec les thérapies virales [33]. Cette synergie peut par ailleurs être utilisée dans des stratégies de gène suicide. Dans cette approche, un gène codant pour une protéine convertissant une prodrogue inactive en métabolite actif dans la cellule infectée est inseré dans le génome viral. Ainsi, dans un modèle de gliome, un virus de la rougeole a été doublement modifié : d’une part, pour exprimer la purine nucléoside phosphorylase, une enzyme qui convertit la fludarabine en médicament actif et, d’autre part, pour cibler spécifiquement les cellules exprimant l’antigène CD20. Dans un modèle de lymphome du manteau, l’effet oncolytique a été augmenté chez les souris prétraitées par le cyclophosphamide et la réponse tumorale a été complète chez tous les animaux recevant ce protocole suivi d’un troisième traitement par fludarabine [34]. Dans une autre étude, un virus de la rougeole a été doublement modifié : d’une part, pour exprimer la purine nucléoside phosphorylase et, d’autre part, pour se lier spécifiquement à un antigène de cellules souches de prostate (PSCA), exprimé à la surface des cellules de cancer de prostate et des cellules d’adénocarcinome pancréatique. Ce virus peut infecter sélectivement les cellules cancéreuses pancréatiques, que l’expression de PSCA soit faible ou élevée. In vivo, le traitement avec la fludarabine potentialise l’effet thérapeutique du virus, y compris dans des cellules résistantes à la gemcitabine. Comme l’antigène PSCA est également exprimé sur les cellules cancéreuses pancréatiques, ce virus a donc été modifié pour augmenter sa sélectivité vis-à-vis des cellules cancéreuses pancréatiques et exprimer un gène suicide (le rendant plus toxique) [14]. La radiothérapie peut également avoir un effet synergique en accroissant l’entrée des virus dans les cellules, la réplication virale et l’expression des gènes viraux. Réciproquement, les virus peuvent sensibiliser les tumeurs vis-à-vis de la radiothérapie [35]. Un virus de la rougeole exprimant ACE a été utilisé en association avec une irradiation dans un modèle de glioblastome, association qui a eu un effet antitumoral synergique. Une irradiation de 12 Gy associée à des injections intraveineuses du virus a permis d’obtenir des régressions tumorales, contrairement au traitement viral seul ou à la radiothérapie seule. Une rémission complète à long terme a été observée chez cinq souris sur dix, et la survie était meilleure en cas de combinaison thérapeutique. L’irradiation a augmenté l’expression de protéines virales (protéines M et H) et d’ACE, ainsi que la réplication virale [36]. Les mécanismes de ces interactions restent actuellement mal connus. Un virus de la rougeole porteur du gène codant pour le symporteur sodium/iodure (NIS) a aussi été créé (MeV-NIS). NIS est une protéine membranaire permettant l’entrée d’anions monovalents dans la cellule. En plus de l’entrée d’ions iodure dans les cellules comme dans la thyroïde, elle permet, d’une part, l’entrée de radioisotopes qui peuvent être utilisés en imagerie in vivo (iode-123, iode-124, iode-125, iode-131, technétium-99m) et, d’autre part, l’entrée de radioisotopes qui peuvent être utilisés dans un but thérapeutique (iode-131, rhénium-186, rhénium-188, astate-211) (Figure 3). En fonction de l’isotope, l’imagerie peut être réalisée par scintigraphie, par tomographie par émission de positons (TEP) ou par tomographie d’émission monophotonique (TEMP). La stratégie thérapeutique qui associe MeV-NIS et traitement radio-isotopique (iode-131) vectorisé par le NIS a montré un effet synergique in vivo dans des modèles de myélome [37] et de cancer de prostate [38]. À l’inverse, dans un modèle de cancer du pancréas, cette synergie n’a pu être observée, probablement en raison d’une distribution insuffisamment homogène, de l’infection et de la réplication virale dans les tumeurs, mais aussi en raison de la radiorésistance des cellules cancéreuses pancréatiques [39]. |
L’utilisation du virus de la rougeole comme traitement anticancéreux est prometteuse. L’utilisation de souches atténuées en vaccination a permis de s’assurer de leur bonne tolérance et de leur sécurité d’utilisation, atouts primordiaux dans le domaine de la thérapie virale ou génique. La sélectivité tumorale est essentielle pour l’efficacité et la sécurité de certaines souches atténuées, et cette sélectivité peut encore être améliorée en contrôlant les capacités de liaison du virus avec ses récepteurs cellulaires. L’immunité antivirale est un des principaux obstacles à surmonter. L’association à un traitement immunosuppresseur est une voie prometteuse et un essai clinique est en cours. La sécurité de cette approche devra également être assurée. D’une manière plus générale, les virus oncolytiques pourraient être mieux utilisés en association avec d’autres traitements comme la chimiothérapie et la radiothérapie, puisque ces combinaisons ont montré des effets antitumoraux synergiques. De plus, le virus de la rougeole a été modifié pour incorporer le gène NIS, ouvrant la voie à des associations de thérapie virale et de traitement radioisotopique sélectif. Les prochains essais cliniques devront probablement étudier ces différentes combinaisons thérapeutiques. Ces avancées permettent d’espérer des applications cliniques, bien qu’elles soient difficiles à envisager avant plusieurs années compte tenu du temps nécessaire à leur préparation et à la réalisation des essais cliniques. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Global measles mortality, 2000–2008 . Morb Mortal Wkly Rep. 2009; ; 58 : :1321.–1326. 2. Enders JF, Peebles TC. Propagation in tissue cultures of cytopathogenic agents from patients with measles . Proc Soc Exp Biol Med. 1954; ; 86 : :277.–286. 3. Muhlebach MD, Mateo M, Sinn PL, et al. Adherens junction protein nectin-4 is the epithelial receptor for measles virus . Nature. 2011; ; 480 : :530.–533. 4. Noyce RS, Bondre DG, Ha MN, et al. Tumor cell marker PVRL4 (nectin 4) is an epithelial cell receptor for measles virus . PLoS Pathog. 2011; ; 7 : :e1002240.. 5. Bluming AZ, Ziegler JL. Regression of Burkitt’s lymphoma in association with measles infection . Lancet. 1971; ; 2 : :105.–106. 6. Mota HC., Infantile Hodgkin’s disease: remission after measles . Br Med J. 1973; ; 2 : :421.. 7. Taqi AM, Abdurrahman MB, Yakubu AM, Fleming AF., Regression of Hodgkin’s disease after measles . Lancet. 1981; ; 1 : :1112.. 8. Zygiert Z., Hodgkin’s disease: remissions after measles .Lancet. 1971; ; 1 : :593.. 9. Heinzerling L, Kunzi V, Oberholzer PA, et al. Oncolytic measles virus in cutaneous T-cell lymphomas mounts antitumor immune responses in vivo and targets interferon-resistant tumor cells . Blood. 2005; ; 106 : :2287.–2294. 10. Galanis E, Hartmann LC, Cliby WA, et al. Phase I Trial of intraperitoneal administration of an oncolytic measles virus strain engineered to express carcinoembryonic antigen for recurrent ovarian cancer . Cancer Res. 2010; ; 70 : :875.–882. 11. Dhiman N, Jacobson RM, Poland GA. Measles virus receptors: SLAM and CD46 . Rev Med Virol. 2004; ; 14 : :217.–229. 12. Dorig RE, Marcil A, Chopra A, Richardson CD. The human CD46 molecule is a receptor for measles virus (Edmonston strain) . Cell. 1993; ; 75 : :295.–305. 13. Anderson BD, Nakamura T, Russell SJ, Peng KW. High CD46 receptor density determines preferential killing of tumor cells by oncolytic measles virus . Cancer Res. 2004; ; 64 : :4919.–4926. 14. Bossow S, Grossardt C, Temme A, et al. Armed and targeted measles virus for chemovirotherapy of pancreatic cancer . Cancer Gene Ther. 2011; ; 18 : :598.–608. 15. Ungerechts G, Springfeld C, Frenzke ME, et al. An immunocompetent murine model for oncolysis with an armed and targeted measles virus . Mol Ther. 2007; ; 15 : :1991.–1997. 16. Ungerechts G, Springfeld C, Frenzke ME, et al. Lymphoma chemovirotherapy: CD20-targeted and convertase-armed measles virus can synergize with fludarabine . Cancer Res. 2007; ; 67 : :10939.–10947. 17. Allen C, Vongpunsawad S, Nakamura T, et al. Retargeted oncolytic measles strains entering via the EGFRvIII receptor maintain significant antitumor activity against gliomas with increased tumor specificity . Cancer Res. 2006; ; 66 : :11840.–11850. 18. Allen C, Paraskevakou G, Liu C, et al. Oncolytic measles virus strains in the treatment of gliomas . Expert Opin Biol Ther. 2008; ; 8 : :213.–220. 19. Liu C, Hasegawa K, Russell SJ, et al. Prostate-specific membrane antigen retargeted measles virotherapy for the treatment of prostate cancer . Prostate. 2009; ; 69 : :1128.–1141. 20. Springfeld C, von Messling V, Frenzke M, et al. Oncolytic efficacy and enhanced safety of measles virus activated by tumor-secreted matrix metalloproteinases . Cancer Res. 2006; ; 66 : :7694.–7700. 21. Leber MF, Bossow S, Leonard VH, et al. MicroRNA-sensitive oncolytic measles viruses for cancer-specific vector tropism . Mol Ther. 2011; ; 19 : :1097.–1106. 22. Morfin F, Beguin A, Lina B, Thouvenot D. Detection of measles vaccine in the throat of a vaccinated child . Vaccine. 2002; ; 20 : :1541.–1543. 23. Leonard VH, Sinn PL, Hodge G, et al. Measles virus blind to its epithelial cell receptor remains virulent in rhesus monkeys but cannot cross the airway epithelium and is not shed . J Clin Invest. 2008; ; 118 : :2448.–2458. 24. Iankov ID, Blechacz B, Liu C, et al. Infected cell carriers: a new strategy for systemic delivery of oncolytic measles viruses in cancer virotherapy . Mol Ther. 2007; ; 15 : :114.–122. 25. Mader EK, Maeyama Y, Lin Y, et al. Mesenchymal stem cell carriers protect oncolytic measles viruses from antibody neutralization in an orthotopic ovarian cancer therapy model . Clin Cancer Res. 2009; ; 15 : :7246.–7255. 26. Liu C, Russell SJ, Peng KW. Systemic therapy of disseminated myeloma in passively immunized mice using measles virus-infected cell carriers . Mol Ther. 2010; ; 18 : :1155.–1164. 27. Lamfers ML, Fulci G, Gianni D, et al. Cyclophosphamide increases transgene expression mediated by an oncolytic adenovirus in glioma-bearing mice monitored by bioluminescence imaging . Mol Ther. 2006; ; 14 : :779.–788. 28. Myers RM, Greiner SM, Harvey ME, et al. Preclinical pharmacology and toxicology of intravenous MV-NIS, an oncolytic measles virus administered with or without cyclophosphamide . Clin Pharmacol Ther. 2007; ; 82 : :700.–710. 29. Bitnun A, Shannon P, Durward A, et al. Measles inclusion-body encephalitis caused by the vaccine strain of measles virus . Clin Infect Dis. 1999; ; 29 : :855.–861. 30. Miest TS, Yaiw KC, Frenzke M, et al. Envelope-chimeric entry-targeted measles virus escapes neutralization and achieves oncolysis . Mol Ther. 2011; ; 19 : :1813.–1820. 31. Senzer NN, Kaufman HL, Amatruda T, et al. Phase II clinical trial of a granulocyte-macrophage colony-stimulating factor-encoding, second-generation oncolytic herpesvirus in patients with unresectable metastatic melanoma . J Clin Oncol. 2009; ; 27 : :5763.–5771. 32. Park BH, Hwang T, Liu TC, et al. Use of a targeted oncolytic poxvirus, JX-594, in patients with refractory primary or metastatic liver cancer: a phase I trial . Lancet Oncol. 2008; ; 9 : :533.–542. 33. Ottolino-Perry K, Diallo JS, Lichty BD, et al. Intelligent design: combination therapy with oncolytic viruses . Mol Ther. 2010; ; 18 : :251.–263. 34. Ungerechts G, Frenzke ME, Yaiw KC, et al. Mantle cell lymphoma salvage regimen: synergy between a reprogrammed oncolytic virus and two chemotherapeutics . Gene Ther. 2010; ; 17 : :1506.–1516. 35. Touchefeu Y, Vassaux G, Harrington KJ. Oncolytic viruses in radiation oncology . Radiother Oncol. 2011; ; 99 : :262.–270. 36. Liu C, Sarkaria JN, Petell CA, et al. Combination of measles virus virotherapy and radiation therapy has synergistic activity in the treatment of glioblastoma multiforme . Clin Cancer Res. 2007; ; 13 : :7155.–7165. 37. Dingli D, Peng KW, Harvey ME, et al. Image-guided radiovirotherapy for multiple myeloma using a recombinant measles virus expressing the thyroidal sodium iodide symporter . Blood. 2004; ; 103 : :1641.–1646. 38. Msaouel P, Iankov ID, Allen C, et al. Noninvasive imaging and radiovirotherapy of prostate cancer using an oncolytic measles virus expressing the sodium iodide symporter . Mol Ther. 2009; ; 17 : :2041.–2048. 39. Penheiter AR, Wegman TR, Classic KL, et al. Sodium iodide symporter (NIS)-mediated radiovirotherapy for pancreatic cancer . Am J Roentgenol. 2010; ; 195 : :341.–349. 40. Mateo M, Lopez M. Nectine-4, une protéine clé pour la transmission du virus de la rougeole . Med Sci (Paris). 2012; ; 28 : :363.–365. 41. Lemay G. Apprivoiser nos ennemis pour en faire des alliés : la virothérapie anticancéreuse . Med Sci (Paris). 2012; ; 28 : :339.–340. |