| |
| Med Sci (Paris). 2012 May; 28(5): 465–468. Published online 2012 May 30. doi: 10.1051/medsci/2012285007.DCC : come back d’un gène suppresseur de tumeur controversé Laura Broutier1 and Marie Castets1* 1Laboratoire Apoptose, cancer et développement, équipe labellisée Ligue contre le cancer, centre de recherche en cancérologie de Lyon, Inserm U1052-CNRS UMR5286, université de Lyon, centre Léon Bérard, 28, rue Laënnec, 69008Lyon, France MeSH keywords: Adénocarcinome, génétique, anatomopathologie, Animaux, Apoptose, Tumeurs colorectales, Évolution de la maladie, Gènes DCC, physiologie, Gènes suppresseurs, Humains, Souris, Souris transgéniques, Modèles biologiques |
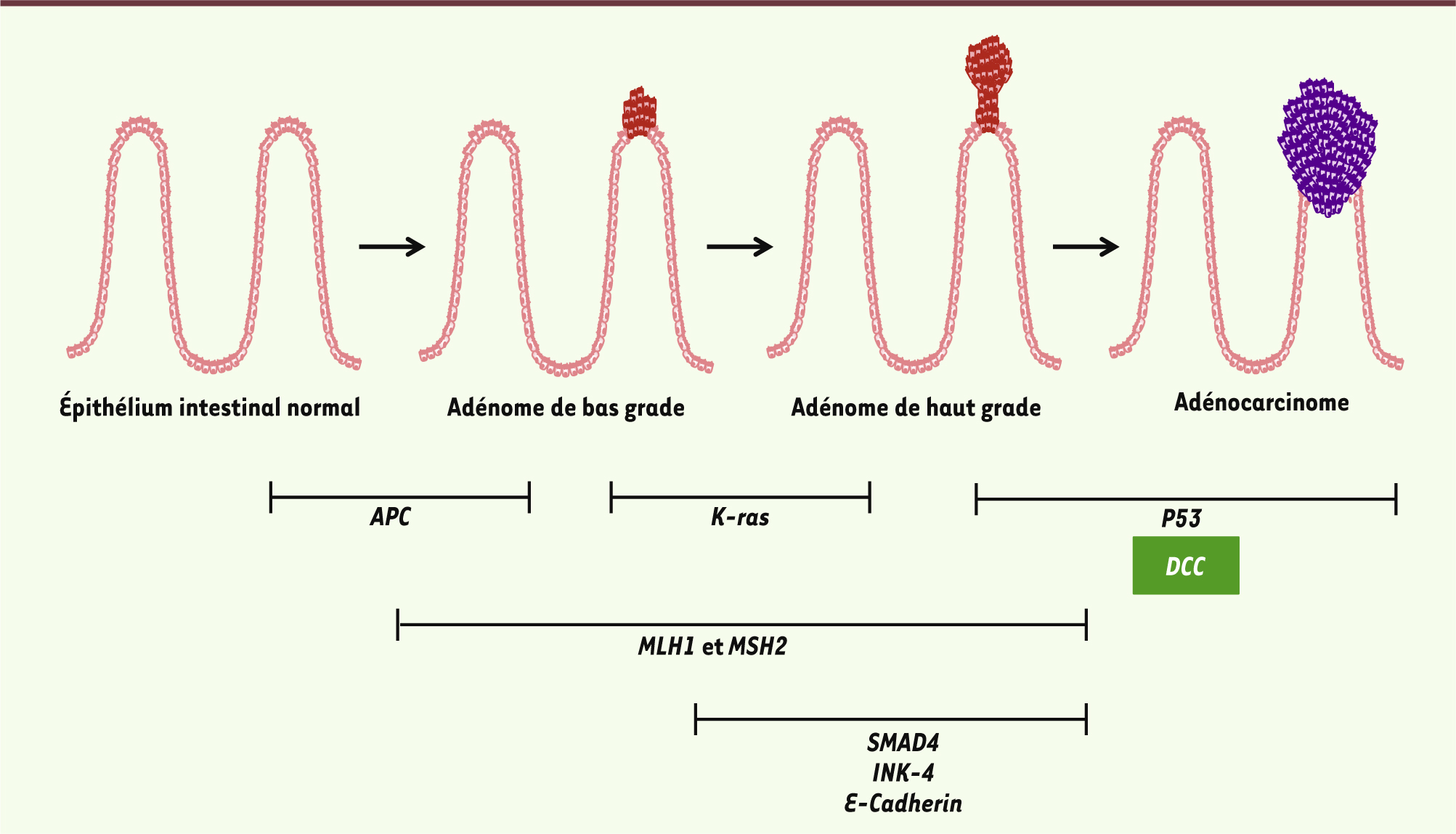
DCC dans les cancers colorectaux : entre vrai et faux-semblant DCC (deleted in colorectal carcinoma) est un récepteur transmembranaire apparenté aux protéines NCAM (neural cell adhesion molecule), essentiellement connu pour son rôle dans le développement du système nerveux. DCC est en effet le récepteur de la Nétrine-1 [1], protéine sécrétée de la famille des laminines, et impliquée dans le contrôle du guidage axonal et de la migration neuronale. Historiquement cependant, DCC a initialement été identifié en tant que gène suppresseur de tumeur potentiel, et impliqué notamment dans la survenue de cancers colorectaux [2]. Les cancers colorectaux figurent parmi les cancers les plus fréquents dans les pays occidentaux et constituent la seconde cause de mortalité par cancer. Ils résultent de la transformation maligne de cellules de l’épithélium intestinal. L’apparition d’adénomes, puis d’adénocarcinomes, résulte de l’altération séquentielle de l’expression d’oncogènes et de gènes suppresseurs de tumeurs intervenant dans la régulation de la prolifération, du maintien de l’intégrité génomique, de la migration ou de l’apoptose des cellules de l’épithélium intestinal [3]. Ainsi, l’invalidation du gène APC (adenomatous polyposis coli) est responsable de l’initiation tumorale, alors que l’acquisition d’altérations supplémentaires des gènes K-ras, p53 ou SMAD4 par exemple, intervient secondairement et favorise la progression tumorale [3] (Figure 1).
 | Figure 1.
Implication séquentielle d’altérations génétiques au cours de la tumorigenèse colorectale. Ce modèle, développé par Vogelstein [ 3], prédit que l’altération successive de l’expression de gènes suppresseurs de tumeurs et d’oncogènes intervient de manière séquentielle au cours de l’échappement tumoral. Ainsi, des mutations du gène APC suffisent à induire la formation de néoplasies intestinales, alors que des altérations des gènes K-ras ou SMAD4 entrent en jeu plus tardivement au cours de ce processus en favorisant la progression tumorale. Nos travaux confirment les données issues de l’analyse de biopsies humaines et indiquent que DCC joue principalement le rôle de gène suppresseur de tumeur en bloquant la transition adénome/carcinome au cours de la tumorigenèse colorectale. MLH1 et MSH2 : de la famille des gènes MMR ( mismatch repair), ils sont impliqués dans la réparation des mésappariements de l’ADN lors de la réplication, et sont mutés dans le syndrome de Lynch (prédisposition héréditaire au cancer colorectal). INK-4 : locus INK4A codant pour p16, un inhibiteur du cycle cellulaire. SMAD4 intervient dans la voie de signalisation du TGFβ ( transforming growth factor β). |
Le rôle de DCC en tant que gène candidat suppresseur de tumeur dans les cancers colorectaux avait été envisagé du fait de sa localisation chez l’homme au locus chromosomique 18q21, affecté par une perte d’hétérozygotie dans 70 % des adénocarcinomes colorectaux [2]. Des travaux ont montré que la surexpression de DCC dans des lignées cellulaires réduit leurs capacités tumorales, in vitro et in vivo dans des modèles murins de xénogreffes [4]. Néanmoins, la fonction suppresseur de tumeurs de DCC a par la suite été remise en cause [4]. En effet, si l’expression de DCC est réduite dans de nombreux cancers, le rôle causal de cette perte d’expression dans l’échappement tumoral n’a pas été clairement établi, en particulier faute de mécanismes susceptibles de l’expliquer [4]. De plus, si l’invalidation de Dcc à l’état homozygote (Dcc-/-) se traduit par des défauts majeurs de développement du système nerveux central, aboutissant à la mort des souris en période périnatale et empêchant de fait leur inclusion dans une étude de tumorigenèse, aucune prédisposition ni à l’initiation, ni à la progression tumorale n’a été observée chez les souris hétérozygotes Dcc+/- [5]. |
DCC : un récepteur à dépendance La possibilité d’une dualité fonctionnelle de DCC, susceptible d’expliquer son rôle sur la structuration du système nerveux et son implication dans l’échappement tumoral, a cependant émergé avec le développement du modèle des récepteurs à dépendance [6, 7]. DCC fait en effet partie de cette famille fonctionnelle comportant aujourd’hui 17 membres, présentant tous la particularité d’être capables d’induire deux signalisations intracellulaires [6, 8].
- En présence de leur ligand, les récepteurs à dépendance induisent une signalisation dite positive, aboutissant à la prolifération, la migration ou la différenciation des cellules, telle que la voie ERK/MAPkinases induite par exemple par le couple Nétrine-1/DCC au cours du développement du système nerveux.
- Mais, contrairement aux récepteurs classiques, les récepteurs à dépendance ne sont pas inactifs en absence de leur ligand, et déclenchent une signalisation dite négative aboutissant à la mort des cellules par apoptose. De par leur rôle proapoptotique, les récepteurs à dépendance constituent donc des gènes suppresseurs de tumeurs potentiels [6, 8].
|
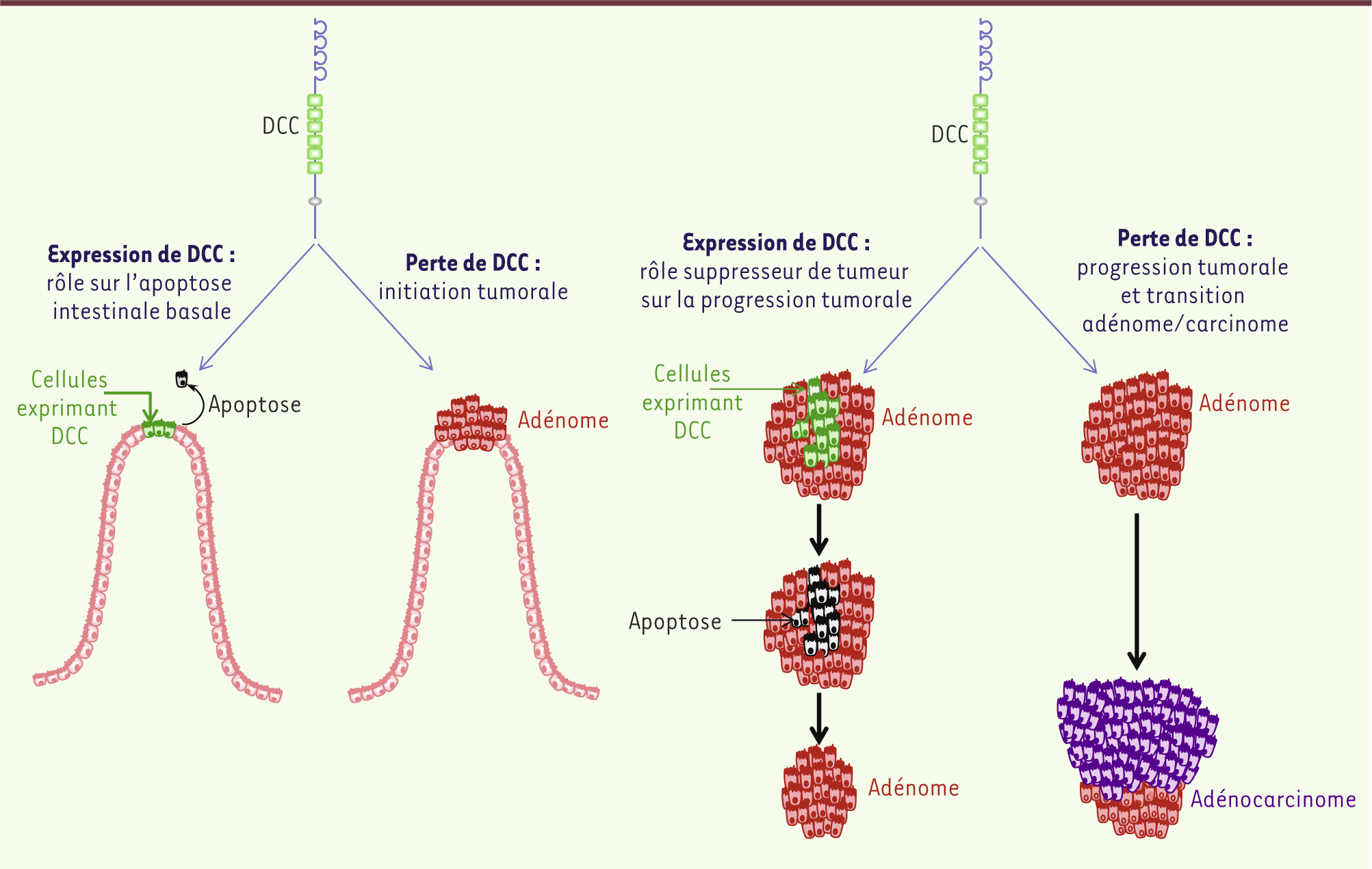
DCC, apoptose et progression tumorale : analyse d’un modèle murin transgénique Afin d’étudier spécifiquement le rôle de la voie de signalisation proapoptotique de DCC au cours de la tumorigenèse intestinale et de contourner le problème de la mortalité périnatale des souris Dcc-/-, nous avons développé un modèle murin qui présente une mutation ponctuelle du domaine intracellulaire de DCC (DCC-D1290N) [9]. Cette mutation ne modifie pas la signalisation positive induite en réponse à Nétrine-1, mais empêche le clivage de DCC par des caspases, étape nécessaire à l’initiation et à l’amplification de la cascade de signalisation proapoptotique induite par ce récepteur [9]. Contrairement aux souris Dcc-/-, les souris homozygotes pour la mutation DCC-D1290N (Dccmut/mut) sont viables. La mutation du site D1290N se traduit par une diminution de l’apoptose basale à l’extrémité des villosités intestinales des souris Dccmut/mut [7]. Cette apoptose dite spontanée participe au renouvellement de l’épithélium intestinal en permettant l’élimination des cellules épithéliales ayant réalisé l’ensemble du processus de prolifération/différenciation/migration depuis les cryptes jusqu’à l’apex des villosités [10]. La perturbation de ce processus apoptotique affecte l’homéostasie intestinale et pourrait, de ce fait, favoriser la survie de cellules ayant potentiellement accumulé des altérations génétiques, et ainsi conduire à l’échappement tumoral. De manière intéressante, les souris Dccmut/mut présentent ainsi une augmentation modérée de la propension à développer spontanément des tumeurs intestinales [9]. Chez l’homme, DCC est perdu dans près de 100 % des métastases hépatiques issues de cancers colorectaux, dans 70 % des cas d’adénocarcinomes mais rarement dans les adénomes de bas grade [8]. Ceci suggère que l’altération de l’expression de DCC intervient secondairement au cours du processus séquentiel d’accumulation de dysfonctionnements génétiques à l’origine de cancers colorectaux. Nous avons donc analysé l’effet de la mutation DCC-D1290N sur la progression tumorale, en croisant les souris DCC-D1290N avec des souris présentant une mutation ponctuelle du gène Apc, suffisante pour induire la formation de néoplasies. L’abolition de la signalisation proapoptotique induite par DCC se traduit par une augmentation majeure de l’incidence et de la fréquence de formation d’adénocarcinomes dans ce contexte génétique prédisposant, puisque 100 % des souris Dccmut/mut présentent des adénocarcinomes (contre 50 % des souris contrôles) [7]. De plus, le blocage de l’apoptose induite par DCC suffit à induire la transition vers des adénocarcinomes très invasifs avec effraction de la séreuse et aboutit même à la formation de micro-métastases hépatiques [9]. La comparaison quantitative de l’importance de l’apoptose dans des adénomes de souris DCC-D1290N mutantes et contrôles permet par ailleurs de proposer que DCC puisse limiter la transition adénomes/adénocarcinomes en induisant l’apoptose de cellules de tumeurs de bas grade, en excès par rapport à la disponibilité du ligand dans le milieu extracellulaire [9] (Figure 2).
 | Figure 2.
Modélisation du rôle de l’apoptose induite par DCC au cours de la tumorigenèse colorectale. DCC se comporte comme un suppresseur de tumeur en induisant l’apoptose des cellules en absence de son ligand Nétrine-1. Ce processus est susceptible d’intervenir à deux niveaux au cours de la tumorigenèse colorectale. En amont, il induit l’apoptose des cellules intestinales parvenues au sommet des villosités et participe de ce fait au renouvellement de l’épithélium intestinal. Le blocage de ce processus induit l’apparition, quoique limitée, de tumeurs intestinales chez la souris. En aval, il déclenche l’apoptose de cellules tumorales présentes en excès par rapport à la disponibilité de Nétrine-1 dans le milieu extracellulaire. DCC semble impliqué de manière majeure dans ce processus, puisque le blocage de sa signalisation proapoptotique déclenche la progression tumorale vers des adénocarcinomes de haut grade chez la souris. |
|
DCC : vers le come back d’un suppresseur de tumeur controversé ? L’analyse de ce modèle murin restaure donc l’idée que DCC puisse, via son activité proapoptotique, être un suppresseur de tumeur. Son absence favoriserait essentiellement la progression tumorale dans un contexte où l’échappement est induit par une première altération (Figure 1). Ces conclusions sont corroborées par une étude développée par le groupe de Berns, reposant sur l’analyse d’un modèle murin invalidé de manière conditionnelle pour l’expression de Dcc [11]. Cette stratégie alternative leur a permis d’observer que la perte de Dcc dans la glande mammaire favorise l’échappement métastatique dans un modèle de prédisposition génétique aux cancers du sein [11]. Il convient maintenant de vérifier la pertinence de ces résultats relativement au processus pathologique à l’origine de la survenue de cancers colorectaux chez l’homme, en déterminant notamment les bases mécanistiques à l’origine de l’altération de l’expression de DCC. Ces études relancent en tout cas l’intérêt suscité il y a près de 20 ans quant à l’implication de DCC en tant que gène suppresseur de tumeur et fournissent des pistes pour expliquer le rôle causal de sa perte d’expression dans la survenue de cancers. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1. Mehlen P, Rama N. Nétrine-1 et guidage axonal : signalisation et traduction asymétrique . Med Sci (Paris). 2007; ; 23 : :311.–315. 2. Fearon ER, Cho KR, Nigro JM, et al. Identification of a chromosome 18q gene that is altered in colorectal cancers . Science. 1990; ; 247 : :49.–56. 3. Kinzler KW, Vogelstein B. Lessons from hereditary colorectal cancer . Cell. 1996; ; 87 : :159.–170. 4. Fearon ER. DCC: is there a connection between tumorigenesis and cell guidance molecules? . Biochim Biophys Acta. 1996; ; 1288 : :M17.–M23. 5. Fazeli A, Dickinson SL, Hermiston ML, et al. Phenotype of mice lacking functional Deleted in colorectal cancer (Dcc) gene . Nature. 1997; ; 386 : :796.–804. 6. Mehlen P, Rabizadeh S, Snipas SJ, et al. The DCC gene product induces apoptosis by a mechanism requiring receptor proteolysis . Nature. 1998; ; 395 : :801.–804. 7. Mehlen P, Bonod-Bidaud C, Bordeaux MC, et al. La notion de récepteurs à dépendance, docteur Jekyll et M. Hyde . Med Sci (Paris). 2001 ; :744.–752. 8. Mehlen P, Fearon ER. Role of the dependence receptor DCC in colorectal cancer pathogenesis . J Clin Oncol. 2004; ; 22 : :3420.–3428. 9. Castets M, Broutier L, Molin Y, et al. DCC constrains tumour progression via its dependence receptor activity . Nature. 2011; ; 482 : :534.–537. 10. Watson AJ, Pritchard DM. Apoptosis in intestinal epithelium: lessons from transgenic and knockout mice . Am J Physiol Gastrointest Liver Physiol. 2000; ; 278 : :G1.–G5. 11. Krimpenfort P, Song JY, Proost N, et al. Deleted in colorectal carcinoma suppresses metastasis in p53-deficient mammary tumours . Nature. 2012; ; 482 : :538.–541. |